Журнал "Гастроэнтерология" Том 58, №1, 2024
Вернуться к номеру
Оксидативний стрес як один з патогенетичних механізмів виникнення гепатопульмонального синдрому у хворих на цироз печінки
Авторы: O.P. Faiura, S.Y. Tolopko, M.O. Abrahamovych, M.R. Ferko, Z.O. Bilous, S.I. Guta, O.O. Abrahamovych
Danylo Halytsky Lviv National Medical University, Lviv, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
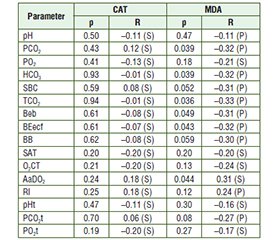
Актуальність. Гепатопульмональний синдром є однією з найбільш небезпечних синтропій у хворих на цироз печінки, а його патогенез потребує всебічного вивчення. Мета: з’ясувати роль оксидативного стресу, порушень кислотно-основної рівноваги та вентиляційно-перфузійних відношень як чинників гепатопульмонального синдрому у хворих на цироз печінки. Матеріали та методи. Гепатопульмональний синдром верифіковано в 44 осіб із цирозом печінки згідно з запатентованою методикою «Спосіб діагностики ступенів тяжкості гепатопульмонального синдрому у хворих на цироз печінки». Усім пацієнтам проведено дослідження газового складу венозної крові, її кислотно-основної рівноваги, активності каталази та малонового діальдегіду. Фактичний матеріал опрацьовано на персональному комп’ютері в програмах Exсel 2010, Statistica 6.0, RStudio v. 1.1.442 та R Commander v. 2.4-4. Результати. Аналізуючи показники газового складу крові залежно від класу цирозу печінки при груповому порівнянні, ми виявили вірогідність різниці для PCO2 (р = 0,03). Також з наростанням тяжкості цирозу печінки та збільшенням вмісту малонового діальдегіду рівень каталази зменшувався, підтверджуючи вплив оксидативного стресу на організм. Було виявлено вірогідний зворотний зв’язок між вмістом малонового діальдегіду та РCO2 (р = 0,039), HCO3 (р = 0,039), TCO2 (р = 0,036), Beb (р = 0,049), BEecf (р = 0,043), що пояснює виникнення гіпокапнії, частково компенсованого метаболічного ацидозу. Між рівнем малонового діальдегіду та AaDO2 зафіксовано пряму кореляцію (р = 0,044), що свідчить про наявність артеріовенозних легеневих шунтів, порушення вентиляційно-перфузійних відношень у хворих на цироз. Відсутність змін вмісту каталази можна, очевидно, пояснити тим, що її активність може суттєво не змінюватися, особливо на ранніх стадіях цирозу печінки, а підтримується компенсаторно. Висновки. У хворих на гепатопульмональний синдром відбувається інтенсифікація пероксидації зі збільшенням тяжкості цирозу печінки, що відображає дисбаланс у редокс-системі, призводить до порушення вентиляційно-перфузійних відношень та виникнення частково компенсованого метаболічного ацидозу.
Background. Hepatopulmonary syndrome is one of the most dangerous syntropies in case of liver cirrhosis. Consequently, it is important to determine the role of oxidative stress, acid-base balance and ventilation-perfusion disorders as factors of hepatopulmonary syndrome development in cirrhotic patients. Materials and methods. We included 44 cirrhotic patients with hepatopulmonary syndrome verified according to the patented Method for diagnosing degrees of hepatopulmonary syndrome severity in patients with liver cirrhosis. In addition to the traditional examinations, we determined the gas composition parameters in venous blood, acid-base balance parameters, catalase activity and malondialdehyde level in all the patients. The received material was processed on a personal computer using Excel 2010, Statistica 6.0, RStudio v. 1.1.442 and R Commander v. 2.4-4. Results. Analysis of blood gas parameters revealed the reliability of the difference for PCO2 (р = 0.03) depending on the class of liver cirrhosis severity. Also, with the liver cirrhosis severity increase, the malondialdehyde level increased, and catalase decreased. Moreover, significant inverse relationships between malondialdehyde content and PCO2 (p = 0.039), HCO3 (p = 0.039), TCO2 (p = 0.036), Beb (p = 0.049), BEecf (p = 0.043) were found resulting in hypocapnia and partially compensated metabolic acidosis. The found direct correlation between malondialdehyde level and AaDO2 (p = 0.044) indicates the arteriovenous pulmonary shunts, ventilation-perfusion disorders. The absence of catalase content changes can obviously be explained by the fact that its activity can be partially compensatory maintained. Conclusions. In patients with hepatopulmonary syndrome, the peroxidation activity enhances with an increase in the liver cirrhosis severity, resulting in the redox homeostasis imbalance, leading to the ventilation-perfusion disorders and partially compensated metabolic acidosis.
цироз печінки; гепатопульмональний синдром; внутрішньолегенева вазодилатація; оксидативний стрес; метаболічний ацидоз
liver cirrhosis; hepatopulmonary syndrome; intrapulmonary vasodilatation; oxidative stress; metabolic acidosis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Abarahamovych M.O., Abaramovych О.O., Fayura O.P., To–lopko S.Ya. Relation between redox homeostasis blood parameters in cirrhotic patients and endothelial dysfunction development. Gastroenterologica e Dietologica. 2020. 66(2). 98-105. doi: 10.23736/S1121-421X.20.02654-9.
- Fayura O.P., Abaramovych О.O., Abarahamovych M.O., To–lopko S.Ya., Fayura L.R., Ferko M.R. The effect of oxidative stress on the autonomic nervous system in patients with liver cirrhosis. Georgian Medical News. 2020. 1(298). 94-100.
- Benz F., Mohr R., Tacke F., Roderburg C. Pulmonary Complications in Patients with Liver Cirrhosis. J Transl Int Med. 2020. 8(3). 150-158. doi: 10.2478/jtim-2020-0024.
- Lange P.A., Stoller J.K. Hepatopulmonary syndrome in adults: Prevalence, causes, clinical manifestations, and diagnosis. Available from: https://www.uptodate.com/contents/hepatopulmonary-syndrome-in-adults-prevalence-causes-clinical-manifestations-and-diagnosis#H780152237.
- Gandhi K.D., Taweesedt P.T., Sharma M., Surani S. Hepatopulmonary syndrome: An update. World J Hepatol. 2021. 13(11). 1699-1706. doi: 10.4254/wjh.v13.i11.1699.
- Fallon M.B., Krowka M.J., Brown R.S., Trotter J.F., Zacks S., Roberts K.E. Impact of hepatopulmonary syndrome on quality of life and survival in liver transplant candidates. Gastroenterology. 2008. 135. 1168-1175. doi: 10.1053/j.gastro.2008.06.038.
- Fuhrmann V., Krowka M. Hepatopulmonary syndrome. Journal of Hepatology. 2018. 69(3). 744-745. doi: 10.1016/j.jhep.2018.01.002.
- Child C.G., Turcotte J.G. Surgery and portal hypertension. Major Probl Clin Surg. 1964. 1. 1-85.
- Pugh R.N., Murray-Lyon I.M., Dawson J.L., Pietroni M.C., Williams R. Transection of the oesophagus for bleeding oesophageal varices. The British Journal of Surgery. 1973. 60(8). 646-649. doi: 10.1002/bjs.1800600817.
- Allameh A., Niayesh-Mehr R., Aliarab A., Sebastiani G., Pantopoulos K. Oxidative Stress in Liver Pathophysiology and Di–sease. Antioxidants (Basel). 2023. 12(9). 1653. doi: 10.3390/antiox12091653.
- Xu D., Hu Y.H., Gou X., Li F.Y., Yang X.Y. et al. Oxidative Stress and Antioxidative Therapy in Pulmonary Arterial Hypertension. Molecules. 2022. 27(12). 3724. doi: 10.3390/molecules27123724.
- Zolty R. Pulmonary arterial hypertension specific therapy: The old and the new. Pharmacol. Ther. 2020. 214. 107576. doi: 10.1016/j.pharmthera.2020.107576.
- Pomacu M.M., Trașcă M.D., Pădureanu V., Bugă A.M., Andrei A.M. et al. Interrelation of inflammation and oxidative stress in liver cirrhosis. Exp Ther Med. 2021. 21(6). 602. doi: 10.3892/etm.2021.10034.
- Conde de la Rosa L., Goicoechea L., Torres S., Garcia-–Ruiz C., Fernandez-Checa J.C. Role of Oxidative Stress in Liver Disorders. Livers. 2022. 2(4). 283-314. doi: 10.3390/livers2040023.
- Seen S. Chronic liver disease and oxidative stress — a narrative review. Expert Review of Gastroenterology & Hepatology. 2021. 15(9). 1021-1035. doi: 10.1080/17474124.2021.1949289.
- Oxidative Stress in Non-Alcoholic Fatty Liver Disease. An Updated Mini Review. Front. Med. 2021. 8. 595371. doi: 10.3389/fmed.2021.595371.
- Tan H.K., Yates E., Lilly K., Dhanda A.D. Oxidative stress in alcohol-related liver disease. World J Hepatol. 2020. 12(7). 332-349. doi: 10.4254/wjh.v12.i7.332.
- Ramos-Tovar E., Muriel P. Molecular Mechanisms That Link Oxidative Stress, Inflammation, and Fibrosis in the Liver. Antioxidants. 2020. 9(12). 1279. doi: 10.3390/antiox9121279.
- Hecker L. Mechanisms and consequences of oxidative stress in lung disease: therapeutic implications for an aging populace. American Journal of Physiology — Lung Cellular and Molecular Physiology. 2018. 314(4). L642-L653. doi: 10.1152/ajplung.00275.2017.
- Zarifmahmoudi L., Khalesi M., Sadeghi R., Jafari S.A., Kiani M.A., Kianifar H. Medical treatment for hepatopulmonary syndrome: a systematic review. Reviews in Clinical Medicine. 2014. 1(4). 165-175. doi: 10.17463/RCM.2014.04.001.
- Chooklin S., Chuklin S. Hepatopulmonary syndrome: diagnosis and treatment. Emergency Medicine. 2023. 19(8). 511-518. doi: 10.22141/2224-0586.19.8.2023.1640.