Журнал «Боль. Суставы. Позвоночник» Том 14, №1, 2024
Вернуться к номеру
Діагностика, профілактика та лікування дефіциту вітаміну D у дорослих: Kонсенсус українських експертів
Авторы: Григор’єва Н.В. (1), Тронько М.Д. (2), Коваленко В.М. (3), Комісаренко С.В. (4), Татарчук Т.Ф. (5), Дєдух Н.В. (1), Великий М.М. (4), Страфун С.С. (6), Комісаренко Ю.І. (7), Калашніков А.В. (6), Орленко В.Л. (2), Паньків В.І. (8), Швець О.В. (9), Гогунська І.В. (10), Регеда С.І. (11)
(1) - Державна установа «Інститут геронтології імені Д.Ф. Чеботарьова Національної академії медичних наук України», м. Київ, Україна
(2) - Державна установа «Інститут ендокринології та обміну речовин імені В.П. Комісаренка Національної академії медичних наук України», м. Київ, Україна
(3) - Державна установа «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України», м. Київ, Україна
(4) - Інститут біохімії імені О.В. Палладіна Національної академії наук України, м. Київ, Україна
(5) - Державна установа «Інститут педіатрії, акушерства і гінекології імені академіка О.М. Лук’янової Національної академії медичних наук України», м. Київ, Україна
(6) - Державна установа «Інститут травматології та ортопедії Національної академії медичних наук України», м. Київ, Україна
(7) - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(8) - Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
(9) - Національний університет біоресурсів і природокористування України, м. Київ, Україна
(10) - Державна установа «Інститут отоларингології імені проф. О.С. Коломійченка Національної академії медичних наук України», м. Київ, Україна
(11) - Державна наукова установа «Центр інноваційних медичних технологій Національної академії наук України», м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Актуальність. Дефіцит вітаміну D (ДВД) є значно поширеним у світі, його частка істотно варіює в різних популяціях і залежить від багатьох причин. До цього часу національних рекомендацій щодо діагностики, профілактики та лікування ДВД у дорослих в Україні не було. Їх створення і стало метою даної роботи. Методологія. Консенсус створювали за допомогою методу Дельфі, голосування проводили за допомогою платформи SurveyMonkey®. Після затвердження складу консенсусної групи, узгодження порядку формування та структури Консенсусу, формулювання і корекції основних положень, двох раундів голосування сформовано основні положення Консенсусу, за які група успішно проголосувала. 15 авторів статті є 15 експертами, які брали участь у голосуванні. Остаточні 14 положень Консенсусу подані в даній статті. Перед кожним положенням наведено його обґрунтування, викладене на основі існуючих у сучасній літературі високоякісних доказів. Результати. Незважаючи на зменшення ДВД в українській популяції протягом останніх років, експертами рекомендовано підвищення обізнаності медичної спільноти та населення щодо проблеми і шляхів її подолання зі скринінгом сироваткового загального рівня 25-гідроксивітаміну D (25(ОН)D) в осіб у певних групах ризику для досягнення цільової концентрації 30–50 нг/мл (75–125 нмоль/л). Для її забезпечення рекомендовано індивідуальний підбір профілактичної дози вітаміну D (800–2000 МО/д молодим здоровим особам і 3000–5000 МО/д — хворим із захворюваннями та станами, які впливають на метаболізм вітаміну D в організмі). Для лікування ДВД рекомендовано короткостроковий прийом більш високих доз (4000–10 000 МО/д) вітаміну D з контролем рівня 25(ОН)D через 4–12 тижнів лікування і подальшим використанням підтримуючих доз. Рекомендовано визначення сироваткового рівня 25(OH)D у хворих з остеопорозом і його ускладненнями перед ініціацією антиостеопоротичної терапії для запобігання її неефективності й підвищення профілю безпеки.
Background. Vitamin D deficiency (VDD) is widespread in the world; its proportion varies considerably in different populations and depends on many causes. Up to now, there were no National recommendations for the diagnosis, prevention, and treatment of VDD in adults in Ukraine. Their creation became the purpose of this work. Methodology. Consensus was created using the Delphi method, voting was conducted using the SurveyMonkey® platform. After approval of the composition of the Consensus Group, agreement on the order of formation and structure of the Consensus, creation and correction of the main statements, and two voting rounds, the main Consensus statements were formed and were successfully voted on. The 15 authors of the article are 15 experts who participated in the voting. The final 14 Consensus statements are presented in this article. Each statement is preceded by a justification based on high-quality evidence available in the current literature. Results. Despite the reduction of VDD in the Ukrainian population in recent years, experts have recommended increasing the awareness of the medical community and the Ukrainian population about the problem and ways to overcome it, with a screening of the total serum level of 25-hydroxyvitamin D (25(OH)D) in subjects from the groups of risk to achieve the target concentration of 30–50 ng/ml (75–125 nmol/l). To ensure it, we recommend the individual selection of a prophylactic dose of vitamin D (800–2000 IU/d for young healthy persons and 3000–5000 IU/d for patients with diseases and conditions that affect the metabolism of vitamin D). For the treatment of VDD, we recommend short-term intake of higher doses (4000–10,000 IU/d) of vitamin D with control of the 25(OH)D level after 4–12 weeks of treatment and subsequent use of maintenance doses. Also, we recommend the determination of serum 25(OH)D level before the initiation of antiosteoporotic therapy in patients with osteoporosis and its complications to prevent its ineffectiveness and increase the safety profile.
вітамін D; Консенсус; рекомендації; діагностика дефіциту вітаміну D; профілактика дефіциту вітаміну D; лікування дефіциту вітаміну D
vitamin D; consensus; recommendations; diagnosis of vitamin D deficiency, prevention of vitamin D deficiency; treatment of vitamin D deficiency
Вступ
Методологія розробки Консенсусу
Епідеміологія дефіциту вітаміну D у дорослих
Скринінг дефіциту вітаміну D у дорослих
Профілактика і лікування дефіциту вітаміну D у дорослих
Додаток 1
Метаболізм вітаміну D і джерела його надходження в організм
Додаток 2
Механізм дії вітаміну D і його скелетні ефекти
Додаток 3
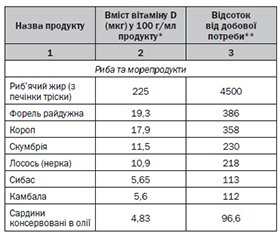
Харчові джерела надходження вітаміну D
/57.jpg)
/58.jpg)
Додаток 4
Основні положення Консенсусу
- Поворознюк В.В., Плудовскі П., Балацька Н.І., Муц В.Я., Климовицький Ф.В., Резніченко Н.А. та ін. Дефіцит та недостатність вітаміну D: епідеміо–логія, діагностика, профілактика та лікування. Під редакцією В.В. Поворознюка, П. Плудовскі. Видавець Заславський О.Ю., 2015. 262 с.
- Zmijewski M.A. Vitamin D and Human Health. International Journal of Molecular Sciences. 2019. 20(1). 145. doi: 10.3390/ijms20010145.
- Alonso N., Zelzer S., Eibinger G., Herrmann M. Vitamin D Metabolites: Analytical Challenges and Clinical Relevance. Calcif. Tissue Int. 2022 Mar 3. 1-20. doi: 10.1007/s00223-022-00961-5. PMID: 35238975; –PMCID: PMC8892115.
- Bikle D.D. Vitamin D: Newer Concepts of Its Metabolism and Function at the Basic and Clinical Level. J. Endocr. Soc. 2020 Feb 1. 4(2). bvz038. doi: 10.1210/jendso/bvz038.
- Carlberg C. Vitamin D in the Context of Evolution. Nutrients. 2022. 14. 3018. doi: 10.3390/nu14153018.
- Tuckey R.C., Cheng C.Y.S., Slominski A.T. The serum vitamin D metabolome: What we know and what is still to discover. J. Steroid. Biochem. Mol. Biol. 2019. 186. 4-21. doi: 10.1016/j.jsbmb.2018.09.003.
- McСollum E.V., Simmonds N., Becker J.E., Shipley P.G. Studies on experimental rickets: An experimental demonstration of the existence of a vitamin which promotes calcium deposition. J. Biol. Chem. 1922. 53. 293-298.
- Craveiro V., Araújo J., Santos A., Ramos E. Vitamin D — From the pro-hormone to the biological actions. Acta portuguesa de nutrição. 2019. 19. 50-54. doi: 10.21011/apn.2019.1909.
- Gil Á., Plaza-Diaz J., Mesa M.D. Vitamin D: Classic and Novel Actions. Ann. Nutr. Metab. 2018. 72(2). 87-95. doi: 10.1159/000486536.
- Bouillon R., Marcocci C., Carmeliet G., Bouillon R., Marcocci C., Carmeliet G. et al. Skeletal and Extraskeletal Actions of Vitamin D: Current Evidence and Outstanding Questions. Endocr. Rev. 2019 Aug 1. 40(4). 1109-1151. doi: 10.1210/er.2018-00126. PMID: 30321335; PMCID: PMC6626501.
- Marino R., Misra M. Extra-Skeletal Effects of Vitamin D. Nutrients. 2019 Jun 27. 11(7). 1460. doi: 10.3390/nu11071460. PMID: 31252594; PMCID: PMC6683065.
- Hanel A., Malmberg H., Carlberg C. Genome-wide effects of chromatin on vitamin D signaling, Journal of Molecular Endocrinology. 2020. 64(4). R45-R56. https://jme.bioscientifica.com/view/journals/jme/64/4/JME-19-0246.xml.
- Pike J.W., Meyer M.B., Lee S.M., Onal M., Benkusky N.A. The vitamin D receptor: contemporary genomic approaches reveal new basic and translational insights. J. Clin. Invest. 2017 Apr 3. 127(4). 1146-1154. doi: 10.1172/JCI88887. PMID: 28240603; PMCID: PMC5373853.
- Żmijewski M.A. Nongenomic Activities of Vitamin D. Nutrients. 2022 Dec 1. 14(23). 5104. doi: 10.3390/nu14235104. PMID: 36501134; PMCID: PMC9737885.
- Holick M.F., Binkley N.C., Bischoff-Ferrari H.A., Gordon C.M., Hanley D.A., Heaney R.P. et al. Endocrine Society Evaluation, treatment, and prevention of vitamin D deficiency: An Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011. 96. 1911-1930. doi: 10.1210/jc.2011-0385.
- Heaney R.P., Armas L.A. Quantifying the vitamin D economy. Nutr. Rev. 2015 Jan. 73(1). 51-67. doi: 10.1093/nutrit/nuu004. PMID: 26024057.
- Cashman K.D. Global differences in vitamin D status and dietary intake: a review of the data. Endocr. Connect. 2022 Jan 11. 11(1). e210282. doi: 10.1530/EC-21-0282.
- Amrein K., Scherkl M., Hoffmann M., Neu–wersch-Sommeregger S., Köstenberger M., Tmava Berisha A. et al. Vitamin D deficiency 2.0: an update on the current status worldwide. Eur. J. Clin. Nutr. 2020 Nov. 74(11). 1498-1513. doi: 10.1038/s41430-020-0558-y.
- Lips P., Cashman K.D., Lamberg-Allardt C., Bischoff-Ferrari H.A., Obermayer-Pietsch B., Bianchi M.L. et al. Current vitamin D status in European and Middle East countries and strategies to prevent vitamin D deficiency: a position statement of the European Calcified Tissue Society. Eur. J. Endocrinol. 2019. 180(4). 23-54. doi: 10.1530/EJE-18-0736.
- Roth D.E., Abrams S.A., Aloia J., Bergeron G., Bourassa M.W., Brown K.H. et al. Global prevalence and disease burden of vitamin D deficiency: a roadmap for action in low- and middle-income countries. Ann. N. Y. Acad. Sci. 2018 Oct. 1430(1). 44-79. doi: 10.1111/nyas.13968.
- Bouillon R. Vitamin D status in Africa is worse than in other continents. Lancet Glob. Health. 2020 Jan. 8(1). e20-e21. doi: 10.1016/S2214-109X(19)30492-9.
- Chevalley T., Brandi M.L., Cashman K.D., Cavalier E., Harvey N.C., Maggi S. et al. Role of vitamin D supplementation in the management of musculoskeletal diseases: update from an European Society of Clinical and Economical Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO) working group. Aging Clin. Exp. Res. 2022 Nov. 34(11). 2603-2623. doi: 10.1007/s40520-022-02279-6. PMID: 36287325; –PMCID: PMC9607746.
- Pludowski P., Takacs I., Boyanov M., Belaya Z., Diaconu C.C., Mokhort T. et al. Clinical Practice in the Prevention, Diagnosis and Treatment of Vitamin D Deficiency: A Central and Eastern European Expert Consensus Statement. Nutrients. 2022 Apr 2. 14(7). 1483. doi: 10.3390/nu14071483. PMID: 35406098; PMCID: PMC9002638.
- Rusińska A., Płudowski P., Walczak M., Borszewska-Kornacka M.K., Bossowski A., Chlebna-Sokół D. et al. Vitamin D Supplementation Guidelines for General Population and Groups at Risk of Vitamin D Deficiency in Poland-Recommendations of the Polish Society of Pediatric Endocrinology and Diabetes and the Expert Panel With Participation of National Specialist Consultants and Representatives of Scientific Societies-2018 Update. Front. Endocrinol. (Lausanne). 2018 May 31. 09. 246. doi: 10.3389/fendo.2018.00246. PMID: 29904370; –PMCID: PMC5990871.
- Borissova A.M., Boyanov M.A., Popivanov P.R., Kolarov Z., Petranova T.P., Shinkov A.D. Recommendation for Diagnosis, Prevention and Treatment of Vitamin D Deficiency; Bulgarian Society of Endocrinology: Sofia, Bulgaria, 2019.
- Bertoldo F., Cianferotti L., Di Monaco M., Falchetti A., Fassio A., Gatti D. et al. Definition, Assessment, and Management of Vitamin D Inadequacy: Suggestions, Recommendations, and Warnings from the Italian Society for Osteoporosis, Mineral Metabolism and Bone Diseases (SIOMMMS). Nutrients. 2022 Oct 6. 14(19). 4148. doi: 10.3390/nu14194148. PMID: 36235800; PMCID: PMC9573415.
- Han A., Park Y., Lee Y.K., Park S.Y., Park C.Y. Position Statement: Vitamin D Intake to Prevent Osteoporosis and Fracture in Adults. J. Bone Metab. 2022 Nov. 29(4). 205-215. doi: 10.11005/jbm.2022.29.4.205. Epub 2022 Nov 30. PMID: 36529863; PMCID: PMC9760769.
- Rosenfeld R.M., Nnacheta L.C., Corrigan M.D. Clinical Consensus Statement Development Manual. Otolaryngology — Head and Neck Surgery. 2015. 153 (2 suppl.). S1-S14. doi: 10.1177/0194599815601394.
- Dalkey N.C. Rand. The Delphi Method: An Experimental Study of Group Opinion. Santa Monica, CA: Rand Corp., 1969. https://apps.dtic.mil/sti/pdfs/AD0690498.pdf.
- Humphrey-Murto S., Varpio L., Wood T.J., Gonsalves C., Ufholz L.A., Mascioli K., Wang C., Foth T. The Use of the Delphi and Other Consensus Group Methods in Medical Education Research: A Review. Acad. Med. 2017 Oct. 92(10). 1491-1498. doi: 10.1097/ACM.0000000000001812. PMID: 28678098.
- Поворознюк В.В., Балацька Н.І., Муц В.Я., Вдовіна О.А. Дефіцит і недостатність вітаміну D у жителів України. Біль. Суглоби. Хребет. 2011. 4(04). 5–13.
- Povoroznyuk V.V., Pludowski P., Holick M., Balatska N.I., Dzerovych N.I., Solonenko T.Yu., Ivanyk O.S. 25-hydroxyvitamin D levels, vitamin D deficiency and insufficiency in patients with bone and musculoske–letal disorders. Pain Joints Spine. 2017. 7(3). 80-88. doi: 10.22141/2224-1507.7.3.2017.116858.
- Поворознюк В.В., Паньків І.В. Дефіцит та недостатність вітаміну D у жителів Буковини та Прикарпаття. Міжнародний ендокринологічний журнал. 2016. 4. 22-25. http://nbuv.gov.ua/UJRN/Mezh_2016_4_5.
- Shchubelka K. Vitamin D status in adults and children in Transcarpathia, Ukraine in 2019. BMC Nutr. 2020 Nov 6. 6(1). 48. doi: 10.1186/s40795-020-00380-5.
- Grygorieva N.V., Musiienko A.S., Bystrytska M.A., Solonenko T.Yu. Deficiency and insufficiency of Vitamin D in the Ukraine — update 2022. Фізіол. журн. 2022. Т. 68(6). 51-59. https://fz.kiev.ua/journals/2022_V.68/6/Fzh-6-2022-51-59.pdf.
- Григор’єва Н.В., Солоненко Т.Ю., Мусієнко А.С., Бистрицька М.А. Дефіцит вітаміну D в Україні у час пандемії COVID-19 і війни. Біль. Суглоби. Хребет. 2023. 1. 7-14. doi: 10.22141/pjs.13.1.2023.352. doi: 10.22141/pjs.13.1.2023.352.
- Herrmann M., Farrell C.L., Pusceddu I., Fabregat-Cabello N., Cavalier E. Assessment of vitamin D status — a changing landscape. Clin. Chem. Lab. Med. 2017 Jan 1. 55(1). 3-26. doi: 10.1515/cclm-2016-0264. PMID: 27362963.
- Bikle D.D. Vitamin D: Production, Metabolism and Mechanisms of Action. [Last Update: December 31, 2021]. In: Feingold K.R., Anawalt B., Boyce A. et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000. https://www.ncbi.nlm.nih.gov/books/NBK278935.
- Pilz S., Zittermann A., Trummer C., Theiler-Schwetz V., Lerchbaum E., Keppel M.H. et al. Vitamin D testing and treatment: a narrative review of current evidence. Endocr. Connect. 2019 Feb 1. 8(2). R27-R43. doi: 10.1530/EC-18-0432. PMID: 30650061; PMCID: PMC6365669.
- Binkley N., Dawson-Hughes B., Durazo-Arvizu R., Thamm M., Tian L., Merkel J.M. et al. Vitamin D measurement standardization: The way out of the chaos. J. Steroid Biochem. Mol. Biol. 2017 Oct. 173. 117-121. doi: 10.1016/j.jsbmb.2016.12.002. PMID: 27979577.
- Máčová L., Bičíková M. Vitamin D: Current Challenges between the Laboratory and Clinical Practice. Nutrients. 2021 May 21. 13(6). 1758. doi: 10.3390/nu13061758. PMID: 34064098; PMCID: PMC8224373.
- Ross A.C., Manson J.E., Abrams S.A., Aloia J.F., Brannon P.M., Clinton S.K. et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J. Clin. Endocrinol. Metab. 2011 Jan. 96(1). 53-8. doi: 10.1210/jc.2010-2704. PMID: 21118827; PMCID: PMC3046611.
- Scientific Opinion on the Tolerable Upper Intake Level of vitamin D. EFSA Journal. 2012. 10(7). doi: 10.2903/j.efsa.2012.2813.
- Pludowski P., Holick M.F., Grant W.B., Konstantynowicz J., Mascarenhas M.R., Haq A. et al. Vitamin D supplementation guidelines. J. Steroid Biochem. Mol. Biol. 2018 Jan. 175. 125-135. doi: 10.1016/j.jsbmb.2017.01.021. PMID: 28216084.
- Bouillon R. Comparative analysis of nutritional guidelines for vitamin D. Nat. Rev. Endocrinol. 2017 Aug. 13(8). 466-479. doi: 10.1038/nrendo.2017.31. PMID: 28387318.
- Pilz S., Trummer C., Pandis M., Schwetz V., Abe–rer F., Grübler M., Verheyen N., Tomaschitz A., März W. Vitamin D: Current Guidelines and Future Outlook. Anticancer Res. 2018 Feb. 38(2). 1145-1151. doi: 10.21873/anticanres.12333. PMID: 29374751.
- Ramasamy I. Vitamin D Metabolism and Guidelines for Vitamin D Supplementation. Clin. Biochem. Rev. 2020 Dec. 41(3). 103-126. doi: 10.33176/AACB-20-00006. PMID: 33343045; PMCID: PMC7731935.
- Rosen C.J., Abrams S.A., Aloia J.F., Brannon P.M., Clinton S.K., Durazo-Arvizu R.A. et al. IOM committee members respond to Endocrine Society vitamin D guideline. J. Clin. Endocrinol. Metab. 2012 Apr. 97(4). 1146-52. doi: 10.1210/jc.2011-2218. PMID: 22442278; –PMCID: PMC5393439.
- Malabanan A., Veronikis I.E., Holick M.F. Redefining vitamin D insufficiency. Lancet. 1998 Mar 14. 351(9105). 805-6. doi: 10.1016/s0140-6736(05)78933-9. PMID: 9519960.
- Serdar M.A., Batu Can B., Kilercik M., Durer Z.A., Aksungar F.B., Serteser M. et al. Analysis of Changes in Parathyroid Hormone and 25 (OH) Vitamin D Levels with Respect to Age, Gender and Season: A Data Mining Study. J. Med. Biochem. 2017 Jan 25. 36(1). 73-83. doi: 10.1515/jomb-2017-0002. PMID: 28680352; PMCID: PMC5471662.
- Vale C.L., Rydzewska L.H.M., Rovers M.M., Emberson J.R., Gueyffier F., Stewart L.А. on behalf of the Cochrane IPD Meta-analysis Methods Group. Uptake of systematic reviews and meta-analyses based on individual participant data in clinical practice guidelines: descriptive study. BMJ. 2015. 350. h1088. doi: 10.1136/bmj.h1088.
- Rockwell M., Kraak V., Hulver M., Epling J. Clinical management of low vitamin D: a scoping review of physicians’ practices. Nutrients. 2018. 10. 493. doi: 10.3390/nu10040493.
- Woodford H.J., Barrett S., Pattman S. Vitamin D: too much testing and treating? Clinical Medicine. 2018. 18. 196-200. doi: 10.7861/clinmedicine.18-3-196.
- Zhao S., Gardner K., Taylor W., Marks E., Goodson N. Vitamin D assessment in primary care: changing patterns of testing. London J. Prim. Care (Abingdon). 2015. 7(2). 15-22. doi: 10.1080/17571472.2015.11493430. PMID: 26217398; PMCID: PMC4494470.
- Avenell A., Bolland M.J., Grey A. 25-Hydroxyvitamin D — should labs be measuring it? Annals of Clinical Biochemistry. 2018. doi: 10.1177/0004563218796858.
- Burnett-Bowie S.M., Cappola A.R. The USPSTF 2021 Recommendations on Screening for Asymptomatic Vitamin D Deficiency in Adults: The Challenge for Clinicians Continues. JAMA. 2021. 325. 1401-1402. doi: 10.1001/jama.2021.2227.
- US Preventive Services Task Force; Krist A.H., Davidson K.W., Mangione C.M., Cabana M., Caughey A.B., Davis E.M. et al. Screening for Vitamin D Deficiency in Adults: US Preventive Services Task Force Recommendation Statement. JAMA. 2021. 325. 1436-1442. doi: 10.1001/jama.2021.3069. PMID: 33847711.
- Wang C.M., Chang C.S., Chang Y.F., Wu S.J., Chiu C.J., Hou M.T. et al. Inverse Relationship between Metabolic Syndrome and 25-Hydroxyvitamin D Concentration in Elderly People without Vitamin D deficiency. Sci. Rep. 2018 Nov 19. 8(1). 17052. doi: 10.1038/s41598-018-35229-2. PMID: 30451913; PMCID: PMC6242887.
- Webb A.R., Kazantzidis A., Kift R.C., Farrar M.D., Wilkinson J., Rhodes L.E. Colour Counts: Sunlight and Skin Type as Drivers of Vitamin D Deficiency at UK Latitudes. Nutrients. 2018 Apr 7. 10(4). 457. doi: 10.3390/nu10040457. PMID: 29642423; –PMCID: PMC5946242.
- Ali M., Uddin Z. Factors associated with vitamin D defіciency among patients with musculoskeletal disorders seeking physiotherapy intervention: a hospital-based observational study. BMC Musculoskeletal Disorders. 2022. 23. 817. doi: 10.1186/s12891-022-05774-z.
- Zhou Y.F., Luo B.A., Qin L.L. The association between vitamin D deficiency and community-acquired pneumonia: A meta-analysis of observational studies. Medicine (Baltimore). 2019 Sep. 98(38). e17252. doi: 10.1097/MD.0000000000017252. PMID: 31567995; PMCID: PMC6756683.
- Mishra P., Parveen R., Bajpai R., Agarwal N. Vitamin D Deficiency and Comorbidities as Risk Factors of COVID-19 Infection: A Systematic Review and Meta-analysis. J. Prev. Med. Public Health. 2022 Jul. 55(4). 321-333. doi: 10.3961/jpmph.21.640. PMID: 35940187; PMCID: PMC9371781.
- Bikle D.D. Vitamin D Regulation of Immune Function. Current Osteoporosis Reports. 2022. 20. 186-193. doi: 10.1007/s11914-022-00732-z.
- Tukaj S. Vitamin D in autoimmune bullous disease. Acta Biochim. Pol. 2020 Feb 12. 67(1). 1-5. doi: 10.18388/abp.2020_2905. PMID: 32049468.
- Komisarenko Y., Bobryk M. Vitamin D deficiency and immune disorders in combined endocrine pathology. Frontiers in Endocrinology. 2018. Oct. 1-8. doi: 10.3389/fendo.2018.00600.
- Dan L., Chen X., Xie Y., Sun Y., Hesketh T., Wang X., Chen J. Nonlinear Association between Serum 25-Hydroxyvitamin D and All-Cause Mortality in Adults with Inflammatory Bowel Disease in a Prospective Cohort Study. J. Nutr. 2022 Sep 6. 152(9). 2125-2134. doi: 10.1093/jn/nxac148. PMID: 35816464.
- Infantino C., Francavilla R., Vella A., Cenni S., Principi N., Strisciuglio C., Esposito S. Role of Vitamin D in Celiac Disease and Inflammatory Bowel Di–seases. Nutrients. 2022 Dec 3. 14(23). 5154. doi: 10.3390/nu14235154. PMID: 36501183; PMCID: PMC9735899.
- Charoenngam N. Vitamin D and Rheumatic Diseases: A Review of Clinical Evidence. Int. J. Mol. Sci. 2021 Oct 1. 22(19). 10659. doi: 10.3390/ijms221910659. PMID: 34639000; PMCID: PMC8508879.
- Makrani A.H., Afshari M., Ghajar M., Forooghi Z., Moosazadeh M. Vitamin D and fibromyalgia: a meta-analysis. Korean J. Pain. 2017 Oct. 30(4). 250-257. doi: 10.3344/kjp.2017.30.4.250. Epub 2017 Sep 29. PMID: 29123619; PMCID: PMC5665736.
- Schneider L., Hax V., Monticielo O., Macedo T.F., Barreto R.K.M., Marcondes N.A., Chakr R. Dualities of the vitamin D in systemic sclerosis: a systematic literature review. Adv. Rheumatol. 2021. 61. Article number: 34. doi: 10.1186/s42358-021-00192-6.
- Meena N., Singh Chawla S.P., Garg R., Batta A., Kaur S. Assessment of Vitamin D in Rheumatoid Arthritis and Its Correlation with Disease Activity. J. Nat. Sci. Biol. Med. 2018 Jan-Jun. 9(1). 54-58. doi: 10.4103/jnsbm.JNSBM_128_17. PMID: 29456394; PMCID: PMC5812075.
- Комісаренко Ю.І. Корекція вітаміном D3 порушень метаболічних процесів у пацієнтів із цукровим діабетом 1-го та 2-го типів. Український біохімічний журнал. 2014. 86(1). 111-116. doi: 10.15407/ubj86.01.111
- Luo B.A., Gao F., Qin L.L. The Association between Vitamin D Deficiency and Diabetic Retinopathy in Type 2 Diabetes: A Meta-Analysis of Observational Studies. Nutrients. 2017 Mar 20. 9(3). 307. doi: 10.3390/nu9030307. PMID: 28335514; PMCID: PMC5372970.
- Паньків І.В. Вплив вітаміну D на рівень андрогенів у чоловіків. Міжнародний ендокринологічний журнал. 2022. 17(8). 646-650. doi: 10.22141/2224-0721.17.8.2021.246801.
- Khozam S.A., Sumaili A.M., Alflan M.A., Sha–wabkeh R.A.S. Association Between Vitamin D Deficiency and Autoimmune Thyroid Disorder: A Syste–matic Review. Cureus. 2022 Jun 12. 14(6). e25869. doi: 10.7759/cureus.25869. PMID: 35836431; PMCID: PMC9275446.
- Wang J., Lv S., Chen G., Gao C., He J., Zhong H., Xu Y. Meta-analysis of the association between vitamin D and autoimmune thyroid disease. Nutrients. 2015 Apr 3. 7(4). 2485-98. doi: 10.3390/nu7042485. PMID: 25854833; PMCID: PMC4425156.
- Al-Khalidi B., Kimball S.M., Rotondi M.A., Ar–dern C.I. Standardized serum 25-hydroxyvitamin D concentrations are inversely associated with cardiometabolic disease in U.S. adults: a cross-sectional analysis of NHANES, 2001-2010. Nutr. J. 2017 Feb 28. 16(1). 16. doi: 10.1186/s12937-017-0237-6. Erratum in: Nutr J. 2017 May 22. 16(1). 32. PMID: 28241878; PMCID: PMC5329954.
- Поворознюк В.В., Резниченко Н.А., Майлян Э.А., Майлян Д.Э. Экстраскелетные эффекты витамина D: роль в патогенезе сердечно-сосудистых заболеваний. Боль. Суставы. Позвоночник. 2015. 17(1). 43-51. doi: 10.22141/2224-1507.1.17.2015.79020.
- Welles C.C., Whooley M.A., Karumanchi S.A., Hod T., Thadhani R., Berg A.H., Ix J.H., Mukamal K.J. Vitamin D deficiency and cardiovascular events in patients with coronary heart disease: data from the Heart and Soul Study. Am. J. Epidemiol. 2014 Jun 1. 179(11). 1279-87. doi: 10.1093/aje/kwu059. Erratum in: Am. J. Epidemiol. 2014 Oct 1. 180(7). 762. PMID: 24699783; PMCID: PMC4036212.
- Zhang H., Wang P., Jie Y., Sun Y., Wang X., Fan Y. Predictive value of 25-hydroxyvitamin D level in patients with coronary artery disease: A meta-analysis. Front. Nutr. 2022 Aug 10. 9. 984487. doi: 10.3389/fnut.2022.984487. PMID: 36034916; PMCID: PMC9399797.
- Eyles D.W. Vitamin D: Brain and Behavior. JBMR Plus. 2020 Oct 18. 5(1). e10419. doi: 10.1002/jbm4.10419. PMID: 33553986; PMCID: PMC7839822.
- Plantone D., Primiano G., Manco C., Locci S., Servidei S., De Stefano N. Vitamin D in Neurological Diseases. Int. J. Mol. Sci. 2022 Dec 21. 24(1). 87. doi: 10.3390/ijms24010087. PMID: 36613531; PMCID: PMC9820561.
- Li G., Li L., Adachi J.D., Wang R., Ye Z., Liu X., Thabane L., Lip G.Y.H. Relationship between Serum 25-Hydroxyvitamin D Level and Risk of Recurrent Stroke. Nutrients. 2022 May 2. 14(9). 1908. doi: 10.3390/nu14091908. PMID: 35565874; PMCID: PMC9099592.
- Vahdat S. Vitamin D and Kidney Diseases: A Narrative Review. Int. J. Prev. Med. 2020 Dec 11. 11. 195. doi: 10.4103/ijpvm.IJPVM_54_19. PMID: 33815719; –PMCID: PMC8000170.
- Keum N., Lee D.H., Greenwood D.C., Manson J.E., Giovannucci E. Vitamin D supplementation and total cancer incidence and mortality: a meta-analysis of randomized controlled trials. Ann. Oncol. 2019 May 1. 30(5). 733-743. doi: 10.1093/annonc/mdz059. PMID: 30796437; PMCID: PMC6821324.
- Skversky A.L., Kumar J., Abramowitz M.K., Kaskel F.J., Melamed M.L. Association of glucocorticoid use and low 25-hydroxyvitamin D levels: results from the National Health and Nutrition Examination Survey (NHANES): 2001–2006. J. Clin. Endocrinol. Metab. 2011 Dec. 96(12). 3838-45. doi: 10.1210/jc.2011-1600. Epub 2011 Sep 28. PMID: 21956424; PMCID: PMC3232615.
- Teagarden D.L., Meador K.J., Loring D.W. Low vitamin D levels are common in patients with epilepsy. Epilepsy Res. 2014 Oct. 108(8). 1352-6. doi: 10.1016/j.eplepsyres.2014.06.008. Epub 2014 Jul 6. PMID: 25060996; PMCID: PMC4149948.
- Gaksch M., Jorde R., Grimnes G., Joakimsen R., Schirmer H., Wilsgaard T. et al. Vitamin D and morta–lity: Individual participant data meta-analysis of standardized 25-hydroxyvitamin D in 26916 individuals from a European consortium. PLoS One. 2017 Feb 16. 12(2). e0170791. doi: 10.1371/journal.pone.0170791. PMID: 28207791; PMCID: PMC5312926.
- Chen Y., Feng S., Chang Z., Zhao Y., Liu Y., Fu J. et al. Higher Serum 25-Hydroxyvitamin D Is Associated with Lower All-Cause and Cardiovascular Mortality among US Adults with Nonalcoholic Fatty Liver Disease. Nutrients. 2022 Sep 27. 14(19). 4013. doi: 10.3390/nu14194013. PMID: 36235666; PMCID: PMC9571761.
- Wan Z., Guo J., Pan A., Chen C., Liu L., Liu G. Association of Serum 25-Hydroxyvitamin D Concentrations With All-Cause and Cause-Specific Mortality Among Individuals With Diabetes. Diabetes Care. 2021 Feb. 44(2). 350-357. doi: 10.2337/dc20-1485. Epub 2020 Nov 8. PMID: 33168652.
- Talebi F., Rasooli Nejad M., Yaseri M., Hadadi A. Association of Vitamin D Status with the Seve–rity and Mortality of Community-Acquired Pneumonia in Iran during 2016–2017: A Prospective Cohort Study. Rep. Biochem. Mol. Biol. 2019 Apr. 8(1). 85-90. PMID: 31334293; PMCID: PMC6590933.
- Rajab H.A. The Effect of Vitamin D Level on Parathyroid Hormone and Alkaline Phosphatase. Diagnostics (Basel). 2022 Nov 17. 12(11). 2828. doi: 10.3390/diagnostics12112828. PMID: 36428888; PMCID: PMC9689845.
- Shahsavani Z., Asadi A.H., Shamshirgardi E., Akbarzadeh M. Vitamin D, Magnesium and Their Interactions: A Review. Int. J. Nutr. Sci. 2021. 6(3). 113-118. doi: 10.30476/IJNS.2021.91766.1144.
- Sasaki S., Segawa H., Hanazaki A., Kirino R., Fujii T., Ikuta K. et al. A Role of Intestinal Alkaline Phosphatase 3 (Akp3) in Inorganic Phosphate Homeostasis. Kidney Blood Press. Res. 2018. 43(5). 1409-1424. doi: 10.1159/000493379. PMID: 30212831; PMCID: PMC8437033.
- Reddy P., Edwards L.R. Magnesium supplementation in vitamin D deficiency. Am. J. Ther. 2019. 26. e124-e32. doi: 10.1097/ MJT.0000000000000538. PMID: 28471760.
- Uwitonze A.M., Razzaque M.S. Role of Magnesium in Vitamin D Activation and Function. J. Am. Osteopath. Assoc. 2018 Mar 1. 118(3). 181-189. doi: 10.7556/jaoa.2018.037. PMID: 29480918.
- Jhee J.H., Nam K.H., An S.Y., Cha M.U., Lee M., Park S. et al. Severe vitamin D deficiency is a risk factor for renal hyperfiltration. Am. J. Clin. Nutr. 2018 Dec 1. 108(6). 1342-1351. doi: 10.1093/ajcn/nqy194. PMID: 30541088.
- Hammami M.M., Yusuf A. Differential effects of vitamin D2 and D3 supplements on 25-hydroxyvitamin D level are dose, sex, and time dependent: a randomized controlled trial. BMC Endocr. Disord. 2017 Feb 24. 17(1). 12. doi: 10.1186/s12902-017-0163-9. PMID: 28231782; PMCID: PMC5324269.
- Tripkovic L., Lambert H., Hart K., Smith C.P., Bucca G., Penson S. et al. Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis. Am. J. Clin. Nutr. 2012 Jun. 95(6). 1357-64. doi: 10.3945/ajcn.111.031070. Epub 2012 May 2. PMID: 22552031; PMCID: PMC3349454.
- Takács I., Tóth B.E., Szekeres L., Szabó B., Bakos B., Lakatos P. Randomized clinical trial to compa–ring efficacy of daily, weekly and monthly administration of vitamin D3. Endocrine. 2017 Jan. 55(1). 60-65. doi: 10.1007/s12020-016-1137-9. Epub 2016 Oct 7. PMID: 27718150.
- Mazess R.B., Bischoff-Ferrari H.A., Dawson-Hughes B. Vitamin D: Bolus Is Bogus — A Narrative Review. JBMR Plus. 2021. 5. e10567. doi: 10.1002/jbm4.10567.
- Cashman K.D., Ritz C., Kiely M., Odin Collaborators. Improved Dietary Guidelines for Vitamin D: Application of Individual Participant Data (IPD)-Level Meta-Regression Analyses. Nutrients. 2017 May 8. 9(5). 469. doi: 10.3390/nu9050469. PMID: 28481259; –PMCID: PMC5452199.
- Про затвердження Норм фізіологічних потреб населення України в основних харчових речовинах і енергії: Наказ Міністерства охорони здоров’я України № 1073 від 03.09.2017. https://zakon.rada.gov.ua/laws/show/z1206-17#Text.
- Nielsen O.H., Hansen T.I., Gubatan J.M., Jensen K.B., Rejnmark L. Managing vitamin D deficiency in inflammatory bowel disease. Frontline Gastroenterol. 2019 Oct. 10(4). 394-400. doi: 10.1136/flgastro-2018-101055. Epub 2019 Jan 7. PMID: 31656565; PMCID: PMC6788352.
- Martineau A.R., Jolliffe D.A., Hooper R.L., Greenberg L., Aloia J.F., Bergman P. et al. Vitamin D supplementation to prevent acute respiratory tract infections: syste–matic review and meta-analysis of individual participant data. BMJ. 2017 Feb 15. 356. i6583. doi: 10.1136/bmj.i6583. PMID: 28202713; PMCID: PMC5310969.
- Boughanem H., Canudas S., Hernandez-Alonso P., Becerra-Tomás N., Babio N., Salas-Salvadó J., Macias-Gonzalez M. Vitamin D Intake and the Risk of Colorectal Cancer: An Updated Meta-Analysis and Systematic Review of Case-Control and Prospective Cohort Studies. Cancers (Basel). 2021 Jun 4. 13(11). 2814. doi: 10.3390/cancers13112814.
- Li Z., Wu L., Zhang J., Huang X., Thabane L., Li G. Effect of Vitamin D Supplementation on Risk of Breast Cancer: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Front. Nutr. 2021. 8. 655727. doi: 10.3389/fnut.2021.655727.
- Cojic M., Kocic R., Klisic A., Kocic G. The Effects of Vitamin D Supplementation on Metabolic and Oxidative Stress Markers in Patients With Type 2 Diabetes: A 6-Month Follow Up Randomized Controlled Study. Front. Endocrinol (Lausanne). 2021 Aug 19. 12. 610893. doi: 10.3389/fendo.2021.610893. PMID: 34489860; –PMCID: PMC8417320.
- Курченко А.І., Комісаренко Ю.І., Антоненко О.В. Вивчення показників стану імунної системи у хворих з поєднаною ендокринною патологією у разі використання препаратів вітаміну D3. Імунологія та алергологія. 2013. (4). 30-35. http://nbuv.gov.ua/UJRN/Ita_2013_4_8.
- Burt L.A., Billington E.O., Rose M.S., Raymond D.A., Hanley D.A., Boyd S.K. Effect of High-Dose Vitamin D Supplementation on Volumetric Bone Density and Bone Strength: A Randomized Clinical Trial. JAMA. 2019. 322(8). 736-745. doi: 10.1001/jama.2019.11889.
- Bollerslev J., Rejnmark L., Zahn A., Heck A., Appelman-Dijkstra N.M., Cardoso L. et al.; 2021 PARAT Working Group. European Expert Consensus on Practical Management of Specific Aspects of Parathyroid Disorders in Adults and in Pregnancy: Recommendations of the ESE Educational Program of Parathyroid Disorders. Eur. J. Endocrinol. 2022 Jan 13. 186(2). R33-R63. doi: 10.1530/EJE-21-1044. PMID: 34863037; PMCID: PMC8789028.
- Minisola S., Colangelo L., Pepe J., Diacinti D., Cipriani C., Rao S.D. Osteomalacia and Vitamin D Status: A Clinical Update 2020. JBMR Plus. 2020 Dec 21. 5(1). e10447. doi: 10.1002/jbm4.10447. PMID: 33553992; –PMCID: PMC7839817.
- Kanis J.A., Cooper C., Rizzoli R., Reginster J.Y.; Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis (ESCEO) and the Committees of Scientific Advisors and National Societies of the International Osteoporosis Foundation (IOF). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2019 Jan. 30(1). 3-44. doi: 10.1007/s00198-018-4704-5. Epub 2018 Oct 15. Erratum in: Osteoporos Int. 2020 Jan. 31(1). 209. Erratum in: Osteoporos Int. 2020 Apr. 31(4). 801. PMID: 30324412; PMCID: PMC7026233.
- Shoback D., Rosen C.J., Black D.M., Cheung A.M., Murad M.H., Eastell R. Pharmacological Management of Osteoporosis in Postmenopausal Women: An Endocrine Society Guideline Update. J. Clin. Endocrinol. Metab. 2020 Mar 1. 105(3). dgaa048. doi: 10.1210/clinem/dgaa048. PMID: 32068863.
- Watts N.B., Adler R.A., Bilezikian J.P., Drake M.T., Eastell R., Orwoll E.S., Finkelstein J.S.; Endocrine Society. Osteoporosis in men: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2012 Jun. 97(6). 1802-22. doi: 10.1210/jc.2011-3045. PMID: 22675062.
- 2022 American College of Rheumatology Guideline for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis. https://www.rheumatology.org/Portals/0/Files/Prevention-Treatment-GIOP-Guideline-Summary.pdf.
- Kong S.H., Jang H.N., Kim J.H., Kim S.W., Shin C.S. Effect of Vitamin D Supplementation on Risk of Fractures and Falls According to Dosage and Interval: A Meta-Analysis. Endocrinol. Metab. (Seoul). 2022 Apr. 37(2). 344-358. doi: 10.3803/EnM.2021.1374. PMID: 35504603; PMCID: PMC9081312.
- DIPART (Vitamin D Individual Patient Analysis of Randomized Trials) Group. Patient level pooled analysis of 68 500 patients from seven major vitamin D fracture trials in US and Europe. BMJ. 2010 Jan 12. 340. b5463. doi: 10.1136/bmj.b5463. PMID: 20068257; PMCID: PMC2806633.
- Yao P., Bennett D., Mafham M., Lin X., Chen Z., Armitage J., Clarke R. Vitamin D and Calcium for the Prevention of Fracture: A Systematic Review and Meta-analysis. JAMA Netw. Open. 2019 Dec 2. 2(12). e1917789. doi: 10.1001/jamanetworkopen.2019.17789. PMID: 31860103; PMCID: PMC6991219.
- Thanapluetiwong S., Chewcharat A., Takkavatakarn K., Praditpornsilpa K., Eiam-Ong S., Susantitaphong P. Vitamin D supplement on prevention of fall and fracture: A Meta-analysis of Randomized Controlled Trials. Medicine (Baltimore). 2020 Aug 21. 99(34). e21506. doi: 10.1097/MD.0000000000021506. PMID: 32846760; –PMCID: PMC7447507.
- Bolland M.J., Grey A., Avenell A. Effects of vitamin D supplementation on musculoskeletal health: a systematic review, meta-analysis, and trial sequential analysis. Lancet Diabetes Endocrinol. 2018 Nov. 6(11). 847-858. doi: 10.1016/S2213-8587(18)30265-1. PMID: 30293909.
- Carmel A.S., Shieh A., Bang H., Bockman R.S. The 25(OH)D level needed to maintain a favorable bisphosphonate response is ≥ 33 ng/ml. Osteoporos. Int. 2012 Oct. 23(10). 2479-87. doi: 10.1007/s00198-011-1868-7. PMID: 22237813; PMCID: PMC3893033.
- Sugimoto T., Matsumoto T., Hosoi T., Shiraki M., Kobayashi M., Okubo N., Takami H., Nakamura T. Efficacy of denosumab co-administered with vitamin D and Ca by baseline vitamin D status. J. Bone Miner. Metab. 2020 Nov. 38(6). 848-858. doi: 10.1007/s00774-020-01119-9. PMID: 32671481.
- Suzuki T., Nakamura Y., Kato H. Calcium and vitamin D supplementation with 3-year denosumab treatment is beneficial to enhance bone mineral density in postmenopausal patients with osteoporosis and rheumatoid arthritis. Ther. Clin. Risk Manag. 2019. 15. 15-22. doi: 10.2147/TCRM.S182858.
- Bertoldo F., Pancheri S., Zenari S., Boldini S., Giovanazzi B., Zanatta M., Valenti M.T., Dalle Carbo–nare L., Lo Cascio V. Serum 25-hydroxyvitamin D levels modulate the acute-phase response associated with the first nitrogen-containing bisphosphonate infusion. J. Bone Miner. Res. 2010 Mar. 25(3). 447-54. doi: 10.1359/jbmr.090819. PMID: 20200999.
- Lu K., Shi Q., Gong Y.Q., Li C. Association between vitamin D and zoledronate-induced acute-phase response fever risk in osteoporotic patients. Front. Endocrinol. (Lausanne). 2022 Oct 10. 13. 991913. doi: 10.3389/fendo.2022.991913. PMID: 36299453; PMCID: PMC9589500.
- Jones G. Extrarenal vitamin D activation and interactions between vitamin D, vitamin D, and vitamin D analogs. Annu. Rev. Nutr. 2013. 33. 23-44. doi: 10.1146/annurev-nutr-071812-161203. Epub 2013 Apr 29. PMID: 23642201.
- Anderson P.H. Vitamin D activity and metabolism in bone. Curr. Osteoporos. Rep. 2017 Oct. 15(5). 443-449. doi: 10.1007/s11914-017-0394-8.
- Contreras-Bolívar V., García-Fontana B., García-Fontana C., Muñoz-Torres M. Mechanisms Involved in the Relationship between Vitamin D and Insulin Resistance: Impact on Clinical Practice. Nutrients. 2021 Oct 1. 13(10). 3491. doi: 10.3390/nu13103491. PMID: 34684492; –PMCID: PMC8539968.
- Delanghe J.R., Speeckaert R., Speeckaert M.M. Behind the scenes of vitamin D binding protein: More than vitamin D binding. Best Practice & Research Clinical Endocrinology & Metabolism. 2015. 29(5). 773-786. doi: 10.1016/j.beem.2015.06.006.
- Bischoff-Ferrari H.A., Orav E.J., Abderhalden L., Dawson-Hughes B., Willett W.C. Vitamin D supplementation and musculoskeletal health. Lancet Diabetes Endocrinol. 2019 Feb. 7(2). 85. doi: 10.1016/S2213-8587(18)30347-4. PMID: 30683217.
- Martineau C., Naja R.P., Husseini A., Hamade B., Kaufmann M., Akhouayri O. et al. Optimal bone fracture repair requires 24R,25-dihydroxyvitamin D3 and its effector molecule FAM57B2. J. Clin. Invest. 2018. 128(8). 3546-3557. doi: 10.1172/JCI98093.
- Kalashnikov A., Apukhovskaya L., Osadchuk T., Stavinskyi Y., Litun Y., Verkhovskyi O. Influence of calcium and vitamin D3 on the mineral metabolism in rats. Experimental study: Bulletin of the Georgian National Academy of Sciences. 2021. 15. 127-133. http://science.org.ge/bnas/t15-n2/18_Kalashnikov_Medical%20Science.pdf.
- Posa F., Di Benedetto A., Cavalcanti-Adam E.A. et al. Vitamin D Promotes MSC Osteogenic Differentiation Stimulating Cell Adhesion and αVβ3 Expression. Stem. Cells Int. 2018. 2018. 6958713. doi: 10.1155/2018/6958713.
- Roseland J.M., Phillips K.M., Patterson K.Y., Pehrsson P.R., Taylor C.L. Vitamin D in foods: An evolution of knowledge. In: Feldman D., Pike J.W., Bouillon R., Giovannucci E., Goltzman D., Hewison M., eds. Vitamin D, Health, Disease and Therapeutics. Fourth Edition. Elsevier, 2018. 2. 41-78. doi: 10.1016/B978-0-12-809963-6.00060-2.