Журнал «Боль. Суставы. Позвоночник» Том 14, №1, 2024
Вернуться к номеру
Ревматоїдний артрит з початком у літньому віці — особливості клінічної картини та лікування (систематичний огляд літератури)
Авторы: Єгудіна Є.Д. (1), Трипілка С.А. (2)
(1) - Клініка сучасної ревматології, м. Київ, Україна
(2) - Комунальне некомерційне підприємство Харківської обласної ради «Обласна клінічна лікарня», м. Харків, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Актуальність. Ревматоїдний артрит (РА) з початком у літньому віці характеризується початком захворювання після 60 років. З огляду на глобальне збільшення частки осіб старшого віку серед населення та потенційні наслідки РА, проблема його діагностики та лікування є досить актуальною. Мета: проаналізувати поточні літературні дані щодо особливостей клінічної картини, диференційної діагностики та методів лікування пацієнтів з РА з початком у літньому віці з урахуванням коморбідних станів. Матеріали та методи. Аналітичний огляд літературних даних було проведено з використанням інформаційного аналізу наукометричних баз даних PubMed, Web of Science, Scopus, Google Scholar за період 2013–2023 рр., але з нього не виключали основні роботи, опубліковані раніше, за ключовими словами «РА з початком у літньому віці», «РА», «діагностика», «лікування», «прогноз». Результати. Аналіз літератури продемонстрував, що якщо більш ранні дослідження стверджували, що РА з початком у літньому віці є більш легкою формою захворювання зі сприятливим прогнозом, то сучасніші дослідження показали більшу активність та тяжкість захворювання, а також гірші клінічні, функціональні та рентгенологічні результати. Незважаючи на сучасні досягнення в розумінні патогенезу РА та новітні стратегії в лікуванні, досі тривають суперечки щодо розуміння та менеджменту пацієнтів з РА з початком у літньому віці. Як показує клінічна практика, більшості пацієнтів з РА з початком у літньому віці призначаються лише нестероїдні протизапальні препарати (НПЗП) та глюкокортикоїди (ГК) без додавання хворобомодифікуючих протиревматичних препаратів (ХМПРП). Сучасні дані показали, що лікування літніх пацієнтів з РА часто є незадовільним через занепокоєння щодо можливих побічних ефектів ХМПРП, наявність супутніх захворювань, поліпрагмазію та когнітивну дисфункцію. Висновки. РА з початком у літньому віці являє собою унікальний клінічний профіль, такі пацієнти потребують індивідуальних стратегій лікування, обов’язкового додавання чи переходу на ХМПРП на підставі активності захворювання, супутніх захворювань і міркувань безпеки, щоб оптимізувати результати лікування та мінімізувати прийом ГК і НПЗП, тим самим підвищуючи якість лікування літніх пацієнтів.
Background. Elderly-onset rheumatoid arthritis (EORA) is characterized by the disease onset after 60 years. Given the importance of the global increase in the proportion of older people in the population and the potential consequences, the problem of diagnosis and treatment of EORA is quite relevant. Purpose: to analyze the current literature data on the peculiarities of the clinical picture, differential diagnosis, and treatment of patients with EORA, taking into account comorbidity. Materials and methods. An analytical review of literature data was conducted using information analysis of the databases PubMed, Web of Science, Scopus, and Google Scholar for the period 2013–2023, but it did not exclude key works that were published earlier, using the keywords “elderly-onset rheumatoid arthritis”, “rheumatoid arthritis”, “diagnosis”, “treatment”, “prognosis”. Results. A review of the literature demonstrated that while previous studies have mainly argued that EORA is a milder form of the disease with a favorable prognosis, recent studies have shown greater disease activity and severity, as well as worse clinical, functional, and radiological outcomes. Despite recent advances in the understanding of RA pathogenesis and new treatment strategies, there is still controversy regarding the management of EORA patients. Clinical practice shows that most patients with EORA are prescribed purely nonsteroidal anti-inflammatory drugs (NSAID) and glucocorticoids (GC) without the addition of disease-modifying antirheumatic drugs (DMARD). Real-world data have demonstrated that the treatment of elderly patients with RA is often unsatisfactory due to concerns about the possible side effects of DMARD, the presence of comorbidities, polypharmacy, and cognitive dysfunction in elderly patients. Conclusions. EORA presents a unique clinical profile, such patients require individualized treatment strategies, mandatory addition or switch to DMARD based on disease activity, comorbidities, and safety considerations to optimize treatment outcomes and minimize GC and NSAIDs intake, thereby improving the quality of treatment of elderly patients.
ревматоїдний артрит з початком у літньому віці; ревматоїдний артрит; діагностика; лікування; прогноз
elderly-onset rheumatoid arthritis; rheumatoid arthritis; diagnosis; treatment; prognosis
Вступ
Матеріали та методи
Результати
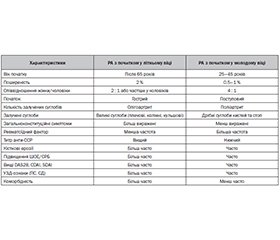
Клінічні відмінності між РА з початком у літньому та молодому віці
Супутні захворювання у пацієнтів з РА з початком у літньому віці
Лікування
Висновки
- Kobak S., Bes C. An autumn tale: Geriatric rheumatoid arthritis. Ther. Adv. Musculoskelet. Dis. 2018. 10(1). 3-11. doi: 10.1177/1759720X17740075.
- Uchiyama S., Takanashi S.M., Gono T., Kaneko Y., Takeuchi T., Kuwana M. Should we reconsider the definition of elderly-onset rheumatoid arthritis in an ageing society? Mod. Rheumatol. 2022. 32(2). 323-329. doi: 10.1093/mr/roab013.
- Pavlov-Dolijanovic S., Bogojevic M., Nozica-Radulovic T., Radunovic G., Mujovic N. Elderly-onset rheumatoid arthritis: characteristics and treatment options. Medicine. 2023. 59(10). 1878. doi: 10.3390/medicina59101878.
- Rasch E.K., Hirsch R., Paulose-Ram R. et al. Prevalence of rheumatoid arthritis in persons 60 years of age and older in the United States. Arthritis Rheum. 2003. 48. 917-926.
- Ke Y., Dai X., Xu D. et al. Features and Outcomes of Elderly Rheumatoid Arthritis: Does the Age of Onset Matter? A Comparative Study From a Single Center in China. Rheumatol. Ther. 2021. 8(1). 243-254. doi: 10.1007/s40744-020-00267-8.
- Corrigan A.B., Robinson R.G., Terenty T.R., Dick-Smith J.B., Walters D. Benign rheumatoid arthritis of the aged. Br. Med. J. 1974. 1(5905). 444-6. doi: 10.1136/bmj.1.5905.444.
- Shiozawa K., Tanaka Y., Imura S. et al. Elderly-onset rheumatoid arthritis: ageing as an independent marker for better joint prognosis. Japanese Journal of Rheumatology. 1997. 7. 103-114. https://doi.org/10.1007/BF03041300.
- Targońska-Stępniak B., Grzechnik K., Kolarz K., Gagoł D., Majdan M. Systemic Inflammatory Parameters in Patients with Elderly-Onset Rheumatoid Arthritis (EORA) and Young-Onset Rheumatoid Arthritis (YORA) — An Observational Study. J. Clin. Med. 2021. 10(6). 1204. doi: 10.3390/jcm10061204.
- Nilsson J., Andersson M.L.E., Hafström I. et al. Influence of Age and Sex on Disease Course and Treatment in Rheumatoid Arthritis. Open Access Rheumatol. 2021. 13. 123-138. doi: 10.2147/OARRR.S306378.
- Soubrier M., Mathieu S., Payet S., Dubost J.J., Ristori J.M. Elderly-onset rheumatoid arthritis. Jt. Bone Spine. 2010. 77(4). 290-296. doi: 10.1016/j.jbspin.2010.04.004.
- Murata K., Ito H., Hashimoto M. et al. Elderly onset of early rheumatoid arthritis is a risk factor for bone erosions, refractory to treatment: KURAMA cohort. Int. J. Rheum. Dis. 2019. 22(6). 1084-1093. doi: 10.1111/1756-185X.13428.
- Romão V.C., Humby F., Kelly S. et al. Treatment-resistant synovitis and radiographic progression are increased in elderly-onset rheumatoid arthritis patients: findings from a prospective observational longitudinal early arthritis cohort study. Semin. Arthritis Rheum. 2020. 50(4). 735-743. doi: 10.1016/j.semarthrit.2020.03.018.
- Nishimura K., Sugiyama D., Kogata Y. et al. Meta-analysis: Diagnostic accuracy of anti-cyclic citrullinated peptide antibody and rheumatoid factor for rheumatoid arthritis. Ann. Intern. Med. 2007. 146(11). 797-808. doi: 10.7326/0003-4819-146-11-200706050-00008.
- Innala L., Berglin E., Möller B. et al. Age at onset determines severity and choice of treatment in early rheumatoid arthritis: A prospective study. Arthritis Res. Ther. 2014. 16(2). R94. doi: 10.1186/ar4540.
- Radu A.F., Bungau S.G. Nanomedical approaches in the realm of rheumatoid arthritis. Ageing Res. Rev. 2023. 87. 101927. doi: 10.1016/j.arr.2023.101927.
- Nawata M., Someya K., Kosaka S. et al. Usefulnessof ultrasound as a predictor of elderly-onset rheumatoid arthritis with polymyalgia rheumatica-like onset. Mod. Rheumatol. 2023. 33(2). 318-322. doi: 10.1093/mr/roac024.
- Origuchi T., Arima K., Umeda M. et al. Clinical outcomes in the first year of remitting seronegative symmetrical synovitis with pitting edema (RS3PE) syndrome. Mod. Rheumatol. 2017. 27(1). 150-154. doi: 10.1080/14397595.2016.1192744.
- Balsa A., Lojo-Oliveira L., Alperi-López M. et al. Prevalence of comorbidities in rheumatoid arthritis and evaluation of their monitoring in clinical practice: the spanish cohort of the COMORA study. Reumatol. Clin. (Engl. Ed.). 2019. 15(2). 102-108. doi: 10.1016/j.reuma.2017.06.002.
- Ramos A.L., Redeker I., Hoffmann F., Callhoff J., Zink A., Albrecht K. Comorbidities in Patients with Rheumatoid Arthritis and Their Association with Patient-reported Outcomes: Results of Claims Data Linked to Questionnaire Survey. The Journal of Rheumatology January. 2019. Jrheum. 180668; DOI: https://doi.org/10.3899/jrheum.180668.
- Dessein P.H., Joffe B.I., Veller M.G. et al. Traditio–nal and nontraditional cardiovascular risk factors are associated with atherosclerosis in rheumatoid arthritis. J. Rheumatol. 2005. 32(3). 435-42.
- Franklin J., Lunt M., Bunn D., Symmons D., Silman A. Risk and predictors of infection leading to hospitalisation in a large primary-care-derived cohort of patients with inflammatory polyarthritis. Ann. Rheum. Dis. 2007. 66(3). 308-12. doi: 10.1136/ard.2006.057265.
- Doran M.F., Crowson C.S., Pond G.R., O’Fallon W.M., Gabriel S.E. Frequency of infection in patients with rheumatoid arthritis compared with controls: a population-based study. Arthritis Rheum. 2002. 46(9). 2287-93. doi: 10.1002/art.10524.
- Widdifield J., Bernatsky S., Paterson J.M., et al. Serious infections in a population-based cohort of 86,039 seniors with rheumatoid arthritis. Arthritis Care Res. (Hoboken). 2013. 65(3). 353-6. doi: 10.1002/acr.21812.
- Schneeweiss S., Setoguchi S., Weinblatt M.E., et al. Anti-tumor necrosis factor alpha therapy and the risk of serious bacterial infections in elderly patients with rheumatoid arthritis. Arthritis Rheum. 2007. 56(6). 1754-64. doi: 10.1002/art.22600.
- Bongartz T., Nannini C., Medina-Velasquez Y.F. et al. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: A population-based study. Arthritis Rheum. 2010. 62(6). 1583-1591. doi: 10.1002/art.27405.
- Parikh-Patel A., White R.H., Allen M., Cress R. Risk of cancer among rheumatoid arthritis patients in California. Cancer Causes Control. 2009. 20(6). 1001-10. doi: 10.1007/s10552-009-9298-y.
- Smolen J.S., Landewé R.B.M., Bijlsma J.W.J. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Ann. Rheum. Dis. 2020. 79(6). 685-699. doi: 10.1136/annrheumdis-2019-216655.
- Palmowski A., Boyadzhieva Z., Nielsen S.M. et al. Sex and age do not modify the association between glucocorticoids and bone mineral density in patients with rheumatoid arthritis: a cross-sectional study. Arthritis Res. Ther. 2023. 25(1). 98. doi: 10.1186/s13075-023-03083-x.
- Monteiro C., Silvestre S., Duarte A.P., Alves G. Safety of Non-Steroidal Anti-Inflammatory Drugs in the Elderly: An Analysis of Published Literature and Reports Sent to the Portuguese Pharmacovigilance System. Int. J. Environ Res. Public Health. 2022. 19(6). 3541. doi: 10.3390/ijerph19063541.
- Lim C.H., Chen H.-H., Chen Y.-H. et al. The risk of tuberculosis disease in rheumatoid arthritis patients on biologics and targeted therapy: a 15-year real world experience in Taiwan. PLoS One. 2017. 12. e0178035. doi: 10.1371/journal.pone.0178035.
- Kawashima H., Kagami S., Kashiwakuma D. et al. Long-term use of biologic agents does not increase the risk of serious infections in elderly patients with rheumatoid arthritis. Rheumatol. Int. 2017. 37. 369-76. doi: 10.1007/s00296-016-3631-z.
- Boers M., Hartman L., Opris-Belinski D. et al. GLORIA Trial consortium. Low dose, add-on prednisolone in patients with rheumatoid arthritis aged 65+: The pragmatic randomised, double-blind placebo-controlled –GLORIA trial. Ann. Rheum. Dis. 2022. 81(7). 925-936. doi: 10.1136/annrheumdis-2021-221957.
- Rempenault C., Combe B., Barnetche T. et al. Metabolic and cardiovascular benefits of hydroxychloroquine in patients with rheumatoid arthritis: A systematic review and meta-analysis. Ann. Rheum. Dis. 2018. 77(1). 98-103. doi: 10.1136/annrheumdis-2017-211836.
- Melles R.D., Jorge A.M., Marmor M.F. et al. Hydroxychloroquine Dose and Risk for Incident Retinopathy: A Cohort Study. Ann. Intern. Med. 2023. 176(2). 166-173. doi: 10.7326/M22-2453.
- Won S., Cho S.K., Kim D. et al. Update on the prevalence and incidence of rheumatoid arthritis in Korea and an analysis of medical care and drug utilization. Rheumatol. Int. 2018. 38(4). 649-656. doi: 10.1007/s00296-017-3925-9.
- Tutuncu Z., Reed G., Kremer J., Kavanaugh A. Do patients with older-onset rheumatoid arthritis receive less aggressive treatment? Ann. Rheum. Dis. 2006. 65(9). 1226-1229. doi: 10.1136/ard.2005.051144.
- Bayrak E.D., Aktas I. Efficacy and gastrointestinal tolerability of methotrexate in late-onset rheumatoid arthritis patients: a prospective cohort study. Egypt Rheumatol. Rehabil. 2023. 50(1). 8. doi: 10.1186/s43166-023-00178-w.
- Bernatsky S., Ehrmann Feldman D. Discontinuation of methotrexate therapy in older patients with newly diagnosed rheumatoid arthritis: Analysis of administrative health databases in Québec, Canada. Drugs Aging. 2008. 25(10). 879-884. doi: 10.2165/00002512-200825100-00007.
- Sugihara T., Ishizaki, T., Onoguchi W. et al. Effectiveness and safety of treat-to-target strategy in elderly-onset rheumatoid arthritis: A 3-year prospective observational study. Rheumatology. 2021. 60(9). 4252-4261. doi: 10.1093/rheumatology/keaa922.
- Radovits B.J., Kievit W., Fransen J. et al. Influence of age on the outcome of antitumour necrosis factor alpha therapy in rheumatoid arthritis. Ann. Rheum. Dis. 2009. 68(9). 1470-1473. doi: 10.1136/ard.2008.094730.
- Sugihara Т., Harigai М. Targeting Low Disease Activity in Elderly-Onset Rheumatoid Arthritis: Current and Future Roles of Biological Disease-Modifying Antirheumatic Drugs. Drugs Aging. 2016. 33. 97-107. doi: 10.1007/s40266-015-0341-2.
- Jinno S., Onishi A., Dubreuil M. et al. Comparison of the efficacy and safety of biologic agents between elderly-onset and young-onset RA patients: The ANSWER cohort study. Rheumatol. Int. 2020. 40(12). 1987-1995. doi: 10.1007/s00296-020-04660-y.
- Chen D.Y., Hsieh T.Y., Chen Y.M., Hsieh C.W., Lan J.L., Lin F.J. Proinflammatory cytokine profiles of patients with elderly-onset rheumatoid arthritis: A comparison with younger-onset disease. Gerontology. 2009. 55(3). 250-258. doi: 10.1159/000164393.
- Pers Y.M., Schaub R., Constant E. et al. Efficacy and safety of tocilizumab in elderly patients with rheumatoid arthritis. Jt. Bone Spine. 2015. 82(1). 25-30. doi: 10.1016/j.jbspin.2014.07.010.
- Payet S., Soubrier M., Perrodeau E. et al. Efficacy and safety of rituximab in elderly patients with rheumatoid arthritis enrolled in a French Society of Rheumatology registry. Arthritis Care Res. (Hoboken). 2014. 66(9). 1289-95. doi: 10.1002/acr.22314.
- Sakai R., Cho S.K., Nanki T. et al. Head-tohead comparison of the safety of tocilizumab and tumor necrosis factor inhibitors in rheumatoid arthritis patients (RA) in clinical practice: Results from the registry of Japanese RA patients on biologics for long-term safety (REAL) registry. Arthritis Res. Ther. 2015. 17(1). 74. doi: 10.1186/s13075-015-0583-8.
- Mariette X., Matucci-Cerinic M., Pavelka K. et al. Malignancies associated with tumour necrosis factor inhibitors in registries and prospective observational studies: A systematic review and meta-analysis. Ann. Rheum. Dis. 2011. 70. 1895-1904. doi: 10.1136/ard.2010.149419.
- Novella-Navarro M., Balsa A. Difficult-to-Treat Rheumatoid Arthritis in Older Adults: Implications of Ageing for Managing Patients. Drugs Aging. 2022. 39(11). 841-849. doi: 10.1007/s40266-022-00976-5.
- Curtis J.R., Schulze-Koops H., Takiya L., Mebus C.A., Terry K.K., Biswas P., Jones T.V. Efficacy and safety of tofacitinib in older and younger patients with rheumatoid arthritis. Clin. Exp. Rheumatol. 2017. 35(3). 390-400. PMID: 28079500.
- Fleischmann R., Alam J., Arora V., Bradley, J., Schlichting D.E., Muram D., Smolen J.S. Safety and efficacy of baricitinib in elderly patients with rheumatoid arthritis. RMD Open. 2017. 3(2). e000546. doi: 10.1136/rmdopen-2017-000546.
- Ytterberg S.R., Bhatt D.L., Mikuls T.R. et al. ORAL Surveillance Investigators. Cardiovascular and Cancer Risk with Tofacitinib in Rheumatoid Arthritis. N. Engl. J. Med. 2022. 386(4). 316-326. doi: 10.1056/NEJMoa2109927.

/88.jpg)
/89.jpg)