Журнал «Боль. Суставы. Позвоночник» Том 14, №2, 2024
Вернуться к номеру
Вплив глюкокортикоїдів на стан кісткової тканини у хворих на хронічне обструктивне захворювання легень
Авторы: Масік Н.П., Масік О.І., Нюшко Т.Ю.
Вінницький національний медичний університет імені М.І. Пирогова, м. Вінниця, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
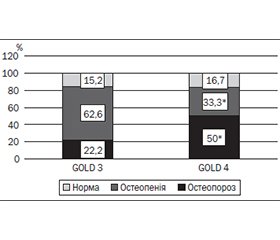
Актуальність. Згідно з рекомендаціями GOLD при загостреннях хронічного обструктивного захворювання легень (ХОЗЛ) доцільне призначення глюкокортикоїдів (ГК), які в терапевтичній дозі можуть знижувати мінеральну щільність кісткової тканини (МЩКТ). Мета: визначити вплив ГК на МЩКТ і частоту глюкокортикоїд-індукованого остеопорозу у хворих на ХОЗЛ залежно від призначеної терапії. Матеріали та методи. Обстежено 202 пацієнти з ХОЗЛ групи Е у фазі загострення. І групу становили 129 хворих, які приймали базисну подвійну терапію, ІІ групу — 73 пацієнти, які приймали потрійну терапію з використанням інгаляційних ГК. При загостренні призначали системні ГК у кумулятивній дозі 352,94 ± 30,51 мг/рік. Досліджували кісткову тканину з використанням денситометра SONOST-2000, вимірюючи швидкість поширення ультразвуку (ШПУ), широкосмугове ослаблення ультразвуку (ШОУ), індекс міцності (ІМ) кісткової тканини, T- і Z-індекси. Результати. Встановлено зниження ІМ, ШОУ, Т- і Z-показників у 43,51 % обстежених І групи і 83,56 % ІІ групи (р < 0,05). У ІІ групі ІМ був нижчим на 9,54 %, ШПУ — на 14,35 %, ШОУ — на 14,57 %, Т-критерій — на 6,9 %, Z-критерій — на 25,86 %; при GOLD 3: ШОУ — на 40,27 %, ІМ — на 3,25 %, Т-критерій — на 17,9 %; при GOLD 4: ІМ — на 19,9 %, ШОУ — на 77,8 %, Т-індекс — на 5,6 % порівняно з показниками І групи. Висновки. За даними ультразвукової денситометрії, глюкокортикоїд-індукований остеопороз діагностовано в 10,71 % хворих І групи і 20,55 % хворих ІІ групи, при цьому його частота залежала від стадії ХОЗЛ: при GOLD 3 він виявлявся в 22,22 % обстежених осіб, при GOLD 4 — у 50,0 %.
Background. According to the GOLD guidelines, glucocorticoids (GCs) are recommended for exacerbations of chronic obstructive pulmonary disease (COPD). Bone mineral density (BMD) can be reduced in case of the use of therapeutic doses of GCs. The aim of the study was to determine the influence of GCs on BMD and the frequency of osteoporosis in patients with COPD depending on the prescribed therapy. Materials and methods. We examined 202 patients with COPD (group E) in the acute phase. Group I consisted of 129 patients taking basic dual treatment, group II — 73 patients taking triple therapy with inhaled GCs. During exacerbations, systemic GCs were prescribed at the cumulative dose of 352.94 ± 30.51 mg/year. The bone state was examined using an ultrasound densitometer SONOST-2000. A Speed of Sound (SOS), Broadband Ultrasound Attenuation (BUA), Stiffness index (SI), and T- and Z-scores were determined. Results. Decreases in SI, BUA, T- and Z- scores were established in 43.51 % of the patients from the I group and 83.56 % from the II group (p < 0.05). In the II group, SI was lower by 9.54 %, BUA — by 14.35 %, SOS — by 14.57 %, T- score — by 6.9 %, Z- score — by 25.86 %; in subjects with GOLD 3: BUA — by 40.27 %, SI — by 3.25 %, T- score — by 17.9 %; in patients with GOLD 4: SI — by 19.9 %, BUA — by 77.8 %, T- score — by 5.6 % compared to the I group. Conclusions. Glucocorticoid-induced osteoporosis was diagnosed in 10.71 % of patients from the I group and 20.55 % of the II group. Its frequency depended on the stage of COPD: GOLD 3 — in 22.22 % of patients, GOLD 4 — in 50.0 % of the subjects.
хронічне обструктивне захворювання легень; глюкокортикоїди; мінеральна щільність кісткової тканини; остеопороз
chronic obstructive pulmonary disease; glucocorticosteroids; bone mineral density; osteoporosis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Global Strategy for the Diagnosis, Management and Prevention of COPD. 2022. Report. www.goldcopd.org.
- Feshchenko YI, Gavrysyuk VK, Dziublyk AY et al. Adapted clinical guideline: chronic obstructive pulmonary disease. Ukr Pulmonol J. 2020;3:5-36. doi: 10.31215/2306-4927-2020-109-3-5-36 (In Ukrainian).
- Chen YW, Ramsook AH, Coxson HO, et al. Prevalence and risk factors for osteoporosis in individuals with COPD: a systematic review and meta-analysis. Chest. 2019;156(6):1092-1110. doi: 10.1016/j.chest.2019.06.036.
- Akyea RK, McKeever TM, Gibson J, et al. Predic–ting fracture risk in patients with chronic obstructive pulmonary disease: a UK-based population-based cohort study. BMJ Open. 2019 Apr 3;9(4):e024951. doi: 10.1136/bmjopen-2018-024951.
- Bitar AN, Syed Sulaiman SA, Ali IAH, et al. Osteoporosis among patients with chronic obstructive pulmonary disease: systematic review and meta-analysis of prevalence, severity, and therapeutic outcomes. J Pharm Bioallied Sci. 2019;11(4):310-320. doi: 10.4103/jpbs.JPBS_126_19.
- Peng CH, Lin WY, Yeh KT, et al. The molecular etio–logy and treatment of glucocorticoid-induced osteoporosis. Tzu Chi Med J. 2021 Apr 1;33(3):212-223. doi: 10.4103/tcmj.tcmj_233_20.
- Hardy RS, Zhou H, Seibel MJ, Cooper MS. Glucocorticoids and Bone: Consequences of Endogenous and –Exogenous Excess and Replacement Therapy. Endocrine Rev. 2018;39:519-48. doi: 10.1210/er.2018-00097.
- Ozcakir S, Sigirli D, Ursavas A, Uzaslan E. COPD and Osteoporosis: Associated Factors in Patients Treated with Inhaled Corticosteroids. Int J Chron Obstruct Pulmon Dis. 2020 Oct 9;15:2441-2448. doi: 10.2147/COPD.S274728.
- Gado M, Baschant U, Hofbauer LC, Henneicke H. Bad to the Bone: The Effects of Therapeutic Glucocorticoids on Osteoblasts and Osteocytes. Front Endocrinol (Lausanne). 2022 Mar 31;13:835720. doi: 10.3389/fendo.2022.835720.
- Tse G, Emmanuel B, Ariti C, et al. A Long-Term Study of Adverse Outcomes Associated With Oral Corticosteroid Use in COPD. Int J Chron Obstruct Pulmon Dis. 2023 Nov 15;18:2565-2580. doi: 10.2147/COPD.S433326.
- Galerneau LM, Bailly S, Terzi N. et al. OUTCOMEREA network. Corticosteroids for severe acute exacerbations of chronic obstructive pulmonary disease in intensive care: From the French OUTCOMEREA cohort. PLoS One. 2023 Apr 19;18(4):e0284591. doi: 10.1371/journal.pone.0284591.
- Del Pozo V, Bobolea I, Rial MJ, et al. Expert consensus on the use of systemic glucocorticoids for mana–ging eosinophil-related diseases. Front Immunol. 2024 Jan 5;14:1310211. doi: 10.3389/fimmu.2023.1310211.
- Czira A, Banks V, Requena G, et al. Treatment pathways, economic burden and clinical outcomes in new users of inhaled corticosteroid/long-acting B2-agonist dual therapy with chronic obstructive pulmonary disease in a primary care setting in England: a retrospective cohort study. BMJ Open. 2024 Feb 7;14(2):e072361. doi: 10.1136/bmjopen-2023-072361.
- Rekalov D, Dotsenko S, Kulinich R, et al. Glucocorticoids in rheumatology — NEMO SINE VITIIS EST. Ukrainian Journal of Rheumatology. 2023;4(94):23-31. doi: 10.32471/rheumatology.27076970.94.18360. (In Ukrainian).
- Khodosh EM, Nartov PV, Yakovenko OK, et al. The logic of glucocorticoid therapy. Аsthma and allergy. 2023; 1:63-71. doi: 10.31655/2307-3373-2023-1-63-71. (In Ukrainian).
- Caramori G, Ruggeri P, Arpinelli F, et al. Long-term use of inhaled glucocorticoids in patients with stable chronic obstructive pulmonary disease and risk of bone fractures: a narrative review of the literature. Int J Chron Obstruct Pulmon Dis. 2019 May 23;14:1085-1097. doi: 10.2147/COPD.S190215.
- Kerwin EM, Ferguson GT, Mo M, et al. Bone and ocular safety of budesonide/glycopyrrolate/formoterol fumarate metered dose inhaler in COPD: a 52-week rando–mized study. Respir Res. 2019;20:167. doi: 10.1186/s12931-019-1126-7.
- Maltais F, Schenkenberger I, Wielders PLML, et al. Effect of once-daily fluticasone furoate/vilanterol versus vilanterol alone on bone mineral density in patients with COPD: a randomised, controlled trial. Ther Adv Respir Dis. 2020;14:1753466620965145.
- Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020;383(1):35-48. doi: 10.1056/NEJMoa1916046.
- Lu C, Mao X. Risk of adverse reactions associated with inhaled corticosteroids for chronic obstructive pulmonary disease: A meta-analysis. Medicine (Baltimore). 2024 Jan 19;103(3):e36609. doi: 10.1097/MD.0000000000036609.
- Grygorieva NV, Kovalenko VM, Коrzh МО, et al. Guideline for diagnostic, prevention and treatment of postmenopausal osteoporosis. Pain, joints, spine. 2023;13(3):128-154. doi: 10.22141/pjs.13.3.2023.378. (In Ukrainian).
- Chanprasertpinyo W, Punsawad C, Khwanchuea R, et al. Comparison between calcaneus quantitative ultrasound and the gold standard DXA in the ability to detect osteoporosis in chronic obstructive pulmonary disease patients. J Orthop Surg Res. 2023 Oct 16;18(1):778. doi: 10.1186/s13018-023-04211-8.
- Janson C, Lisspers K, Ställberg B, et al. Osteoporosis and fracture risk associated with inhaled corticosteroid use among Swedish COPD patients: the –ARCTIC study. Eur Respir J. 2021 Feb 17;57(2):2000515. doi: 10.1183/13993003.00515-2020.
- Price DB, Voorham J, Brusselle G, et al. Inhaled corticosteroids in COPD and onset of type 2 diabetes and osteoporosis: matched cohort study. NPJ Prim Care Respir Med. 2019;29:38. doi: 10.1038/s41533-019-0150-x.
- Miravitlles M, Auladell-Rispau A, Monteagudo M, et al. Systematic review on long-term adverse effects of inhaled corticosteroids in the treatment of COPD. Eur Respir Rev. 2021 Jun 23;30(160):210075. doi: 10.1183/16000617.0075-2021.
- Song JE, Bak SH, Lim MN, et al. CT-Derived Deep Learning-Based Quantification of Body Composition Associated with Disease Severity in Chronic Obstructive Pulmonary Disease. J Korean Soc Radiol. 2023 Sep;84(5):1123-1133. doi: 10.3348/jksr.2022.0152.
- Price D, Chen S, Kerkhof M, et al. Disease burden for patients with chronic obstructive pulmonary disease receiving maintenance therapy. Am J Resp Crit Care Med. 2020;201:A2553. https://doi.org/10.1164/ajrccm-conference.2020.201.1_MeetingAbstracts.A2553.
- Eslaminejad AR, Sharifi H, Sadr M, et al. Prevalence and Associated Factors of Osteoporosis in Chro–nic Obstructive Pulmonary Disease Patients. J Iran Med Counc. 2023;6(1):82-91. http://dx.doi.org/10.18502/jimc.v6i1.11846
- Voorham J, Xu X, Price DB, et al. Healthcare resource utilization and costs associated with incremental systemic corticosteroid exposure in asthma. Allergy. 2019 Feb;74(2):273-283. doi: 10.1111/all.13556.
- Price DB, Trudo F, Voorham J, et al. Adverse outcomes from initiation of systemic corticosteroids for asthma: long-term observational study. J Asthma Allergy. 2018 Aug 29;11:193-204. doi: 10.2147/JAA.S176026.