Журнал «Травма» Том 26, №6, 2025
Вернуться к номеру
Гігантоклітинна пухлина дистального відділу променевої кістки, результати хірургічного лікування
Авторы: Проценко В.В. (1), Бур’янов О.А. (2), Чорний В.С. (2), Кухарук А.С. (2), Солоніцин Є.О. (1)
(1) - ДУ «Інститут травматології та ортопедії НАМН України», м. Київ, Україна
(2) - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
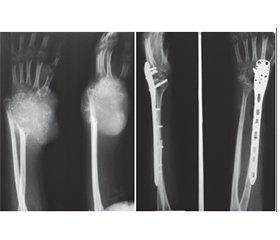
Актуальність. Гігантоклітинна пухлина (ГКП) дистального відділу променевої кістки є доброякісною, місцевоагресивною пухлиною, яка характеризується частими рецидивами та має певний метастатичний потенціал. Внутрішньокісткова або сегментарна резекція дистального відділу променевої кістки з ГКП створює дефект у дистальному відділі променевої кістки. Основними хірургічними методиками реконструкції такого дефекту є застосування спонгіозних ало-/автотрансплантатів, штучних матеріалів, поліметилметакрилату, васкуляризованих і неваскуляризованих кісткових автотрансплантатів, кістково-суглобових алотрансплантатів та індивідуальних ендопротезів. Ми проводили оцінку онкологічних, хірургічних і функціональних результатів при ГКП дистального відділу променевої кістки з урахуванням різних методик хірургічних втручань і реконструкцій. Мета: хірургічне видалення ГКП дистального відділу променевої кістки, зниження ймовірності рецидиву пухлини та збереження функції променево-зап’ясткового суглоба. Матеріали та методи. Проведено хірургічне лікування 21 хворого з ГКП дистального відділу променевої кістки. Середній вік хворих становив 28,7 року (діапазон від 18 до 39 років). Проліковано 8 (38,1 %) пацієнтів із ГКП II/III ступеня (за Кампаначчі) дистального відділу променевої кістки, після резекції дистального сегмента променевої кістки з пухлиною та реконструкції дефекту кістки за допомогою неваскуляризованого малогомілкового автотрансплантата проксимального відділу малогомілкової кістки, фіксованого за допомогою пластини або серкляжів до залишку променевої кістки. 7 (33,3 %) пацієнтам із ГКП I ступеня (за Кампаначчі) проведена внутрішньокісткова резекція дистального відділу променевої кістки з пухлиною та пластика дефекту кістки матеріалом на основі біоактивного скла (біокомпозитом) або спонгіозна автопластика. 1 (4,8 %) пацієнту з ГКП II ступеня (за Кампаначчі) та 2 (9,5 %) пацієнтам із рецидивом пухлини виконана внутрішньокісткова резекція дистального відділу променевої кістки з пухлиною та пластика дефекту поліметилметакрилатом (кістковим цементом), 2 (9,5 %) пацієнтам із ГКП III ступеня (за Кампаначчі) та 1 (4,8 %) пацієнту після повторних рецидивів пухлини виконано сегментарну резекцію кістки із заміщенням дефекту автотрансплантатом із проксимального відділу малогомілкової кістки й артродез у променево-зап’ястковому суглобі. Результати. Середній період спостереження становив 5,5 року (2,8–11,2 року). Унаслідок проведеного лікування у 3 (14,3 %) пацієнтів спостерігалися ускладнення — вивих автотрансплантата у променево-зап’ястковому суглобі при застосуванні неваскуляризованого малогомілкового автотрансплантата, вивих виправлено за рахунок повторного хірургічного втручання. Рецидиви пухлини спостерігалися у 3 (14,3 %) пацієнтів. У першому випадку після внутрішньокісткової резекції та пластики матеріалом на основі біоактивного скла виконано внутрішньокісткову резекцію, видалення матеріалу та пластику дефекту кістковим цементом, у другому — після внутрішньокісткової резекції та спонгіозної автопластики виконано внутрішньокісткову резекцію, видалення матеріалу та пластику дефекту кістковим цементом, у третьому — після внутрішньокісткової резекції та пластики кістковим цементом у зв’язку з повторним рецидивом пухлини виконано резекцію дистального сегмента променевої кістки з рецидивом пухлини й артродез у променево-зап’ястковому суглобі за допомогою автотрансплантата та металоостеосинтезу пластиною. Функціональні результати верхньої кінцівки після органозберігаючих операцій із приводу ГКП дистального відділу променевої кістки за шкалою MSTS становили в середньому: після внутрішньокісткової резекції та пластики матеріалом на основі біоактивного скла або спонгіозної автопластики — 98,52 % (97,7–99,9 %), після резекції дистального сегмента променевої кістки з пухлиною та реконструкції дефекту кістки за допомогою неваскуляризованого малогомілкового автотрансплантата — 89,34 % (78,6–92,5 %). Функціональні результати кінцівки оцінені у 21 пацієнта, відмінні результати отримані у 5 (23,8 %) пацієнтів, добрі — у 10 (47,6 %), задовільні — у 6 (28,6 %). Середній час зрощення у малогомілково-променевому з’єднанні після застосування неваскуляризованого малогомілкового автотрансплантата становив 7,5 місяця (3,2–16,1 місяця). Середня сила хвату прооперованої верхньої кінцівки після застосування неваскуляризованого малогомілкового автотрансплантата від нормальної сторони становила 50 % (35–69 %), а фактичне середнє значення для прооперованої сторони — 15 кг порівняно з 30 кг для протилежної нормальної сторони. Середній діапазон рухів становив: супінація передпліччя — 47° (31–69°), пронація передпліччя — 33° (16–55°), згинання кисті у долонний бік — 40° (18–67°), розгинання кисті (у тильний бік) — 29° (11–52°), при комбінованих рухах — 151° (75–180°). Загалом 59 % (24–70 %) комбінованого діапазону рухів було збережено у прооперованої сторони порівняно з протилежною нормальною стороною. 85,7 % прооперованих пацієнтів були задоволені результатами лікування. Висновки. Внутрішньокісткова резекція дистального відділу променевої кістки з пухлиною та пластика дефекту різними пластичними матеріалами є методикою вибору при ГКП I ступеня. Резекція дистального сегмента променевої кістки з пухлиною й автопластика дефекту кістки за допомогою проксимального сегмента неваскуляризованої малогомілкової кістки є ефективною методикою при ГКП II/III ступеня. Внутрішньокісткова резекція дистального відділу променевої кістки з пухлиною та пластика дефекту поліметилметакрилатом (кістковим цементом) є методикою вибору при рецидиві ГКП. Артродез у променево-зап’ястковому суглобі за допомогою автотрансплантата та металоостеосинтез пластиною є також методикою вибору при повторних рецидивах ГКП. Рецидив пухлини пов’язуємо з абластичним і радикальним видаленням ГКП. Ускладнення після органозберігаючих операцій із приводу ГКП дистального відділу променевої кістки пов’язуємо з недодержанням пацієнтами рекомендацій у післяопераційний період.
Background. Giant cell tumour (GCT) of the distal radius is a benign, locally aggressive bone tumour characterized by frequent recurrences and certain metastatic potential. Intramedullary or segmental resection of the distal radius affected by GCT results in a defect in the distal radial segment. Main surgical reconstruction techniques for such defects include the use of spongy allo- and autografts, synthetic materials, polymethylmethacrylate, vascularized and non-vascularized bone autografts, osteoarticular allografts, and custom-made endoprostheses. In this study, we evaluated the oncological, surgical, and functional outcomes of distal radius GCT with different surgical interventions and reconstruction methods. Objective: surgical excision of distal radius giant cell tumour, reduction of tumour recurrence risk, and preservation of wrist joint function. Materials and methods. Surgical treatment was performed in 21 patients with distal radius GCT. Their mean age was 28.7 years (range: 18–39 years). Eight patients (38.1 %) with Campanacci grade II/III distal radius GCT underwent resection of the distal radial segment followed by reconstruction using a non-vascularized proximal fibular autograft fixed to the remaining radius with a plate or cerclage wires. Seven patients (33.3 %) with Campanacci grade I GCT underwent intramedullary resection and defect reconstruction using bioactive glass-based biocomposite material or spongy autograft. One patient (4.8 %) with Campanacci grade II GCT and 2 patients (9.5 %) with recurrent tumours underwent intramedullary resection and reconstruction with polymethylmethacrylate (bone cement). Two patients (9.5 %) with Campanacci grade III GCT and 1 patient (4.8 %) with repeated recurrences underwent segmental bone resection with defect replacement using a proximal fibular autograft, along with wrist arthrodesis. Results. The average follow-up period was 5.5 years (range: 2.8–11.2 years). Complications occurred in 3 patients (14.3 %), all involving dislocation of the fibular autograft in the wrist joint, which was corrected by revision surgery. Tumour recurrence was detected in 3 patients (14.3 %). In the first case, after intramedullary resection and bioactive glass-based reconstruction, the tumour was re-excised, the material removed, and the defect reconstructed with bone cement. In the second case, recurrence occurred after intramedullary resection and spongy autografting, requiring cement reconstruction. In the third case, after recurrence following cement reconstruction, a distal radial resection with arthrodesis using a fibular autograft and plate osteosynthesis was performed. Functional outcomes of the upper limb after organ-preserving surgeries for distal radius GCT according to the MSTS scale averaged: 98.52 % (97.7–99.9 %) after bioactive glass or spongy autograft reconstruction, and 89.34 % (78.6–92.5 %) after resection and fibular autograft reconstruction. Functional outcomes were assessed in all 21 patients: excellent in 5 (23.8 %), good in 10 (47.6 %), and satisfactory in 6 (28.6 %). The average union time at the fibular-radial junction using a non-vascularized fibular autograft was 7.5 months (range: 3.2–16.1 months). The mean grip strength of the operated limb was 50 % (35–69 %) of the unaffected side, averaging 15 kg compared to 30 kg on the opposite side. The average range of motion included: forearm supination — 47° (31–69°), forearm pronation — 33° (16–55°), palmar flexion of the wrist — 40° (18–67°), dorsal extension of the wrist — 29° (11–52°), during combined movements — 151° (75–180°). Overall, 59 % (24–70 %) of the total motion range was preserved on the operated side compared to the normal side. A total of 85.7 % of patients were satisfied with the treatment outcomes. Conclusions. Intramedullary resection of distal radius GCT with defect reconstruction using various grafting materials is the preferred method for Campanacci grade I. Resection of the distal radial segment with fibular autograft reconstruction is effective for grade II/III tumours. Cement reconstruction is the method of choice in recurrent GCT. Wrist arthrodesis using autograft and plate osteosynthesis is preferred in cases of recurrent wrist instability. Tumour recurrence is associated with insufficient ablative and radical excision. Complications after organ-preserving surgery for distal radius GCT are linked to non-compliance with postoperative recommendations.
гігантоклітинна пухлина; променева кістка; дистальний відділ; комбіноване лікування; хірургічне лікування; функція кінцівки; рецидив пухлини
giant cell tumour; radius; distal segment; combined treatment; surgical treatment; limb function; tumour recurrence