Журнал «Травма» Том 26, №6, 2025
Вернуться к номеру
Гомеокінетична класифікація артропатій
Авторы: Сокрут М.В., Климовицький Ф.В., Сокрут О.П., Потапов Ю.О., Сокрут В.М., Литвинова О.В., Попов В.М., Муллахметов А.Г.
Донецький національний медичний університет, м. Кропивницький, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
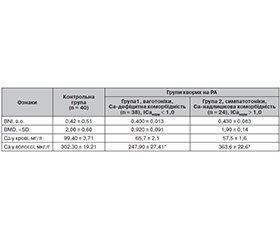
Актуальність. «Вегетативний паспорт» і коморбідність формують параметри гомеокінезу у пацієнтів з ревматоїдним артритом (РА), визначають механізми пошкодження суглобів через автоімунну агресію (серопозитивний артрит) чи окисний стрес (серонегативний артрит). Матеріали та методи. У спостереженні 62 пацієнти були розподілені за «вегетативним паспортом» і коморбідністю на дві групи: перша (38 випадків) — ваготоніки з серопозитивним РА і кальцій-дефіцитною коморбідністю. Друга група (n = 24) — симпатотоніки з серонегативним РА і кальцій-надлишковою коморбідністю. Розподіл на групи ваготоніків і симпатотоніків проводили згідно з даними спектрального аналізу серцевого ритму та автоматизованими тестами визначення «вегетативного паспорта» і форми соматогенії (https://sokrut.com/somatogenytest2). Результати. Проведена клініко-патогенетична паралель суглобового синдрому дозволила виділити дисневротичні, дисгормональні, дизімунні, дисметаболічні, дисциркуляторні, дизелементозні артропатії та розробити гомеокінетичну/патогенетичну класифікацію на базі вегетативного паспорта, порушення параметрів гомеокінезу і коморбідності. У схему реабілітаційного діагнозу запропоновано включати: «вегетативний паспорт» (ваготонік чи симпатотонік); порушення параметрів гомеокінезу на системному (дисневротичні/дисгормональні/дизімунні/дисметаболічні артропатії), органному (дисциркуляторні артропатії) та клітинному рівнях (дизелементозні артропатії); форму коморбідності (кальцій-дефіцитна чи кальцій-надлишкова), соматогенії (ацетилхолінові серотонін-дефіцитні тривожно-депресивні чи адренергічні серотонін-надлишкові паніко-фобічні); недостатність функції суглобів (НФ0–4). Висновки. Встановлені інформативні критерії визначення вегетативного паспорта, форми коморбідності і соматогенії, індекси рівноваги системи-антисистеми гомеокінезу дали змогу розробити гомеокінетичну класифікацію артропатій та запропонувати індивідуальну програму/план доказового лікування та реабілітації пацієнтів з РА.
Background. The “autonomic passport” and comorbidity form homeokinesis parameters in patients with rheumatoid arthritis (RA), determine the mechanisms of joint damage due to autoimmune aggression (seropositive arthritis) or oxidative stress (seronegative arthritis). Materials and methods. Our study involved 62 patients who were divided into two groups according to the “autonomic passport” and comorbidity: group 1 (38 cases) — vagotonics with seropositive RA and calcium-deficient comorbidity; group 2 (n = 24) — sympathotonics with seronegative RA and calcium-excessive comorbidity. The division into groups of vagotonics and sympathotonics was carried out according to the data of spectral analysis of the heart rate and automated tests for determining the “autonomic passport” and the form of somatogeny [https://sokrut.com/somatogenytest2]. Results. The conducted clinical and pathogenetic comparison of the joint syndrome allowed distinguishing dysneurotic, dyshormonal, dysimmune, dysmetabolic, dyscirculatory, dyselement arthropathies and develop a homeokinetic/pathogenetic classification based on the “autonomic passport”, violations of homeokinesis parameters and comorbidity. It is proposed to include in the rehabilitation diagnosis scheme the following: “autonomic passport” (vagotonic or sympathotonic); violation of homeokinesis parameters at the systemic (dysneurotic/dyshormonal/dysimmune/dysmetabolic arthropathies), organ (dyscirculatory arthropathies) and cellular levels (dyselemental arthropathies); form of comorbidity (calcium-deficient or calcium-excessive), somatogeny (acetylcholine serotonin-deficient anxious-depressive or adrenergic serotonin-excessive panic-phobic); insufficiency of joint function. Conclusions. The established informative criteria for determining the “autonomic passport”, forms of comorbidity and somatogeny, indices of the balance of the homeokinesis system-antisystem made it possible to develop a homeokinetic classification of arthropathies and propose an individual program/plan of evidence-based treatment and rehabilitation of RA patients.
«вегетативний паспорт»; -адренорецептори; серотонінергічні рецептори H5TR2-альфа; внутрішньоклітинний кальцій; коморбідність; гомеокінез; ревматоїдний артрит; класифікація
“autonomic passport”; -adrenoreceptors; 5-HT2A serotonergic receptors; intracellular calcium; comorbidity; homeokinesis; rheumatoid arthritis; classification