Журнал «Здоровье ребенка» 3 (54) 2014
Вернуться к номеру
Артериальная гипертензия у подростков: факторы стабилизации и прогрессирования
Авторы: Коренев Н.М., Богмат Л.Ф., Носова Е.М., Яковлева И.М., Никонова В.В., Бессонова И.Н. - ГУ «Институт охраны здоровья детей и подростков НАМН Украины», г. Харьков
Рубрики: Семейная медицина/Терапия, Кардиология, Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
На основании данных обследования 120 подростков с артериальной гипертензией было установлено, что по мере нарастания у них индекса массы тела увеличиваются глубина и частота нарушений функции эндотелия (в пробах эндотелийзависимой и эндотелийнезависимой вазодилатации), которые тесно коррелируют с нарушениями в липидном спектре крови, углеводном и пуриновом обмене, а также сопровождаются повышением уровня эндотелина-1 и факторов воспаления (С-реактивного протеина, интерлейкина-6, ФНО-α), а также микроальбуминурией. Полученные результаты могут быть использованы для выделения среди подростков с артериальной гипертензией лиц, нуждающихся в более интенсивном наблюдении и лечении с контролем метаболизма липидов, углеводов и пуринов.
На підставі даних обстеження 120 підлітків із артеріальною гіпертензією було встановлено, що при підвищенні в них індексу маси тіла збільшуються глибина і частота порушень функції ендотелію (в пробах ендотелійзалежної та ендотелійнезалежної вазодилатації), що тісно корелюють із порушеннями в ліпідному спектрі крові, вуглеводному та пуриновому обміні, а також супроводжуються підвищенням рівня ендотеліну-1, факторів запалення (С-реактивного протеїну, інтерлейкіну-6, ФНП-α) та мікроальбумінурією. Одержані результати можуть бути використані для виділення серед підлітків із АГ осіб, що потребують більш інтенсивного спостереження та лікування АГ із контролем метаболізму ліпідів, вуглеводів і пуринів.
Based on survey data of 120 adolescents with arterial hypertension it was found that with the growth of their body mass index, severity and incidence of endothelial dysfunction disorders increased (in samples of endothelium-dependent and endothelium-independent vasodilation), which are closely correlated with disturbances in blood lipid spectrum, carbohydrate and purine metabolism, and also are associated with increased levels of endothelin-1 and inflammatory factors (C-reactive protein, interleukin-6, TNF-α), as well as microalbuminuria. The findings can be used to isolate among adolescents with hypertension persons in need of more intensive supervision and treatment, with the control of lipid, carbohydrate and purine metabolism.
артериальная гипертензия, подростки, углеводный обмен, липидный спектр крови, эндотелиальная дисфункция, факторы воспаления.
артеріальна гіпертензія, підлітки, вуглеводний обмін, ліпідний спектр крові, ендотеліальна дисфункція, фактори запалення.
arterial hypertension, adolescents, carbohydrate metabolism, lipid profile, endothelial dysfunction, inflammatory factors.
Статья опубликована на с. 6-11
Прогрессирование артериальной гипертензии (АГ) с развитием осложнений, в том числе атеросклеротических и тромбоэмболических (инфаркт миокарда, инсульт), происходит под влиянием различных агрессивных факторов, воздействующих как непосредственно, так и опосредованно через формирование дисфункции эндотелия [1–5].
АГ у подростков представляет собой неоднородную группу как по механизмам формирования, так и по клинико–гемодинамическим и нейрогуморальным составляющим. У одних, преимущественно у подростков с отягощенной наследственностью, АГ формируется как самостоятельное заболевание под влиянием активации нейрогуморальных систем (САС, РААС и др.) и изменений взаимоотношений центрального и периферического звеньев гемодинамики. У других АГ является составляющей метаболического синдрома (МС), который представляет собой клинико–патогенетический симптомокомплекс взаимосвязанных нарушений процессов обмена (углеводного, липидного, пуринового), механизмов регуляции функции эндотелия и гемодинамики в целом, которые формируются на фоне нейрогуморальной дисфункции. Одним из основных условий формирования МС является наличие сниженной чувствительности тканей к инсулину, так называемая инсулинорезистентность, которая сопровождается системной гипер–инсулинемией [6–9].
Проблема АГ и ожирения, как составляющих метаболического синдрома, за последние годы приобрела масштабы эпидемии не только в нашей стране, но и во всем мире. На современном этапе жировая ткань не рассматривается лишь как энергетическое депо, ее роль выходит далеко за рамки энергетического обмена. Новые данные представляют ее как эндокринный и паракринный орган, который способен влиять на другие органы и системы [10–14].
Цель исследования — установление частоты и характера распределения факторов риска формирования осложнений у подростков с АГ в зависимости от массы тела.
Материалы и методы исследования
Под наблюдением находилось 120 подростков–юношей 13–18 лет с АГ. Контрольную группу составил 21 практически здоровый подросток с нормальной массой тела и нормальными показателями артериального давления (АД).
Диагноз АГ, ее степень и стадию устанавливали индивидуально на основании показателей суточного профиля АД, в соответствии с принятой на III конгрессе педиатров Украины Классификацией первичной артериальной гипертензии у детей (2006) и Рекомендациями Украинской ассоциации кардиологов по профилактике и лечению АГ (2013). В исследование не включались подростки с вторичными формами АГ (эндокринная патология — феохромоцитома, гипертиреоз; врожденные аномалии сердца и крупных сосудов — коарктация аорты, недостаточность клапанов аорты; воспалительные поражения и аномалии сосудов почек и др.).
Физическое развитие подростков оценивалось по показателям антропометрических параметров (рост, масса тела, объем талии (ОТ) и объем бедер (ОБ)) и расчетам индекса массы тела (ИМТ, кг/м2). Значения ИМТ оценивали по номограммам с учетом возраста и пола ребенка. ИМТ, который находился между 15 и 85 ‰, расценивался как нормальный, между 85 и 97 ‰ — как избыточная масса тела, а выше 97 ‰ — как ожирение. Показателем абдоминального ожирения у подростков после 16 лет был объем талии ≥ 94 см, а у детей до 16 лет — выше 90 ‰ (IDF, 2007).
Подростки с АГ были распределены в подгруппы в зависимости от индекса массы тела. В первую подгруппу вошли 43 подростка с артериальной гипертензией и нормальной массой тела (ИМТ не превышал 85 ‰), во вторую — 25 человек с АГ и избыточной массой тела (ИМТ находился в пределах от 85 до 97 ‰), а в третью — 52 подростка с АГ и ожирением (ИМТ превышал значения 97 ‰).
Всем исследуемым проведено суточное мониторирование АД (СМАД). СМАД проводили аппаратом АВРМ–04 (Венгрия), определяли средние значения систолического (САД) и диастолического артериального давления (ДАД) в дневное и ночное время, пульсовое давление, суточный индекс (СИ) для САТ и ДАТ.
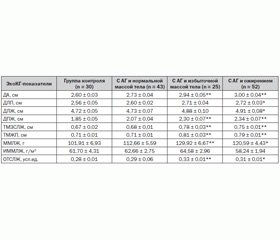
Функциональное состояние сердечно–сосудистой системы оценивали с помощью ультразвукового исследования сердца в М– и В–режимах с использованием датчика 3,5 МГц на аппарате Sonoline–SL1 фирмы Siеmens по стандартной методике, рекомендованной Ассоциацией специалистов по эхокардиографии. Определяли следующие показатели: диаметр аорты (ДА), диаметр левого предсердия (ДЛП), диаметр левого (ДЛЖ) и правого желудочков сердца (ДПЖ), толщину задней стенки левого желудочка (ТМЗСлж) и межжелудочковой перегородки (ТММЖП) и относительную толщину стенки левого желудочка (ОТСЛЖ).
Функция эндотелия сосудов оценивалась с помощью цифровой системы ультразвуковой диагностики SA 8000 Live линейным датчиком 5 МГц по методике Celermajer с соавт. [15]. Плечевую артерию визуализировали в продольном направлении на 2–5 см выше сгиба локтя. Диаметр плечевой артерии оценивали в состоянии покоя после 10–минутного отдыха. Стимулом, который вызывает зависимую от эндотелия вазодилатацию, является реактивная гиперемия, которая создается манжеткой с давлением на 40–50 мм рт.ст. выше систолического АД данного индивидуума. Диаметр оценивали после снятия манжетки через 60 с. Через 15 минут после установления диаметра артерии пациенту давали 0,5 мг нитроглицерина под язык в качестве независимого стимула. Нормальной реакцией плечевой артерии принято считать прирост ее диаметра на 10 % и более от исходного в пробе с реактивной гиперемией и на 20 % и более — в пробе с нитроглицерином.
Эндотелин–1 в сыворотке крови определялся методом иммуноферментного анализа с помощью набора DRG (International Inc., USA). Количественное определение С–реактивного протеина (СРП) в сыворотке крови проводилось с помощью конкурентного твердофазного иммуноферментного анализа. Содержание ИЛ–6 в сыворотке крови определялось твердофазным иммуноферментным методом с использованием тест–систем «ИЛ–6 ИФА–Бест», (г. Новосибирск, Россия); содержание ФНО–-а — с использованием тест–систем «ФНО–а ИФА–Бест» (ЗАТ «Вектор–Бест», г. Новосибирск, Россия) на иммуноферментном анализаторе Human–reader фирмы Human (Германия).
Определение уровня мочевой кислоты в сыворотке крови проводили энзиматическим колориметрическим методом с уриказой и пероксидазой с использованием диагностических наборов Liquick Cor–UA (Польша).
Статистическая обработка материала проведена на IBM PC/Pentium–4 с использованием пакета прикладних программ SPSS 17.0.
Результаты и обсуждение
Анализ средних значений антропометрических показателей исследуемых подростков свидетельствует о достоверном превышении массы тела, индекса массы тела, ОТ, ОБ, а также индекса ОТ/ОБ в подгруппах пациентов с избыточной массой тела и ожирением (табл. 1).
Показатели суточного мониторирования АД свидетельствуют о том, что у подростков с АГ и нормальной массой тела плотность гипертензии в течение суток значительно превосходит ее плотность как у подростков с избыточной массой тела, так и с ожирением (табл. 2). Так, у под–ростков с АГ и избыточной массой тела частота регистрации повышенного как систолического, так и диастолического АД находилась в пределах от 21,2 до 31,3 % времени суток, у подростков с АГ и ожирением — от 20,1 до 43,0 %, преобладая в ночное время, в то время как у юношей с АГ и нормальной массой тела — от 28,0 до 45,6 % времени суток, также преобладая в ночное время.
Доказано, что формирование различных вариантов гипертрофии миокарда является независимым фактором риска развития таких осложнений АГ, как ишемическая болезнь сердца, инфаркт миокарда, аритмии, хроническая сердечная недостаточность [16–17].
При изучении основных морфофункциональных параметров сердца (по данным ЭхоКГ) было установлено, что у подростков с АГ по мере нарастания массы тела происходит перестройка миокарда с вовлечением в процесс как левого, так и правого желудочков сердца, левого предсердия, с развитием гипертрофии миокарда (эксцентрической, концентрического ремоделирования).
Известно, что формирование АГ ассоциируется с нарушением не только адекватного контроля тонуса периферических сосудов, но прежде всего с нарушением функции эндотелия. При этом снижается способность эндотелия выделять релаксирующие факторы, но сохраняется или даже увеличивается продукция сосудосуживающих компонентов [3, 18].
При изучении показателей эндотелиальной функции (ЭФ) у подростков с АГ в зависимости от массы тела было установлено (табл. 4), что исходные показатели диаметра плечевой артерии не отличались в исследуемых подгруппах.
Процент прироста диаметра артерии после реактивной гиперемии у подростков с АГ и нормальной массой тела достиг в среднем 14,2 %, что отвечает нормальным значениям, но при этом у 40,9 % из них этот показатель не достигал 10 %.
У пациентов с АГ и избыточной массой тела процент прироста диаметра плечевой артерии на эндотелийзависимый стимул по группе в целом также был лишь несколько выше 10 % (11,15 ± 0,03 %), но у 48,6 % лиц он не достиг этого уровня.
В группе юношей с АГ и ожирением процент прироста диаметра у большинства (70,00 ± 6,48 %) в пробе с реактивной гиперемией не достиг нормальных значений и в среднем составил 6,6 % (табл. 4).
При проведении пробы с нитроглицерином (стимулированная эндотелийнезависимая вазодилатация) установлено, что у подростков с АГ и нормальной массой тела прирост диаметра плечевой артерии соответствовал норме — 23,80 ± 0,02 %, у пациентов с АГ и избыточной массой тела — лишь 11,15 ± 0,03 %, а у лиц с АГ и ожирением — 15,50 ± 0,01 %. При этом у 47,7 % подростков с АГ и нормальной массой тела не произошло достаточной дилатации сосуда на мощный стимул, которым является нитроглицерин, а в группах с избыточной массой тела и с ожирением это отмечено у большей половины исследуемых (62,0 %). Кроме того, у подростков с АГ и избыточной массой тела через 10 мин после пробы с нитроглицерином продолжался прирост диаметра плечевой артерии (+4,05 %) в отличие от подростков двух других подгрупп, у которых в ответ на снижение его концентрации в сыворотке крови диаметр сосудов возвращался к исходным величинам (табл. 4).
Таким образом, наиболее выраженные нарушения эндотелийзависимой вазодилатации установлены у подростков с АГ и ожирением, в то время как эндотелийнезависимая вазодилатация (стимулированная нитроглицерином) была снижена также у подростков с ожирением, но особенно у лиц с АГ и избыточной массой тела.
Исследования последних лет показали, что в развитии эндотелиальной дисфункции особая роль принадлежит активной локальной секреции эндотелина–1 с нарушением его утилизации [3]. При изучении этого показателя у подростков с АГ было установлено, что средние значения эндотелина–1 были достоверно выше у юношей с АГ и ожирением (р < 0,001), у подростков с нормальной и избыточной массой тела отмечена лишь тенденция к его повышению (р < 0,1) (табл. 5).
Так как жировая ткань является одним из наиболее мощных продуцентов провоспалительных цитокинов, а степень выраженности ожирения, особенно абдоминального, тесно коррелирует с уровнем циркулирующих маркеров воспаления не только у больных МС, но и в общей популяции взрослого населения, представлялось важным проанализировать характер изменений этих показателей у подростков с АГ в зависимости от массы тела.
Установлено, что показатели ИЛ–6 и ФНО–-а у подростков с АГ при наличии избыточной массы тела и ожирения были выше по сравнению с контрольной группой, но не достигали уровня достоверности и не имели значимых различий в исследуемых подгруппах (табл. 5). Средние же значения СРП у подростков постепенно увеличивались от группы с нормальной массой тела к группе с избыточной и ожирением (р < 0,01; р < 0,001) (табл. 5).
Ранее проведенные исследования показали, что наличие МАУ является маркером не столько дисфункции эндотелия клубочкового аппарата почек, сколько генерализованной дисфункции эндотелия. Именно этот показатель является предиктором кардиоваскулярных катастроф у больных с сердечно–сосудистой патологией, в том числе у больных с АГ [19].
При оценке уровня МАУ было установлено достоверное повышение его значений у подростков с АГ всех исследуемых подгрупп, но в группе подростков с АГ и нормальной массой тела эти показатели были достоверно выше показателей других подгрупп (табл. 5).
Исследования показали, что нарушения пуринового обмена — гиперурикемию как у лиц с АГ, так и с АГ и ожирением необходимо рассматривать с позиций формирования дисфункции эндотелия за счет как уменьшения освобождения NO, пролиферации эндотелиальных клеток, стимуляции продукции СРП и ФНО–-а, так и действия других медиаторов воспаления через стимуляцию митогенактивированной протеинкиназы и ядерных факторов транскрипции [20, 21].
При изучении показателей уровня мочевой кислоты в сыворотке крови бессимптомная гипер–урикемия установлена у 56,2 ± 6,2 % подростков с АГ по группе в целом, с некоторым преобладанием у подростков с АГ и ожирением в сравнении с юношами с АГ и нормальной массой тела (58,9 ± 5,3 % против 51,0 ± 5,3 %; р < 0,1).
Таким образом, у подростков с АГ и избыточной массой тела, но особенно у лиц с АГ и ожирением установлено повышение уровня наиболее мощного фактора вазоконстрикции эндотелина–1, а также факторов системного субклинического воспаления (СРП, ФНО–), которые и определяют дестабилизацию функции эндотелия у этой категории подростков, способствуя стабилизации и прогрессированию заболевания.
Наиболее высокий уровень МАУ, который установлен у подростков с АГ и нормальной массой тела, при отсутствии существенного повышения уровня эндотелина–1 и факторов системного воспаления, в некоторой степени можно объяснить более значимой гемодинамической нагрузкой на эндотелий сосудов за счет высокой плотности АГ в течение суток, а также возможным действием других, не учтенных в данном исследовании факторов.
Выводы
1. У подростков с АГ по мере нарастания индекса массы тела происходит дезадаптивное ремоделирование миокарда левого и правого желудочков сердца, левого предсердия, развитие их гипертрофии (эксцентрической, концентрического ремоделирования), а также формирование эндотелиальной дисфункции. Эти явления сопровождаются повышением уровня эндотелина–1, МАУ и факторов субклинического воспаления (СРП, ИЛ–6, ФНО–-а).
2. Подростки с АГ и различным уровнем повышения индекса массы тела требуют особого внимания и более интенсивного контроля как АД, так и изменений со стороны сердечно–сосудистой системы и показателей дестабилизации функции эндотелия (эндотелина–1, МАУ, СРП, ИЛ–6, ФНО–-а).
1. Свищенко Е.П. Эссенциальная гипертензия [Текст] / Е.П. Свищенко, Л.В. Безродная, О.П. Борткевич // Укр. мед. часоп. — 2008. — № 2. — С. 5–35.
2. Горбась І.М. Епідеміологічні та медико–соціальні аспекти артеріальної гіпертензії [Текст ] / І.М. Горбась // Артеріальна гіпертензія у підлітків: проблеми та перспективи: збірник доповідей наукового симпозіуму. — Х., 2011. — С. 11–19.
3. Шишкин А.Н. Эндотелиальная дисфункция и артериальная гипертензия / А.Н. Шишкин, М.Л. Лындина // Артериальная гипертензия. — 2008. — № 4. — С. 315–319.
4. Hubert H.B. Obesity as an independent risk factor for cardiovascular disease: a 26 year follow up of participants of the Framingham Heart Study [Text] / H.B. Hubert, M. Feinleib, McNamara // Circulation. — 1983. — № 67. — Р. 968–977.
5. Коваленко В.М. Регіональні медико–соціальні проблеми хвороб системи кровообігу. Динаміка та аналіз [Текст]: аналітично–статистичний посібник / В.М. Коваленко, В.М. Корнацький. — К., 2013. — 239 с.
6. Коваль С.Н. Современные представления о возможности прогнозирования течения артериальной гипертензии при метаболическом синдроме [Текст] / С.Н. Коваль, В.В. Божко, И.А. Снегурская // Артериальная гипертензия. — 2012. — № 6(26). — С. 34–39.
7. Ferrora L. Metabolic syndrome and left ventricular hypertrophy in a general population. Redults from the Gubbio studi [Text] / L. Ferrora // G. Hum. Hypertens. — 2007. — № 21(10). — P. 795–801.
8. Структура факторов риска поражения органов–мишеней и метаболических изменений у больных артериальной гипертензией в различных возрастных группах [Текст] / С.А. Бойцов [и др.] // Кардиология. — 2009. — № 4. — С. 19–24.
9. Особенности поражения органов–мишеней у больных артериальной гипертензией с наличием и в отсутствие метаболического синдрома [Текст] / Г.Х. Шарипова [и др.] // Тер. архив. — 2009. — № 6. — С. 67–73.
10. Daniel S.R. Lipid screening and cardiovascular health in childhood [Text] / S.R. Daniel, F.R. Greer // Pediatrics. — 2008. — № 122(1). — Р. 198–208.
11. Метаболический синдром у детей и подростков. Консенсус Международной диабетической федерации [Текст] // Международный эндокрин. журн. — 2008. — № 2(14). — С. 100–103.
12. К проблеме патогенеза метаболического синдрома. Жировая ткань и маркеры острой фазы воспаления [Текст] / И.К. Кондаков [и др.] // Артериальная гипертензия. — 2009. — № 3(5). — С. 39–43.
13. Bassuk S.S. Higt–sensivity C–reactive protein. Clinical importance [Text] / S.S. Bassuk, N. Rifai, P.M. Ridker // Curr. Probl. Cardiol. — 2004. — Vol. 29. — P. 439–493.
14. Comparison of interleicin–6 and C–reactive protein for the risk of developing of hypertension in women [Text] / Sesso H.D. [et al.] // Hypertension. — 2007. — Vol. 49. — P. 304–310.
15. Non–invasive detection of endothelial dysfunction in children and adult at risk of atherosclerosis [Text] / Celermajer [et al.] // The Lanset. — 1992. — Vol. 146, № 1085. — P. 245–255.
16. Европейское общество гипертензии и Европейское общество кардиологов. Рекомендации по лечению артериальной гипертензии [Текст]. — Милан, 2007. — 83 с.
17. Радченко Г.Д. Гіпертрофія лівого шлуночка: визначення, методи оцінки, можливості регресування [Текст] / Г.Д. Радченко, Ю.М. Сіренко // Артериальная гипертензия. — 2010. — № 4(12). — С. 82–90.
18. Мочевая кислота и функция эндотелия микроциркуляторного русла у больных на ранних стадиях артериальной гипертонии [Text] / И.В. Атюнина [и др.] // Системные гипертензии. — 2012. — № 2. — С. 29–33.
19. Бильченко А.В. Микроальбуминурия: эволюция понимания клинической роли [Текст] / А.В. Бильченко // Здоров’я України. — 2010. — № 3. — С. 65–67.
20. Khosla U.M. Hyperuricemia induces endotelian disfunction [Text] / U.M. Khosla, S. Zharikov, J.L. Finch // Kidney Int. — 2005. — Vol. 67. — P. 1739–1742.
21. Netea M.G. The role hyperuricemia in the increased cytokine production after lipopolysacharide chellengein neutropenic mice [Text] / M.G. Netea, B.J. Kullberg, W.I. Blik // Blood. — 1997. — Vol. 89. — P. 577–582.

/8/8.jpg)
/9/9.jpg)
/9/9_2.jpg)