Журнал «Здоровье ребенка» 5 (56) 2014
Вернуться к номеру
Деякі маркери регенерації печінки в дітей раннього віку з уродженим і хронічним гепатитом
Авторы: Шадрін О.Г. - ДУ «Інститут педіатрії, акушерства і гінекології НАМН України»; Магомедов О.О. - ДУ «Інститут травматології та ортопедії НАМН України», м. Київ; Чернега Н.Ф., Басараба Н.М., Дюкарева С.В., Ковальчук А.А. - ДУ «Інститут педіатрії, акушерства і гінекології НАМН України»
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У результаті клініко-параклінічних досліджень у дітей раннього віку з гепатитом виявлено підвищення концентрації фактора росту гепатоцитів (HGF) і фактора некрозу пухлини α, що свідчить про високу фіброзну направленість запального процесу в печінці незалежно від тривалості перебігу. Доведений кореляційний зв’язок між рівнями HGF і білковозв’язаним гідроксипроліном обґрунтовує можливість використання показників як маркерів регенераторної активності печінки, зв’язок між якими збільшується з тривалістю патологічного процесу.
В результате клинико-параклинических исследований у детей раннего возраста с гепатитом выявлено повышение концентрации фактора роста гепатоцитов (HGF) и фактора некроза опухоли α, что свидетельствует о высокой фиброзной направленности воспалительного процесса в печени независимо от длительности течения. Доказанная корреляционная связь между уровнями HGF и белковосвязанным гидроксипролином обосновывает возможность использования показателей как маркеров регенераторной активности печени, связь между которыми увеличивается с длительностью патологического процесса.
As a result of clinical and paraclinical studies in young children with hepatitis we detected increased concentration of hepatocyte growth factor (HGF) and tumor necrosis factor α, which indicates a high fibrous focus of inflammation in the liver, regardless of the duration of the course. Correlation between the levels of HGF and protein-bound hydroxyproline justifies the use of indicators as markers of the regenerative activity of the liver, the relationship between them increases with the duration of the pathological process.
гепатит, діти раннього віку, цитокіни, сполучна тканина.
гепатит, дети раннего возраста, цитокины, соединительная ткань.
hepatitis, young children, cytokines, connective tissue.
Статья опубликована на с. 7-12
Проблема дифузних захворювань печінки в дітей залишається актуальною як через різноманіття етіологічної структури, так і високу ймовірність формування хронічного перебігу патології, особливо в дітей раннього віку. Особливості реактивності дитячого організму та його великі компенсаторні можливості призводять до того, що первинно–хронічний перебіг гепатиту проходить без виражених клінічних проявів, а загальні біохімічні показники крові не завжди дозволяють визначити тяжкість перебігу захворювання та швидкість прогресування фіброзних змін, а значить, і прийняття рішення про доцільність і характер терапії. Роботи останніх років свідчать про неухильну тенденцію до хронізації хвороб печінки в дітей, а темпи процесу такі, що їх ускладнення розвиваються не тільки у дорослих, а й у дітей старшого віку [1].
Клінічні й експериментальні дослідження останніх десятиріч направлені на вивчення структури і змін позаклітинного матриксу (ПКМ) в нормальній і фіброзній тканині печінки. Доведено, що в процесі неспецифічної репарації ушкоджень тканинні структури акумулюють ПКМ, що складається з колагену, структурних глікопротеїнів, сульфатних протеогліканів і гіалуронової кислоти. Перерозподіл ПКМ в умовах пошкодження відбувається з переважним накопиченням його в субендотеліальному просторі Діссе, що призводить не тільки до «капіляризації» синусоїдів, й до метаболічних змін, зокрема в структурі колагенів, глікопротеїнів і протеогліканів [2].
Колаген становить 25–35 % білків організму людини і представлений переважно продуктами неповного розпаду сформованих колагенових волокон і щойно синтезованого розчинного колагену. Метаболічні зміни, що відбуваються в структурі колагену, пов’язані перш за все із ступенем гідроксилювання проліну. Гідроксипролін (ГП) стабілізує та захищає молекулу колагену від дії пошкоджуючих ферментів. Підвищення концентрації вільної фракції ГП в сироватці крові вказує на ступінь активного катаболізму колагену, а порушення співвідношення вільного і білковозв’язаного ГП, за даними наукових досліджень, розцінюється як результат активації фіброгенезу в сполучній тканині [3]. У печінці процес обміну колагену проходить більш швидко, ніж в інших тканинах, а зміни активності ферментів, що беруть участь у метаболізмі колагену, зокрема колагенази, вважаються найбільш чутливими і специфічними індикаторами патологічного процесу.
Переважну частину позаклітинних гліко-кон’югатів становлять протеоглікани. Значний прогрес у вивченні ПКМ був досягнутий у зв’язку з молекулярним розділенням нормальних і фіброзних протеогліканів печінки людини. Попередньо протеоглікани були класифіковані виключно на підставі складу вуглеводного ланцюга — глікозаміногліканів (ГАГ), включених до основного білка, що визначало три основних типи залежно від ступеня сульфатування. У сучасних дослідженнях визначена здатність протеогліканів утримувати перисинусоїдальні ліпоцити (зірчасті клітини, клітини Іто) в ушкодженій печінці, що обумовлюється просторовою структурою бокових ланцюгів ГАГ.
Накопичені на сьогодні наукові дані дозволили поряд із змінами в структурі ПКМ показати значну роль порушень імунного статусу в умовах будь-якого пошкодження тканини печінки [4–6]. Доведено, що такі зміни є активним послідовним процесом, що починається з некрозу паренхіми і супроводжується секрецією про- і протизапальних цитокінів, взаємодія між якими визначає процес формування фіброзної тканини в печінці [7]. Під час ушкодження відбувається активація змін фенотипу зірчастих клітин, які починають трансформуватися в міофібробласти. Похідні від зірчастих клітин міофібробласти є ключовими регуляторами не тільки матричного синтезу, а також активації і секреції численних про- і протизапальних цитокінів і факторів росту. Механізм фіброгенної активації, що лежить в основі трансформації зірчастих клітин в міофібробласти, зводиться в каскадну модель, яка ініціюється за допомогою попередньої фази некрозу (апоптозу) гепатоцитів із виходом цитокінів. Наступна прозапальна фаза фіброгенезу характеризується стимуляцією секреції цитокінів міофібробластами та взаємодіючими компонентами ПКМ. Деякі цитокіни можуть стимулюватися не тільки міофібробластами, а й автокринним шляхом і в режимі спокою зірчастих клітин. Отже, постзапальна фаза значною мірою сприяє збереженню фіброгенного процесу, навіть після виключення або скорочення запальної фази.
Порушення рівноваги між фібротичними й антифібротичними факторами веде до збільшення в 3–10 разів компонентів ПКМ [8, 9]. Саме фактори росту, такі як тромбоцитарний фактор росту В і D (PDGF-B і PDGF-D), фактор росту гепатоцитів (HGF), фактор некрозу пухлини a (TNF-ф), ендотелін-1, фактори росту фібробластів (FGFs), інсуліноподібний фактор росту I, адипонектин та інші, щільно пов’язані з ПКМ в умовах запального процесу [10, 11]. Матриця виконує роль губки для їх фіксації в певних ковалентних і нековалентних зв’язках із протеогліканами, колагеном, фібронектином. В останні роки виділені основні білки, які ковалентно пов’язані в бокових ланцюгах конкретними ГАГ, і доведено, що рівень їх експресії регулюється цитокінами, серед яких значну роль відіграють TNF-a і HGF [5, 6].
Фактор некрозу пухлини a є поліпептидним цитокіном, який вважають основним в ініціації багатьох патофізіологічних відповідей організму. Вплив TNF-a на клітини реалізується через рецептори, які розташовані на поверхні більшості клітин людини [12, 13]. Взаємодія TNF-a з рецепторами зумовлює активацію факторів транскрипції, які є регуляторами генів широкого спектра медіаторів, таких як інтерлейкіни та фактори росту, серед яких HGF є ключовим у регулюванні регенеративних процесів печінки.
HGF є найбільш активним цитокіном в фазі G1 клітинного циклу, має властивості потужного мітогену гепатоцитів із біологічними морфогенними й антиапоптотичними реакціями [14]. HGF присутній у печінці у відносно великих кількостях, а після ушкодження печінки його підвищення в плазмі крові реєструється вже через 3 години після ушкодження в 10–20 разів [15]. HGF викликає сильну мітогенну відповідь і клональну експансію гепатоцитів у культурі, а ін’єкції його в воротну вену щурів і мишей викликають проліферацію гепатоцитів із збільшенням печінки [16]. TNF-a, здійснюючи конкуруючу і стимулюючу дію на протилежні ефекти матриці, пов’язаної з HGF, зберігає гепатоцити нормальної печінки в стані спокою, а частина ефектів HGF, яка стимулюється TNF-a, може викликати зміни, що властиві процесам регенерації.
Таким чином, ушкодження печінки будь-якої етіології супроводжується перерозподілом компонентів ПКМ, а рівень таких змін регулюється за участю цитокінів, які виділяються на місцевому рівні і паралельно потрапляють у периферичний кровообіг [15]. На сучасному етапі залишається недостатньо вивченим зв’язок показників цитокінів, зокрема TNF-a і HGF, як координаторів порушень у структурі ПКМ при запальних захворюваннях печінки. Вивчення характеру таких відношень є важливим для медичної науки, може суттєво вплинути на підходи до терапії.
Метою роботи було вивчення показників цитокінів (HGF і TNF-a) і метаболітів сполучної тканини (СТ) (вільна і білковозв’язана фракції ГП, ГАГ, колагеназа) у дітей раннього віку із запальними захворюваннями печінки.
Матеріали і методи
Для вирішення поставленої мети були проведені клініко–лабораторні й інструментальні дослідження 57 дітей раннього віку: 1-ша група — 24 дитини з уродженим гепатитом (УГ); 2-га група — 13 дітей із хронічним гепатитом (ХГ); групу контролю становили 20 практично здорових дітей раннього віку. Верифікація діагнозу ґрунтувалась на строках прояву гепатиту (перші 1–6 місяців життя), клінічних проявах (жовтяниця, гепатоспленомегалія, геморагічний синдром), клініко-біохімічних показниках сироватки крові (загальний білірубін і його фракції, аланінамінотрансфераза (АЛТ), аспартатамінотрансфераза (АСТ), лужна фосфатаза (ЛФ), глутаматтрансфераза (ГГТ), протеїнограма, тимолова проба, протромбін), гемограми. Визначались маркери: HBV (HBsAg, HBeAg, анти-HBclgM, DNA HBV) та HCV (анти-HCVlgM, RNA HCV). Серологічне обстеження матері та новонародженого проводили для виключення TORCH-інфекції (токсоплазмоз, краснуха, герпетична, цитомегаловірусна інфекція (CMV)), а також інших інфекцій (вірус імунодефіциту людини (HIV) та ін.) за показаннями.
Для вивчення показників цитокінів (HGF і TNF-a) застосовували імуноферменті аналізи, що проводили на імуноферментному аналізаторі Stat Fax 303 [16, 17]. Тест для кількісного визначення HGF і TNF-a заснований на методі твердофазного імуноферментного аналізу з використанням специфічних моноклональних антитіл до людського HGF і TNF-a. Для характеристики процесів обміну ПКМ визначали концентрацію продуктів її обміну в сироватці крові (БГ, ВГП, ГАГ, колагеназа), застосовували апарат КФК-3-01 [18–21]. Дані досліджень оброблені методами математичної статистики, використовувалися параметричні методи (критерій Стьюдента). Критичне значення рівня значимості приймалося рівним 5 %. Аналіз даних проводився за допомогою програми Excel XP.
Результати й обговорення
Клінічна картина в дітей як із уродженим, так і хронічним гепатитом характеризувалася значним поліморфізмом. Основним проявом при УГ була гепатомегалія у 95,8 % дітей, у 37,5 % гепатомегалія супроводжувалась збільшенням селезінки. У клінічній картині обстежених дітей домінували інтоксикація (79,1 %) і диспептичні порушення (83,3 %).
Провідне місце серед УГ займав гепатит CMV-етіології (41,6 %). Клінічні прояви CMV–гепатиту включали жовтяницю (87,5 %), різний ступінь гепатоспленомегалії (87,5 %), інтоксикаційний синдром (87,5 %), епізоди ахолічних випорожнень, транзиторну неврологічну симптоматику. Рівні АЛТ та АСТ у переважної кількості дітей були вищими за 2–4 норми (54,1 %). В 1 дитини з CMV-інфікуванням виявлено поєднання CMV-інфекції з токсоплазмозом, у 2 — з герпетичною інфекцією. Клінічна картина у них не мала специфічних проявів, явних ознак інфекційного захворювання при народженні діти не мали, при подальшому обстеженні виявлялись гепатоспленомегалія, жовтяниця, ураження центральної нервової системи.
Перинатальний гепатит В виявлено у 1 дитини. Печінкові проби були вищими за 2–4 норми. Виявлені маркери HBV-HBsAg, позитивна DNA HBV визначались протягом усього періоду спостереження.
У значної частки дітей (37,5 %) з УГ етіологічний чинник хвороби не було виявлено, за ознаками перебігу (гепатоспленомегалія, підвищення активності цитолітичних ферментів) діагностовано так званий криптогенний гепатит. Клінічна картина характеризувалась поліморфізмом, активність трансаміназ корелювала із тяжкістю перебігу.
Серед дітей з ХГ у 3 визначався хронічний гепатит В, у 2 — хронічний гепатит С, у 4 — криптогенний гепатит, в 1 — хронічний автоімунний гепатит, у 3 — CMV-гепатит. За даними фізикального обстеження в дітей із ХГ основним симптомом була гепатомегалія (84,6 %), що стабільно тривала весь період спостереження, а ступінь її не завжди співвідносився зі ступенем тяжкості захворювання. У 30,7 % дітей мав місце гепатолієнальний синдром. Холестатичні явища були виявлені у 2 дітей із криптогенним гепатитом, в 1 дитини — з хронічним гепатитом В. Дитина з хронічним автоімунним гепатитом мала високий ступінь активності запального процесу, спостерігалась носова кровотеча, венозні колатералі на животі.
Характерними біохімічними змінами в крові для обстежених із гепатитами були гіпербілірубінемія, переважно за рахунок кон’югованого білірубіну, стійке підвищення печінково–клітинних ферментів (АЛТ, АСТ, ЛДГ, ГГТ та ін.); підвищення глобулінових фракцій, зниження альбумінів і факторів згортання крові (протромбіну, фібриногену та ін.). Варто відмітити, що біохімічні маркери не були специфічними для гепатиту, спричиненого конкретним вірусом, а лише показниками ураження печінки, а переважна глибини цього ураження та тривалості відновлювального процесу.
Результати вивчення рівнів TNF-a і HGF у дітей з уродженим і хронічним гепатитом продемонстрували вірогідні зміни показників порівняно із здоровими, що відображає роль імунних механізмів у патогенезі розвитку патології. При обстеженні рівні цитокінів у здорових дітей становили: TNF-a — 38,40 ± 3,48 пг/мл, HGF — 421,0 ± 21,6 пг/мл (табл. 1).
Діти з гепатитами мали вірогідно високі показники TNF-a відносно групи контролю, найвищі — 515,4 ± 11,4 пг/мл — діти з ХГ. Цікавим є факт, що в умовах хронічного запалення вищим порівняно з групою УГ реєструвався показник TNF-a. На нашу думку, таку особливість можна пояснити не стільки тривалістю процесу, скільки незрілістю імунної системи у дітей перших місяців життя, що, можливо, є позитивним з огляду на утримання низької активності запального процесу і пояснює малосимптомну клінічну картину в дітей раннього віку.
Високими реєструвались також концентрації показників HGF як одного з основних мітогенних факторів. У дітей з ХГ рівень HGF становив 1242,5 ± 24,6 пг/мл, з УГ — 1044,8 ± 35,6 пг/мл. Загальне підвищення HGF у дітей із гепатитом підтверджує дані літератури щодо підвищення регенераторної активності печінки й активного прогресування фіброзних процесів при даній патології. Відсутність суттєвої різниці між групами вродженого та хронічного гепатиту свідчить, на наш погляд, про високу фіброзну направленість запального процесу в печінці, що не залежить від тривалості перебігу.
З огляду на суперечливий характер отриманих показників було доцільним вивчення не тільки вмісту цитокінів, але і їх співвідношення (TNF-a/HGF). Виявлено, що за однакових показників HGF у дітей групи вродженого та хронічного гепатиту співвідношення показника TNF-a/HGF виявилось втричі вищим у групі дітей з ХГ і становило відповідно 0,41 проти 0,12 (р < 0,05).
Аналіз вивчення концентрації метаболітів СТ засвідчив вірогідні зміни в дітей із гепатитом порівняно із здоровими. Підвищення концентрації колагенази, яке є характерним для будь-яких неспецифічних ушкоджень СТ, на відміну від показників ГП і ГАГ спостерігалося в обох групах дітей із гепатитом (табл. 2).
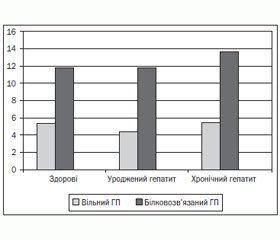
У дітей з УГ активність колагенази зростає щодо показників норми до 132,5 % (р < 0,05), із ХГ — до 110,5 %. Фракції ГП як маркери обміну колагену мали різнонаправлені зміни в групах дітей із гепатитом (рис. 1).
/10/10.jpg)
Найбільш висока концентрація білковозв’язаної фракції ГП (13,65 ± 0,50) як маркера синтетичної фази обміну відмічена в дітей із ХГ, у дітей із УГ (11,75 ± 0,68) показник не відрізнявся від рівня здорових (11,80 ± 0,59). Концентрація вільної фракції ГП як показника утворення «молодого» колагену і маркера катаболічної фази в дітей із ХГ практично не відрізнялась від здорових — 5,47 ± 0,56 і 5,32 ± 0,21 відповідно, а в групі дітей з УГ була вірогідно знижена (4,33 ± 0,28) відносно показників норми (5,32 ± 0,21). Такі дані підтверджують переважний розпад колагену в дітей із ХГ, а білковозв’язаний ГП може бути маркером деструктивних змін у печінці при затяжних запальних процесах.
Збільшення співвідношення білковозв’язаного і вільного ГП розцінюється, за літературними джерелами [4], як результат активації фіброгенезу в СТ. За отриманими даними, показник співвідношення білковозв’язаного/вільного ГП був високим у дітей з УГ, діти з ХГ мали незначне підвищення. Така висока фіброзна активність при УГ за показниками фракцій ГП урівноважена високим рівнем активності колагенази. У групі дітей із ХГ активність колагенази не відрізнялась від активності у здорових, але була вірогідно нижчою відносно рівня при УГ. Можна припустити, що концентрація колагенази є домінуючим фактором фіброзної активності печінкової тканини, а її низька концентрація при підвищенні фракцій ГП вказує на прогресування фіброзних змін. Висока активність колагенази при незмінених фракціях ГП свідчить про відсутність початкових фіброзних змін.
При ушкодженні печінки протеоглікани беруть участь у зберіганні зірчастих клітин, маркерів активності ушкодження. Рівень вуглеводних складових протеогліканів (ГАГ) відображає зміни ПКМ при ушкодженні. Синтез загальних ГАГ на ранніх стадіях ушкодження, за літературними даним, знаходиться в стадії пригнічення, потім активно посилюється [22]. За даними проведених досліджень, у дітей з УГ визначалась висока концентрація ГАГ, у дітей із ХГ вона не змінювалась. Отримані дані узгоджуються з даними літератури, однак можна припустити, що підвищення ГАГ при УГ свідчить про можливу високу руйнівну активність гепатоцитів при УГ, яка з часом знижується, або даний факт засвідчує виснаження ГАГ на тлі хронічного запалення.
Для оцінки взаємозв’язку між рівнями цитокінів і показниками метаболітів СТ був використаний метод кореляційних структур (табл. 3–6) [23].
Як видно з табл. 3–6, єдиними із пов’язаних середнім кореляційним зв’язком (p = 0,50) показниками визначені білковозв’язаний ГП і HGF. За даними літератури, у сироватці практично здорових дітей уміст вільного та білковозв’язаного ГП стабільний, а величини цих показників із віком несуттєво зростають та можуть бути використані як біохімічні маркери синтезу колагену [24]. Білковозв’язаний ГП відображає швидкість колагеноутворення в організмі та є колагеноподібним білок-компонентом системи компліменту, що також відноситься до гострофазних білків і відображає реакцію організму на запалення [2]. Виявлений кореляційний зв’язок демонструє тісний зв’язок між ступенем запалення і секрецією одного з головних мітогенних факторів, що бере участь у регенерації і фіброзоутворенні в печінковій тканині.
Таким чином, у дітей раннього віку з гепатитом виявлено підвищення концентрації HGF і TNF-a, що свідчить про високу фіброзну направленість запального процесу в печінці незалежно від тривалості перебігу. Доведений кореляційний зв’язок між рівнями HGF і білковозв’язаним ГП обґрунтовує можливість використання показників як маркерів регенераторної активності печінки, зв’язок між якими збільшується з тривалістю патологічного процесу.
1. Учайкин В.Ф. Циррозы печени у детей / В.Ф. Учайкин, С.Б. Чуелов, А.Л. Россина [и др.] // Педиатрия. — 2008. — Т. 87, № 5.
2. Бабак О.Я. Цирроз печени и его осложнения / О.Я. Бабак, Е.В. Колесникова. — К.: Здоровье Украины, 2011. — 576 с.
3. Timpl R. Macromolecular organization of base ment membranes // Curr. Opin. Cell Biol. — 1996. — 8. — Р. 618–624.
4. Caviglia G.P. Non-invasive assessment of liver fibrosis: key messages for clinicians / G.P. Caviglia, G.A. Touscoz, А. Smedile, R. Pellicano // Pol. Arch. Med. Wewn. — 2014 Apr 29. — Рii: AOP_14_034. [Epub ahead of print]
5. Kugelmas M. Cytokine and NASH: a pilot study of the effects of lifestyle modification and vitamin E / M. Kugelmas, D. Hill, B. Vivian [et al.] // Hepatology. — 2003. — 38. — Р. 413–419.
6. Berenguer M. Progression of liver fibrosis in post-transplant hepatitis C: mechanisms, assessment and treatment / М. Berenguer, D. Schuppan // J. Hepatol. — 2013. — 58(5). — Р. 1028–41.
7. Socha P. Pharmacological Interventions for Nonalcoholic Fatty Liver Disease in Adults and in Children: A Systematic Review / P. Socha, A. Horvath, P. Vajro [et al.] // Journal of Pediatric Gastroenterology & Nutrition. — 2009. — Vol. 48, Issue 5. — Р. 587–96.
8. Zhao L. The diffuse stallate cell system / L. Zhao, A.D. Burt // J. Mol. Hist. — 2007. — 38. — Р. 53–64.
9. Novo E. Cellular and molecular mechanisms in liver fibrogenesis / Е. Novo, S. Cannito, С Paternostro [et al.] // Arch. Biochem. Biophys. — 2014. — 15. — Р. 20–37.
10. Sahin H. Chemokines in tissue fibrosis / H. Sahin, H.E. Wasmuth // Biochim. Biophys. Acta. — 2013. — 1832(7). — Р. 1041–8.
11. The Liver: Biology and Pathobiology / [Arias I.M., Boyer J.L., Chisari F.V. [et al.]. — Lippincott Williams & Wilkins, Philadelphia. Fourth Edition. — 2001.
12. Кричевская О.А. Фактор некроза опухоли-a и его растворимые рецепторы при ревматических заболеваниях: клиническое и патогенетическое значение / О.А. Кричевская, Н.Г. Клюквина, Е.Н. Александрова [и др.] // Науч.-практ. ревматология. — 2005. — № 2. — С. 43–46.
13. Sikora J.P. Clinical evaluation of proinflammatory cytokine inhibitors (sTNFR I, sTNFR II, IL-1 ra), anti-inflammatory cytokines (IL-10, IL-13) and activation of neutrophils after burn-induced inflammation / J.P. Sikora, D. Chlebna-Sokół, E. Andrzejewska [et al.] // Scand. J. Immunol. — 2008. — Vol. 68, № 2. — С. 145–15.
14. Ishikawa T. Hepatocyte growth factor (HGF)/c-Met signaling is required for stem cell mediated liver regeneration / Т. Ishikawa, V.M. Factor, J.U. Marquardt [et al.] // Hepatology. — 2012. — 55(4). — Р. 1215–26.
15. Herbein G. Tumor necrosis factor (TNF-a) and TNF receptor in viral pathogenesis / G. Herbein, W.A. O’Brien // Proc. Soc. Exp. Boil. Med. — 2000. — Vol. 223. — P. 241–257.
16. Madonna R. Hepatocyte growth factor: Molecular biomarker and player in cardioprotection and cardiovascularregeneration / R. Madonna, C. Cevik, M. Nasser [et al.] // Thromb. Haemost. — 2012. — № 8. — P. 107–116.
17. Karkampouna S. TGF-a signaling in liver regeneration / S. Karkampouna, P. Ten Dijke, S. Dooley, M.K. Julio // Curr. Pharm. Des. — 2012. — 18(27). — Р. 4103–13.
18. Lindy S. Collagenolytic activity in rheumatoid synovial tissue / S. Lindy, J. Halme // Clin. Chim. Acta. — 1973. — V. 47, № 2. — P. 153–157.
19. Frey S. Etude d’une methode d’exploration et du taux normal de I’hydroxproline du serum // Biochem., Biophys. — 1965. — 3. — № 2. — P. 446–450.
20. Stegemann H.J. A simple procedure for the determination of hydroxyproline in urine and bone // Biochem. Med. — 1952. — V. 3, № 1. — P. 23–30.
21. Кляцкин С.А., Лифщиц Р.И. Методика определения гликозаминогликанов орциновым методом в крови больных / С.А. Кляцкин, Р.И. Лифщиц // Лаб. дело. — 1989. — № 10. — С. 51–53.
22. Okazaki I. Reversibility of hepatic fibrosis: from the first report of collagenase in the liver to the possibility of gene therapy for recovery / I. Okazaki, Т. Watanabe, S. Hozawa [et al.] // Keio J. Med. — 2001. — 50(2). — Р. 58–65.
23. Руденко В.М. Математична статистика / В.М. Руденко. — К.: Центр учбової літератури, 2012. — 304 с.
24. Мазуров В.И. Биохимия коллагеновых белков / В.И. Мазуров. — М., 1984. — 220 с.

/10/10_2.jpg)
/11/11.jpg)
/11/11_2.jpg)