Журнал «Здоровье ребенка» 5 (56) 2014
Вернуться к номеру
Участие интерлейкинового семейства 1 в развитии воспалительной реакции при инфекционном процессе. 4. Роль IL-1F11 (IL-33)
Авторы: Абатуров А.Е. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. - Национальный медицинский университет им. А.А. Богомольца, г. Киев;
Юлиш Е.И. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В обзоре представлена характеристика цитокина IL-1F11 (IL-33), его механизма действия и значения в развитии воспалительной реакции.
В огляді наведена характеристика цитокіну IL-1F11 (IL-33), його механізму дії та значення в розвитку запальної реакції.
The review presents the characteristics of cytokine IL-1F11 (IL-33), its mechanisms of action and value in the development of inflammatory response.
воспаление, цитокин IL-1F11 (IL-33), инфекционный процесс.
запалення, цитокін IL-1F11 (IL-33), інфекційний процес.
inflammation, cytokine IL-1F11 (IL-33), infectious process.
Статья опубликована на с. 158-161
Введение
Цитокин IL-1F11 (IL-33) — один из последних (2005 г.) идентифицированных представителей IL-1 цитокинового семейства [10]. Первоначально он был открыт как продукт гена DVS27, который активируется в эндотелиоцитах сосудов головного мозга после субарахноидального кровоизлияния, и как ядерный фактор венул с высоким эндотелием (nuclear factor from high endothelial venules — NF-HEV). Молекула IL-1F11 (IL-33) состоит из 270 аминокислотных остатков, которые формируют два домена: N-терминальный гомеодомен, который содержит хроматинсвязывающий helix-turn-helix (HTH) мотив, и C-терминальный цитокиновый IL-1-подобный домен [5, 11].
Синтез, процессинг и высвобождение IL-1F11 (IL-33)
Первично IL-1F11 (IL-33) экспрессируется как протеин с молекулярной массой 30 kDa в различных клетках и тканях [5].
Продуценты IL-1F11 (IL-33)
Экспрессия IL-1F11 (IL-33) отмечена в эпителио–цитах, эндотелиоцитах, макрофагах, DC, тучных клетках, адипоцитах, но наиболее активная экспрессия характерна для клеток ткани легкого и кожных покровов (эпителиоцитов слизистой оболочки бронхов, фибробластов кожи, гладкомышечных клеток), эндотелиоцитов [3, 10]. Остается невыясненным вопрос, какие типы клеток являются основным источником 18 kD формы IL-1F11 (IL-33) в процессе развития воспаления. По мнению Chia-Lin Hsu и соавт. [3], на роль определяющих продуцентов IL-1F11 (IL-33) могут претендовать тучные клетки дермальной локализации при состояниях, в основе которых лежит IgE-опосредованная реакция.
Процессинг IL-1F11 (IL-33)
Большая часть вновь синтезируемых молекул IL-1F11 (IL-33) транслоцируется в ядро клетки, где они проявляют свою активность в полномерном виде. Считают, что в цитоплазме клетки активация протеина IL-1F11 (IL-33) выполняется каспазой-1 или кальпаином. Каспаза-1 расщепляет молекулу IL-1F11 (IL-33) на уровне Asp178 или Ser111 C-терминального домена, что приводит к появлению активной секретируемой во внеклеточное пространство 18 kD формы цитокина [2, 10]. Однако, по мнению Grace E.J. Murphy и соавт. [19], полномерная форма IL-1F11 (IL-33) в естественных условиях не является непосредственным субстратом каспазы-1 и не требует протеолиза для активации. Более того, расщепление каспазой-1 приводит к инактивации молекулы IL-1F11 (IL-33) [27, 29].
Высвобождение IL-1F11 (IL-33)
Цитокин IL-1F11 (IL-33) высвобождается из клеток преимущественно в момент их некротической гибели, проявляя свойства DAMP [21]. Во время апоптотической гибели его молекула расщепляется на неактивные формы внутри клеток [26]. Полномерная форма IL-1F11 (IL-33), высвобожденная из клеток во время воспаления, может быть протеолитическому расщеплению эластазой нейтрофилов и катепсином G с образованием более активных форм [9]. Расщепленные формы IL-1F11 (IL-33) с более высокой биологической активностью являются подлинными цитокинами, которые связываются с цепью IL-1R4 рецептора IL-1F11 (IL-33), в то время как полномерные молекулы IL-1F11 (IL-33) функционируют IL-1R4-независимым способом. Следует отметить, что протеаза-4 тучных клеток обусловливает деградацию IL-1F11 (IL-33) в экстрацелюллярном матриксе и таким образом способствует подавлению активности воспалительного процесса [14].
Рецепторы IL-1F11 (IL-33)
Рецептор IL-1F11 (IL-33) (IL-33R) является гетеродимером и состоит из двух цепей — IL-1R4 (T1/ST2, Fit-1 или DER4) и IL-1R аксессуарного протеина (IL-1RAcP) IL-1R3, который входит в состав рецепторов IL-1F1 (IL-1а), IL-1F1 (IL-1b), IL-1F6, IL-1F8 и IL-1F9 [20]. Цитокин 1F11/IL33 является лигандом цепи IL-1R4, которая первоначально была описана как рецептор Th2-лимфоцитов и тучных клеток. Цепь IL-1R4 экпрессирована на поверхности мембран Th2-лимфоцитов, базофилов, тучных клеток, NK [4, 6].
Внутриклеточное действие IL-1F11 (IL-33)
Внутриядерно расположенный IL-1F11 (IL-33) функционирует как транскрипционный репрессор [18], который связывается с кислым карманом димерного гистона H2A-H2B на поверхности нуклеосом, оказывая ингибирующее действие на транскрипцию генов.
Внеклеточное действие IL-1F11 (IL-33)
Экстрацеллюлярно расположенные молекулы IL-1F11 (IL-33) оказывают свое действие, активируя специфический рецептор IL-33R [22, 25]. IL-1F11 (IL-33) индуцирует развитие воспалительного ответа по Th2-типу. Введение очищенного IL-1F11 (IL-33) приводит к усиленной продукции IL-4, IL-5 и IL-13 Th2-клетками и ингибированию продукции IFN-y Th1-клетками. Также данный цитокин действует на Th2-клетки как хемоаттрактант [1, 8]. Действие IL-1F11 (IL-33) на другие клетки представлено в табл. 1 [5, 7, 17, 24].
IL-1F11 (IL-33) оказывает определенное влияние на процессы воспаления, репарации. Так, под влиянием IL-1F11 (IL-33) происходит возбуждение ILC2 (естественных лимфоидных клеток типа 2), что приводит к возникновению эозинофилии, индукции фиброза, ремоделированию дыхательных путей, развитию иммунной толерантности, протекции гепатоцитов от эффектов ишемии/реперфузии. IL-1F11 (IL-33) индуцирует секрецию базофилами IL-4, который способствует экспрессии ингибиторного FcyRIIB на эффекторных макрофагах. Под влиянием IL-1F11 (IL-33) усиливается продукция тучными клетками IL-5 и IL-1b и IL-6, которые участвуют в регуляции синтеза аутоантител и дифференцировки Th17-клеток [14].
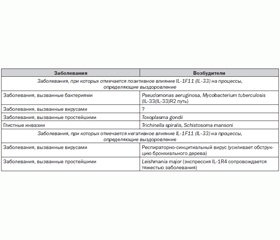
Значение IL-1F11 (IL-33) при инфекционных заболеваниях
Keisuke Oboki и соавт. [5], проанализировав участие IL-1F11 (IL-33) в развитии некоторых инфекционных заболеваний (табл. 2), не исключают, что данный цитокин играет далеко не второстепенную роль при множестве других болезней, вызванных бактериальными, вирусными, паразитарными и глистными агентами.
Систематическое введение мышам экзогенного IL-1F11 (IL-33) сопровождается развитием эозинофилии, спленомегалии, гипертрофии слизистых оболочек пищеварительного, респираторного трактов и снижением активности атеросклеротического процесса [8]. IL-1F11 (IL-33) играет ключевую роль в развитии хронических Th2-ассоциированных воспалительных заболеваний, в том числе аллергических конъюнктивита, ринита, атопического дерматита [5, 27], бронхиальной астмы [15, 16, 23, 27]. IL-1F11 (IL-33) участвует в патогенезе Th1-ассоциированных процессов (аутоиммунных артритов) [12, 19] и способствует развитию фиброза печени [13]. Также идентифицированы достоверные флуктуации уровней концентрации IL-1F11 (IL-33) в сыворотке крови и активности экспрессии IL-1R4 на целевых клетках при сахарном диабете I типа, системной красной волчанке, рассеянном склерозе, остром инфаркте миокарда, гипертрофической кардиомиопатии, болезни Альцгеймера [5].
Заключение
Цитокин IL-1F11 (IL-33) является представителем интерлейкинового семейства 1, который в основном экспрессируется в эпителиальных клетках и локализуется в ядре клетки. Высвобождение IL-1F11 (IL-33) из клеток происходит при их некротической гибели. Цитокин IL-1F11 (IL-33), взаимодействуя с рецепторами IL-33R, который представляет собой гетеродимер, состоящий из IL-1RL1 (ST2) и IL-1RAcP, преимущественно активирует Th2-лимфоциты, тучные клетки, базофилы, эозинофилы. Цитокин IL-1F11 (IL-33) играет протективную роль при многих инфекционных заболеваниях. Чрезмерная продукция IL-1F11 (IL-33) обусловливает развитие аллергических заболеваний.
1. Barksby H.E., Lea S.R., Preshaw P.M., Taylor J.J. The expanding family of interleukin-1 cytokines and their role in destructive inflammatory disorders // Clin. Exp. Immunol. — 2007. — Vol. 149, № 2. — P. 217-225. — doi: 10.1111/j.1365-2249.2007.03441.x.
2. Cayrol C., Girard J.P. The IL-1-like cytokine IL-33 is inactivated after maturation by caspase-1 // Proc. Natl. Acad. Sci USA. — 2009. — Vol. 106, № 22. — P. 9021-9026. — doi: 10.1073/pnas.0812690106.
3. Hsu C.L., Neilsen C.V., Bryce P.J. IL-33 Is Produced by Mast Cells and Regulates IgE-Dependent Inflammation // PLoS One. — 2010. — Vol. 5, № 8. — P. e11944. — doi: 10.1371/journal.pone.0011944.
4. IL-33 amplifies both T(h)1-and T(h)2-type responses through its activity on human basophils, allergen-reactive T(h)2 cells, iNKT and NK Cells / M.D. Smithgall, M.R. Comeau, B.R.P. Yoon, D. Kaufman, R. Armitage, D. E. Smith // Int. Immunol. — 2008. — Vol. 20, № 8. — P. 1019-1030. — doi: 10.1093/intimm/dxn060.
5. IL-33 and IL-33 Receptors in Host Defense and Diseases / K. Oboki, T. Ohno, N. Kajiwara, H. Saito, S. Nakae // Allergol. Int. — 2010. — Vol. 59, № 2. — P. 1-18. — doi: 10.2332/allergolint.10-RAI-0186.
6. IL-33 exacerbates antigen-induced arthritis by activating mast cells / D. Xu, H.R. Jiang, P. Kewin, Y. Li, R. Mu, A.R. Fraser, N. Pitman, M. Kurowska-Stolarska, A.N.J. McKenzie, I.B. McInnes, F.Y. Liew // Proc. Natl. Acad. Sci. USA. — 2008. — Vol. 105, № 31. — P. 10913-10918. — doi: 10.1073/pnas.0801898105.
7. IL-33 Exacerbates Eosinophil-Mediated Airway Inflammation / B. Stolarski, M. Kurowska-Stolarska, P. Kewin, D. Xu, F.Y. Liew // J. Immunol. — 2010. — Vol. 185, № 6. — P. 3472-3480. — doi: 10.4049/jimmunol.1000730.
8. IL-33 is a chemoattractant for human Th2 cells / M. Komai-Koma, D. Xu, Y. Li, A.N. McKenzie, I.B. McInnes, F.Y. Liew // Eur. J. Immunol. — 2007. — Vol. 37, № 10. — P. 2779-2786. — doi: 10.1002/eji.200737547.
9. IL-33 is processed into mature bioactive forms by neutrophil elastase and cathepsin G / E. Lefrançais, S. Roga, V. Gautier, A. Gonzalez-de-Peredo, B. Monsarrat, J.P. Girard, C. Cayrol // Proc. Natl. Acad. Sci USA. — 2012. — Vol. 109, № 5. — P. 1673-1678. — doi: 10.1073/pnas.1115884109. doi: 10.1073/pnas.1115884109.
10. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines / J. Schmitz, A. Owyang, E. Oldham, Y. Song, E. Murphy, T.K. McClanahan, G. Zurawski, M. Moshrefi, J. Qin, X. Li, D.M. Gorman, J.F. Bazan, R.A. Kastelein // Immunity. — 2005. — Vol. 23, № 5. — P. 479-490. — doi:10.1016/j.immuni.2005.09.015.
11. IL-33, the IL-1-like cytokine ligand for ST2 receptor, is a chromatin-associated nuclear factor in vivo / V. Carriere, L. Roussel, N. Ortega, D.A. Lacorre, L. Americh et al. // Proc. Natl. Acad. Sci. USA. — 2007. — Vol. 104, № 1. — P. 282-287. — doi: 10.1073/pnas.0606854104.
12. Increased levels of interleukin 33 in sera and synovial fluid from patients with active rheumatoid arthritis / Y. Matsuyama, H. Okazaki, H. Tamemoto, H. Kimura, Y. Kamata, K. Nagatani, T. Nagashima, M. Hayakawa, M. Iwamoto, T. Yoshio, S. Tominaga, S. Minota // J. Rheumatol. — 2010. — Vol. 37, № 1. — P. 18-25. — doi: 10.3899/jrheum.090492.
13. Interleukin-33 overexpression is associated with liver fibrosis in mice and humans / P. Marvie, M. Lisbonne, A. L’helgoualc’h, M. Rauch, B. Turlin, L. Preisser, K. Bourd-Boittin, N. Théret, H. Gascan, C. Piquet-Pellorce, M. Samson // J. Cell. Mol. — 2010. — Vol. 14, № 6B. — P. 1726-1739. — doi: 10.1111/j.1582-4934.2009.00801.x.
14. Interleukin-33: a mediator of inflammation targeting hematopoietic stem and progenitor cells and their progenies / H. Le, W. Kim, J. Kim, H.R. Cho, B. Kwon // Front. Immunol. — 2013. — Vol. 4. — P. 104. — doi: 10.3389/fimmu.2013.00104.
15. Investigations into the role of ST2 in acute asthma in children / M. Ali, G. Zhang, W.R. Thomas, C.J. McLean, J.A. Bizzintino, I.A. Laing, A.C. Martin, J. Goldblatt, P.N. Le Souëf, C.M. Hayden // Tissue Antigens. — 2009. — Vol. 73, № 3. — P. 206-212. — doi: 10.1111/j.1399-0039.2008.01185.x.
16. Kakkar R., Lee R.T. The IL-33/ST2 pathway: therapeutic target and novel biomarker // Nat. Rev. Drug Discov. — 2008. — Vol. 7, № 10. — P. 827-840. — doi: 10.1038/nrd2660.
17. Lloyd C.M. IL-33 family members and asthma — bridging innate and adaptive immune responses // Curr. Opin. Immunol. — 2010. — Vol. 22, № 6. — P. 800-806. — doi: 10.1016/j.coi.2010.10.006.
18. Moussion C., Ortega N., Girard J.P. The IL-1-like cytokine IL-33 is constitutively expressed in the nucleus of endothelial cells and epithelial cells in vivo: a novel ‘alarmin’? // PLoS One. — 2008. — Vol. 3, № 10. — P. e3331. — doi: 10.1371/journal.pone.0003331.
19. Murphy G.E.J., Xu D., Liew F.Y., McInnes I.B. Role of interleukin 33 in human immunopathology // Ann. Rheum. Dis. — 2010. — Vol. 69, Suppl. 1. — P. i43-47. — doi: 10.1136/ard.2009.120113.
20. O’Neill L.A. The interleukin-1 receptor_Toll-like receptor superfamily: 10 years of progress // Immunol. Rev. — 2008. — Vol. 226. — P. 10-18. — doi: 10.1111/j.1600-065X.2008.00701.x.
21. Oboki K., Nakae S., Matsumoto K., Saito H. IL-33 and Airway Inflammation // Allergy Asthma Immunol. Res. — 2011. — Vol. 3, № 2. — P. 81-88. — doi: 10.4168/aair.2011.3.2.81.
22. Regulation of expression of the novel IL-1 receptor family members in the mouse brain / R. Andre, D. Lerouet, I. Kimber, E. Pinteaux, N. J. Rothwell // J. Neurochem. — 2005. — Vol. 95, № 2. — P. 324-330. — doi: 10.1111/j.1471-4159.2005.03364.x.
23. Role of IL-33 in bronchial asthma / N. Mato, M. Bando, H. Yamasawa, T. Hosono, Y. Mizushina, M. Sata, G. Ohki, Y. Sugiyama // Nihon Kokyuki Gakkai Zasshi. — 2010. — Vol. 48, № 6. — P. 419-425.
24. Role of interleukin-33 in innate-type immune cells in allergy / S. Nakae, H. Morita, T. Ohno, K. Arae, K. Matsumoto, H. Saito // Allergol. Int. — 2013. — Vol. 62, № 1. — P. 13-20. — doi: 10.2332/allergolint.13-RAI-0538.
25. Roussel L., Erard M., Cayrol C., Girard J.P. Molecular mimicry between IL-33 and KSHV for attachment to chromatin through the H2A-H2B acidic pocket // EMBO Rep. — 2008. — Vol. 9, № 10. — P. 1006-1012. — doi: 10.1038/embor.2008.145.
26. Suppression of interleukin-33 bioactivity through proteolysis by apoptotic caspases / A.U. Lüthi, S.P. Cullen, E.A. McNeela, P.J. Duriez, I.S. Afonina, C. Sheridan, G. Brumatti, R.C. Taylor, K. Kersse, P. Vandenabeele, E.C. Lavelle, S.J. Martin // Immunity. — 2009. — Vol. 31, № 1. — P. 84-98. — doi: 10.1016/j.immuni.2009.05.007.
27. The dual function cytokine IL-33 interacts with the transcription factor NF-kB to dampen NF-kB-stimulated gene transcription / S. Ali, A. Mohs, M. Thomas, J. Klare, R. Ross, M.L. Schmitz, M.U. Martin // J. Immunol. — 2011. — Vol. 187, № 4. — P. 1609-1616. — doi: 10.4049/jimmunol.1003080.
28. The role of interleukin-33 in chronic allergic conjunctivitis / A. Matsuda, Y. Okayama, N. Terai, N. Yokoi, N. Ebihara, H. Tanioka, S. Kawasaki, T. Inatomi, N. Katoh, E. Ueda, J. Hamuro, A. Murakami, S. Kinoshita // Invest. Ophthalmol. Vis. Sci. — 2009. — Vol. 50, № 10. — P. 4646-4652. — doi: 10.1167/iovs.08-3365.
29. Zhao W., Hu Z. The enigmatic processing and secretion of interleukin-33 // Cell. Mol. Immunol. — 2010. — Vol. 7, № 4. — P. 260-262. — doi: 10.1038/cmi.2010.3.

/159/159.jpg)
/160/160.jpg)