Журнал «Здоровье ребенка» 6 (57) 2014
Вернуться к номеру
Лекарственные средства, модулирующие активность TLR
Авторы: Абатуров А.Е. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. - Национальный медицинский университет им. А.А. Богомольца, г. Киев; Юлиш Е.И. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В обзоре представлена характеристика разрабатываемых лекарственных средств, которые модулируют активность Толл-подобных рецепторов и могут быть применены при лечении инфекционных, хронических воспалительных, аутоиммунных, аллергических заболеваний, злокачественных новообразований.
В огляді подано характеристику розроблюваних лікарських засобів, які модулюють активність Тол-подібних рецепторів і можуть бути застосовані при лікуванні інфекційних, хронічних запальних, автоімунних, алергічних захворювань, злоякісних новоутворень.
The review presents characteristics of drugs being developed that modulate Toll-like receptors activity and can be applied in the treatment of infectious, chronic inflammatory, autoimmune, allergic diseases, malignancies.
терапия, инфекционный процесс, Толл-подобные рецепторы.
терапія, інфекційний процес, Тол-подібні рецептори.
therapy, infectious process, Toll-like receptors.
Статья опубликована на с. 131-136
В настоящее время активно разрабатываются лекарственные средства, модулирующие активность Толл-подобных рецепторов (Toll-like receptors — TLR), для лечения и профилактики инфекционных заболеваний, хронических воспалительных, аллергических, аутоиммунных болезней и неопластических процессов [10].
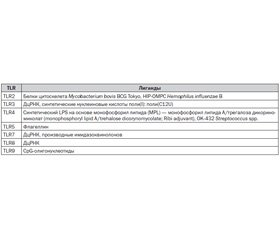
Учитывая, что лиганды TLR радикально влияют на активность специфического иммунного ответа, их используют как адъюванты вакцин против различных инфекционных заболеваний. Одновременная поставка адъюванта и антигена активирует процессинг антигена и презентацию продуктов I и II классов HLA системы на атигенпрезентирующих клетках и макрофагах, что позволяет снизить дозу доставляемого специфического антигена и уменьшить его нежелательные эффекты. Поскольку вакцинация является безальтернативным методом профилактики распространенных инфекционных заболеваний и носит повсеместный и широкомасштабный характер, вакцины могут содержать только адъюванты с высоким профилем безопасности. Единственным адъювантом, одобренным для использования при изготовлении вакцин, до настоящего времени являлся алюминий гидрохлорид. Открытие TLR системы позволило подойти к решению вопроса об эффективности вакцинации с эволюционной точки зрения. В качестве адъювантов вакцин против гриппа, гепатита В, С, малярии, ВИЧ-инфекции, папилломавирусной инфекции, лепры были предложены синтетические и естественные агонисты TLR, которые в многочисленных научных исследованиях показали превосходные профили безопасности и эффективности (табл. 1) [10, 14, 24].
На основе гигиенической теории было сделано предположение, что микробная инвазия может предотвращать развитие аллергического процесса, в связи с чем многими научно-исследовательскими группами активно изучается возможность использования лигандов TLR при хронических аллергических заболеваниях [11, 16]. Лекарственные препараты, содержащие лиганды к TLR4, TLR8, TLR9 и предназначенные для лечения аллергического ринита и бронхиальной астмы, находятся на различных фазах клинического исследования и характеризуются достаточно высоким уровнем эффективности, который позволяет применять ультракороткие схемы лечения [12]. В частности, только четырехкратное введение Pollinex Quattro, содержащего несколько аллергенов и MPL, достоверно уменьшило активность клинических проявлений аллергического ринита во время обострения заболевания [8, 17], а шесть инъекций Tolamba в последующие два года предупреждают развитие аллергической реакции на аллергены амброзии [11, 23].
Исследования TLR показали, что неадекватное повышение их активности может быть причиной развития системного воспалительного ответа и лежать в основе хронических воспалительных и аутоиммунных заболеваний, поэтому возможность и эффективность применения при данных заболеваниях антагонистов TLR активно изучаются на протяжении последних лет (табл. 2) [15, 19, 22]. В экспериментальных и клинических исследованиях показано, что применение Eritoran E5564 и TAK-242, содержащих антагонисты TLR4, как эффективно в предотвращении развития эндотоксического шока, вызываемого ЛПС, на моделях животных, так и эффективно и безопасно при лечении септических процессов [1, 2, 5, 7, 18, 23].
Учитывая, что иммунная толерантность лежит в основе развития неопластических процессов, агонисты TLR в настоящее время рассматривают как лекарственные средства, которые возможно использовать при лечении онкологических больных, как правило, в комбинации с традиционной химиотерапией (табл. 2) [3, 20, 21].
Также разрабатываются лекарственные средства, влияющие на активность внутриклеточных сигнальных путей TLR [14].
Таким образом, в настоящее время создан внушительный пул лекарственных средств, непосредственно влияющих на активность TLR, исследование которых показало достаточную их клиническую эффективность при заболеваниях различного генеза. Согласно мнению Abbi L. Engel и соавт. [6], недостаточная терапевтическая эффективность лекарственных средств, влияющих на активность TLR, обусловлена коротким периодом полураспада и низкой биодоступностью их молекул. Авторы считают, что индукция регуляторных путей, ассоциированных с продукцией IL-10 и пролиферацией Treg-клеток, может уменьшить побочное провоспалительное действие агонистов TLR. Предполагается, что использование нанотехнологий для доставки лекарственных средств и различных способов самонаведения молекул агонистов TLR может значительно увеличить терапевтическую эффективность лекарственных средств, влияющих на активность TLR.
1. Analysis of binding site for the novel small-molecule TLR4 signal transduction inhibitor TAK-242 and its therapeutic effect on mouse sepsis model / K. Takashima, N. Matsunaga, M. Yoshimatsu, K. Hazeki, T. Kaisho, M. Uekata, O. Hazeki, S. Akira, Y. Iizawa, M. Ii // Br. J. Pharmacol. — 2009. — Vol. 157, № 7. — P. 1250–1262. — doi: 10.1111/j.1476-5381.2009.00297.x.
2. Barochia A.V., Cui X., Natanson C., Eichacker P.Q. Risk of death and the efficacy of eritoran tetrasodium (E5564): design considerations for clinical trials of anti-inflammatory agents in sepsis // Crit. Care Med. — 2010. — Vol. 38, № 1. — P. 306–308. — doi: 10.1097/CCM.0b013e3181b77fe3.
3. Cancer and inflammation: promise for biologic therapy / S. Demaria, E. Pikarsky, M. Karin, L.M. Coussens, Y.C. Chen, E.M. El-Omar, G. Trinchieri, S.M. Dubinett, J.T., Mao E. Szabo, A. Krieg, G.J. Weiner, B.A. Fox, G. Coukos, E. Wang, R.T. Abraham, M. Carbone, M.T. Lotze // J. Immunother. — 2010. — Vol. 33, № 4. — P. 335–351. — doi: 10.1097/CJI.0b013e3181d32e74.
4. Crespo-Lessmann A., Juárez-Rubio C., Plaza-Moral V. Papel de los receptores toll-like en las enfermedades respiratorias // Archivos de Bronconeumología. — 2010. — Vol. 46, № 3. — P. 135–142. — doi: 10.1016/j.arbres.2009.07.011.
5. Effect of Toll-like receptor 4 inhibitor on LPS-induced lung injury / H. Seki, S. Tasaka, K. Fukunaga, Y. Shiraishi, K. Moriyama, K. Miyamoto, Y. Nakano, N. Matsunaga, K. Takashima, T. Matsumoto, M. Ii, A. Ishizaka, J. Takeda // Inflamm Res. — 2010. — Vol. 59, № 10. — P. 837–845. — doi: 10.1007/s00011-010-0195-3.
6. Engel A.L., Holt G.E., Lu H. The pharmacokinetics of Toll-like receptor agonists and the impact on the immune system // Expert. Rev. Clin. Pharmacol. — 2011. — Vol. 4, № 2. — P. 275–289. — doi: 10.1586/ecp.11.5.
7. Eritoran tetrasodium (E5564) treatment for sepsis: review of preclinical and clinical studies / A. Barochia, S. Solomon, X. Cui, C. Natanson, P.Q. Eichacker // Expert Opin. Drug Metab. Toxicol. — 2011. — Vol. 7, № 4. — P. 479–494. — doi: 10.1517/17425255.2011.558190.
8. Gawchik S.M., Saccar C.L. Pollinex Quattro Tree: allergy vaccine // Expert. Opin. Biol. Ther. — 2009. — Vol. 9, № 3. — P. 377-382. — doi: 10.1517/14712590802699596.
9. Gosu V., Basith S., Kwon O.P., Choi S. Therapeutic applications of nucleic acids and their analogues in Toll-like receptor signaling // Molecules. — 2012. — Vol. 17, № 11. — P. 13503–13529. — doi: 10.3390/molecules171113503.
10. Hennessy E.J., Parker A.E., O'Neill L.A.J. Targeting Toll-like receptors: emerging therapeutics? // Nat. Rev. Drug Disc. — 2010. — Vol. 9, № 4. — P. 293–307. — doi: 10.1038/nrd3203.
11. Horner A.A. Update on toll-like receptor ligands and allergy: implications for immunotherapy // Curr. Allergy Asthma Rep. — 2006. — Vol. 6, № 5. — P. 395–401.
12. Kanzler H., Barrat F.J., Hessel E.M., Coffman R.L. Therapeutic targeting of innate immunity with Toll-like receptor agonists and antagonists // Nature medicine. — 2007. — Vol. 3, № 5. — P. 552–559. — doi:10.1038/nm1589.
13. Krieg A.M. Therapeutic potential of Toll-like receptor 9 activation // Nat. Rev. Drug Discov. — 2006. — Vol. 5. — P. 471–484.
14. Krishnan J., Lee G., Choi S. Drugs Targeting Toll-like Receptors // Arch. Pharm. Res. — 2009. — Vol 32, № 11. — P. 1485–1502. — doi: 10.1007/s12272-009-2100-6.
15. Loiarro M., Ruggiero V., Sette C. Targeting TLR/IL-1R signalling in human diseases // Mediators Inflamm. — 2010. — Article ID 674363. — 12 p. — doi: 10.1155/2010/674363.
16. Makkouk A., Abdelnoor A.M. The potential use of Toll-like receptor (TLR) agonists and antagonists as prophylactic and/or therapeutic agents // Immunopharmacol. Immunotoxicol. — 2009. — Vol. 31, № 3. — P. 331–338. — doi: 10.1080/08923970902802926.
17. Patel P., Salapatek A.M. Pollinex Quattro: a novel and well-tolerated, ultra short-course allergy vaccine // Expert. Rev. Vaccines. — 2006. — Vol. 5, № 5. — P. 617–629. — doi:10.1586/14760584.5.5.617.
18. Phase 2 trial of eritoran tetrasodium (E5564), a toll-like receptor 4 antagonist, in patients with severe sepsis / M. Tidswell, W. Tillis, S.P. Larosa, M. Lynn, A.E. Wittek, R. Kao, J. Wheeler, J. Gogate, S.M. Opal // Crit. Care Med. — 2010. — Vol. 38, № 1. — P. 72–83. — doi: 10.1097/CCM.0b013e3181b07b78.
19. Toll-like Receptor 2 Signaling in CD4(+) T Lymphocytes Promotes T Helper 17 Responses and Regulates the Pathogenesis of Autoimmune Disease / J.M. Reynolds, B.P. Pappu, J. Peng, G.J. Martinez, Y. Zhang, Y. Chung, L. Ma, X.O. Yang, R.I. Nurieva, Q. Tian, C. Dong // Immunity. — 2010. — Vol. 32, № 5. — P. 692–702. — doi: 10.1016/j.immuni.2010.04.010.
20. Toll-like receptor-3 as a target to enhance bioactivity of cancer immunotherapy / C.F. Nicodemus, L. Wang, J. Lucas, B. Varghese, J.S. Berek // Am. J. Obstet. Gynecol. — 2010. — Vol. 202, № 6. — P. 608.e1–608.e8. — doi: 10.1016/j.ajog.2009.12.001.
21. Tomillero A., Moral M.A. Gateways to clinical trials // Methods Find. Exp. Clin. Pharmacol. — 2009. — Vol. 31, № 2. — P. 107–146.
22. Treatment of lupus-prone mice with a dual inhibitor of TLR7 and TLR9 leads to reduction of autoantibody production and amelioration of disease symptoms / F.J. Barrat, T. Meeker, J.H. Chan, C. Guiducci, R.L. Coffman // Eur. J. Immunol. — 2007. — Vol. 37, № 12. — P. 3582–3586. — doi: 10.1002/eji.200737815.
23. Tse K., Horner A.A. Update on toll-like receptor-directed therapies for human disease // Ann. Rheum. Dis. — 2007. — Vol. 66, Suppl 3. — P. iii77-80. — doi:10.1136/ard.2007.078998.
24. Yokota S., Okabayashi T., Fujii N. The battle between virus and host: modulation of Toll-like receptor signaling pathways by virus infection // Mediators Inflamm. — 2010. — Vol. 2010. — № 184328. — doi: 10.1155/2010/184328.

/132/132.jpg)
/132/132_2.jpg)
/133/133.jpg)
/134/134.jpg)
/135/135.jpg)