Журнал «Травма» Том 15, №5, 2014
Вернуться к номеру
Клініко-патогенетична характеристика болю у нижньому відділі спини та застосування хондропротекторних ефектів Піаскледину в його комплексній терапії
Авторы: Головченко Ю.І., Тріщинська М.А., Бельська І.В. - Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 43-47
За даними ВООЗ, у розвинених країнах світу поширення болю за масштабами цілком порівнянне з пандемією. За даними епідеміологічних досліджень, 58–84 % населення хоча б раз в житті відчували болі в спині, у популяції віком 20–64 років від таких болів страждають 24 % чоловіків та 32 % жінок [26]. Поширеність хронічних больових синдромів надзвичайно велика: не менше 15–20 % населення страждає від хронічних больових синдромів [44]. У широкому сенсі біль є попереджувальним сигналом і оберігає нас від пошкоджуючих впливів, а також попереджає про порушення, що виникли в середині самого організму, і відкриває шлях до розпізнавання й лікування багатьох захворювань [4, 15]. Актуальність проблеми настільки очевидна, що не потребує спеціальних аргументів, оскільки відомо, що біль належить до скарг, із якими найчастіше пацієнти звертаються по допомогу до лікарів різних спеціальностей. Але, незважаючи на загальну увагу, тривале вивчення, проблема болю ще далека від вирішення. Під синдромом болю в нижній частині спини (low back pain — LBP) розуміють біль, що локалізується між XII парою ребер і сідничними складками [18, 23, 31]. В Україні вертеброгенна патологія та захворювання периферичної нервової системи посідають друге місце після цереброваскулярної патології (показники захворюваності становлять 520 випадків на 100 тис. населення). У світі ця патологія лідирує серед захворювань, що зумовлюють тимчасову непрацездатність, а в Європі є другою за частотою звернень до невропатолога. У вікових межах 30–45 років біль у нижній частині спини є найчастішою причиною втрати працездатності. Водночас лише 40 % хворих звертаються по медичну допомогу.
Багато дослідників і фахівців, які надають допомогу пацієнтам із болем у спині, дотримуються поглядів, що розвиток хронічного болю в спині — це результат комбінації дегенеративних змін хребта й ушкодження різних структур (зазвичай м’язів і зв’язкового апарату) внаслідок мікротравматизації, іноді на фоні наявних нейроортопедичних порушень, неадекватного навантаження на хребетний руховий сегмент. При цьому біль розглядається швидше як корисний сигнал про наявність ноцицептивного джерела, що продукується нормально функціонуючою нервовою системою. Існує декілька поширених синдромів, що характеризуються болем і гіперчутливістю, проте при цьому немає чіткого етіологічного чинника, і тому його нерідко називають нез’ясовним.
У патогенезі цього типу болю, що прийнято називати дисфункціональним, провідну роль відіграють не периферичні ушкодження, а нейродинамічні порушення центральної нервової системи. Дослідження показують, що пацієнти з хронічним болем у спині вирізняються підвищеним ризиком розвитку хронічного головного болю, дисфункції, болю в шийному відділі хребта [34, 42, 43]. Біль у спині частіше зустрічається при низькій самооцінці стану здоров’я та за наявності ряду захворювань: мігрені, захворювань серця, кісток, суглобів [39]. Таке поєднання різних больових синдромів вказує швидше на порушення процесів обробки ноцицептивної інформації в центральній нервовій системі, наявність «пластичної пам’яті» на біль, що дозволяє йому надалі «існувати відносно незалежно від початкового джерела ноцицептивної імпульсації» [30].
Серед структурних ушкоджень, що викликають LBP, можна виділити такі: грижа пульпозного ядра; вузький хребетний канал (стеноз центрального каналу, стеноз латерального каналу); нестабільність унаслідок дискової (дегенерації міжхребетного диска) або екстрадискової (фасеточних суглобів, спондилолістезу) патології; м’язово-тонічний, або міофасціальний, синдром [32].
У генезі LBP велике значення мають функціональні порушення в різних відділах хребта — обмеження його рухливості в хребетному руховому сегменті або зворотне блокування, причинами якого можуть бути статичні або динамічні навантаження, антифізіологічні пози й травми [1, 2, 19]. Біль, пов’язаний з ураженням дуговідросткових суглобів, може визначатися ізольовано або поєднуватися з іншими біомеханічними порушеннями. До останніх належить дегенеративний спондилолістез, пов’язаний із сагітальною орієнтацією дуговідросткових суглобів у поперековому відділі хребта. Оскільки міжхребетний диск і дуговідросткові суглоби разом забезпечують рухи в хребетному руховому сегменті, вони позначаються в літературі як «трисуглобовий комплекс». Відомо, що дуговідросткові суглоби містять велику кількість інкапсульованих і неінкапсульованих нервових закінчень. Наявність низькопорогових механоцепторів у капсулі суглоба свідчить на користь того, що вона виконує й пропріорецептивну функцію. Окрім субстанції Р і кальцитонін-ген-спорідненого пептиду, значне число нервових закінчень містить нейропептид Y — речовину, характерну для симпатичних еферентних волокон. При дегенеративному ураженні дуговідросткових суглобів у хрящі й синовіальній капсулі визначаються медіатори запалення: простагландини, інтерлейкіни (ІЛ) 1 і 6, фактор некрозу пухлини a [29].
У патогенезі розвитку радикулопатії обговорюється роль цитокінів. У дисках пацієнтів, які були прооперовані з приводу радикулопатії, відмічено підвищення рівнів інтерлейкіну-1, інтерлейкіну-1a, інтерлейкіну-6, інтерлейкіну-8, простагландину Е2 і фактора некрозу пухлини a [25, 40]. Цитокіни, особливо фактор некрозу пухлини a, посилюють синтез потужного медіатора запалення — оксиду азоту. В експериментах на тваринах активність синтетази оксиду азоту підвищувалася при дії вмісту пульпозного ядра на корінці спинномозкових нервів, а її інгібування зменшувало вираженість набряку корінця й покращувало швидкість проведення збудження по нервових волокнах [25].
Імунна система також може опосередковано формувати дію пульпозного ядра на корінці спинномозкових нервів. За сучасними уявленнями, розвиток аутоімунних процесів пов’язаний зі змінами природної імунологічної толерантності внаслідок антигенної стимуляції модифікованими або перехресно реагуючими антигенами, а також антигенами зі зниженою толерантністю, порушенням функції імунологічної толерантності до аутоантигенів та появою аутоагресивного клону імунокомпетентних клітин. У цих випадках імунні реакції відрізняються органним тропізмом і передбачають самопідтримання захворювання.
У зв’язку з вищеперерахованим слід зазначити, що LBP — це поліетіологічний симптомокомплекс вертеброгенного, травматичного, соматогенного та іншого генезу [3, 7, 13, 14, 16]. Передбачається також можливість комбінування причинних факторів його розвитку, що найбільш часто є основою диференціально-діагностичних помилок, обумовлених суб’єктивною позицією дослідника при встановленні діагнозу. Переважно ураження корінців спинномозкових нервів обумовлене вертебральними причинами — наявністю грижі міжхребетного диска, дегенеративними змінами в міжхребетних суглобах, вузьким хребетним каналом [12, 17].
Доведено, що процеси дегенерації хряща в периферичних суглобах і міжхребетних суглобах ідентичні. Для проведення патогенетичної терапії остеохондротичних змін запропоновано безліч препаратів, проте структурно-модифікуючий ефект доведений лише для хондроїтину сульфату, глюкозаміну сульфату, неомилюваних сполук екстрактів олії бобів сої та авокадо (Піаскледин), діацереїну, гіалуронової кислоти.
Одним із структурно-модифікуючих препаратів є Піаскледин (ASU) (Laboratories Expanscience, Франція). У препараті, що випускається по 300 мг у капсулах, міститься 2/3 екстракту олії бобів сої та 1/3 екстракту олії авокадо. Механізм дії Піаскледину спрямований на інгібування ІЛ-1, стимуляцію синтезу колагену в культурі хондроцитів і синтез протеогліканів. У людських хондроцитах Піаскледин пригнічує синтез колагенази, стромелізину, ІЛ-6 і ІЛ-8, а також простагландину Е2 [33]. Крім стимуляції синтезу міжклітинної речовини гіалінового хряща (протеогліканів і колагенових волокон), притаманної іншим структурно-модифікуючим препаратам, Піаскледин підвищує експресію трансформуючого фактора росту β1 (TGF-β1), трансформуючого фактора росту β2 (TGF-β2), а також інгібітору активатора плазміногену-1 (PAI-1) [22]. Трансформуючі фактори росту є цитокінами, що синтезуються хондроцитами й остеобластами. Вони регулюють синтез макромолекул міжклітинної речовини суглобового хряща. З одного боку, TGF-β мають анаболічний ефект і є одними з найпотужніших стимуляторів синтезу макромолекул хряща, з іншого — гальмують їх деградацію. PAI-1 пригнічує продукцію активатора плазміногену, що бере участь у пошкодженні хряща, як опосередковано (через стимуляцію металопротеїназ), так і внаслідок прямої дії на хрящ шляхом активації деградації протеогліканів.
Симптом-модифікуючий ефект Піаскледину при остеоартрозі (ОА) колінних і кульшових суглобів вивчений у ряді рандомізованих клінічних досліджень (РКД) [33–36]. У подвійному сліпому плацебо-контрольованому РКД [24] оцінювалась потреба в нестероїдних протизапальних препаратах (НПЗП) у 163 хворих із помірними й сильними болями при ОА колінних і кульшових суглобів, які отримували Піаскледин або плацебо. Потреба в НПЗП протягом 3 місяців лікування була вірогідно меншою в групі хворих, які отримували активний препарат, ніж у групі плацебо (43,4 і 69,7 % хворих відповідно; p < 0,001), так само як і кумулятивна доза НПЗП (p < 0,001) (табл. 1).
/44/44.jpg)
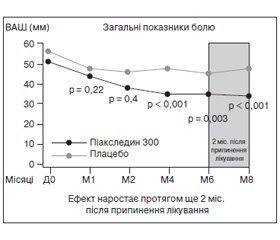
У більш тривалому (8 місяців) плацебо-контрольованому РКД [35] оцінювалась динаміка кількісних показників, що відображають біль при ОА за 6 місяців активної терапії в 164 хворих із гонартрозом і коксартрозом, а також збереження ефекту протягом 2 місяців після закінчення прийому препарату. Вірогідну перевагу Піаскледину порівняно з плацебо було показано за такими параметрами: зменшення болю (оцінка за візуально-аналоговою шкалою (ВАШ), мм, р = 0,003), зменшення функціонального індексу Лекена ( p < 0,001). Також відзначено значне зменшення потреби в НПЗП в основній групі порівняно з групою плацебо за весь час лікування — 48 і 63 % хворих відповідно (р = 0,054). Особливо цікаво, що спостерігалося подальше зменшення потреби в НПЗП протягом 2 місяців після відміни лікування (48 і 56,4 % відповідно, p < 0,05) і було підтверджено наявність у Піаскледину тривалої й вираженої післядії (рис. 1).
/45/45.jpg)
Структурно-модифікуючий ефект Піаскледину був оцінений у 2 багатоцентрових плацебо-контрольованих РКД [36, 38]. Дослідження, проведене M. Lequesne et al. у 2002 році, включало 163 пацієнтів з одно- або двостороннім коксартрозом. Тривалість дослідження — 2 роки. Стадія за Kellgren — Lawrence до початку дослідження була I–II. Обов’язковим критерієм включення в дослідження було зареєстроване рентгенологічно звуження щілини кульшового суглоба, усі хворі відзначали постійний біль в уражених суглобах тривалістю не менше 6 міс., індекс Лекена був 4 бали й більше. Пацієнти були рандомізовані й розподілені на 2 групи: 85 хворих протягом усього дослідження отримували 300 мг/добу Піаскледину, а 78 хворих отримували плацебо. За демографічними й клінічним параметрами групи були порівнянні. У цілому в обох групах відзначалася подібна динаміка зміни суглобової щілини, але серед хворих, які мали ширину суглобової щілини на початку дослідження менше 2,5 мм, прийом Піаскледину зменшив негативну динаміку порівняно з плацебо практично у 2 рази: при прийомі Піаскледину звуження суглобової щілини становило 0,43 мм, на тлі плацебо — 0,86 мм (p < 0,01).
Інше дослідження E. Maheu et al., опубліковане у 2013 році, тривало протягом 3 років, воно включало 399 хворих із коксартрозом за наявності клінічної симптоматики (постійний або рецидивуючий біль протягом останнього року, альгофункціональний індекс Лекена — від 3 до 10 балів). У цьому дослідженні оцінка зміни ширини суглобової щілини в кульшовому суглобі була первинною кінцевою точкою й проводилась двома незалежними оцінювачами на початку дослідження, через 1, 2 і 3 роки. Включалися пацієнти з шириною суглобової щілини від 1 до 4 мм. Враховуючи, що вже після початку дослідження міжнародний консенсуc [42–44] не рекомендував використовувати зміну суглобової щілини як первинну кінцеву точку у зв’язку з труднощами трактування такої зміни (нерівномірність і несиметричність змін), додатково в групах хворих, які отримували Піаскледин або плацебо, оцінювали кількість хворих із рентгенологічним прогресуванням ОА. Прогресування деструкції хряща реєструвалося, якщо зменшення суглобової щілини було ≥ 0,5 мм за 3 роки. Серед хворих, які закінчили дослідження (по 170 пацієнтів у кожній групі), зменшення суглобової щілини за 3 роки становило –0,67 мм у групі плацебо і –0,64 мм у групі хворих, які отримували активний препарат (різниця 0,034 мм; 95 % CI –0,156–0,225), відмінності невірогідні (р = 0,72). При цьому вірогідно менше було хворих із рентгенологічним прогресуванням звуження суглобової щілини при лікуванні Піаскледином (40,4 %), ніж у групі плацебо (50,3 %) (р = 0,040).
У 2008 році був проведений метааналіз РКД з Піаскледином [28], у яких взяли участь 664 пацієнти з ОА кульшових (41,4 %) і колінних суглобів (58,6 %). Піаскледин перевершував плацебо щодо впливу на біль (середнє зменшення болю за ВАШ становило 10,7 % при гонартрозі і 11,3 % при коксартрозі; р = 0,04) і на функціональний індекс Лекена (р = 0,0003). У 3 дослідженнях відзначався вірогідно більший, ніж при застосуванні плацебо, позитивний ефект Піаскледину на вищезазначені показники, тільки в дослідженні M. Lequesne et al. [37] симптоматичний ефект Піаскледину не відрізнявся від ефекту плацебо. Нагадаємо, що основним критерієм відбору хворих у це дослідження було значне звуження суглобової щілини кульшового суглоба. А оскільки при ОА добре відома дисоціація між клінічними й рентгенологічними проявами ОА, можливо, група хворих не мала виражених симптомів ОА.
У відкритому рандомізованому дослідженні ефективності та безпеки Піаскледину в комбінації з нестероїдними протизапальними препаратами [21] порівняно з НПЗП у 2 паралельних групах пацієнтів із болем у нижній частині спини, асоційованим зі спондилоартрозом, спостерігалося значне зменшення вираженості больового синдрому, особливо при збільшення тривалості прийому Піаскледину, покращення функціонального стану хребта, що поєднувалося з відмінною переносимістю препарату.
Висока безпека Піаскледину відзначена у всіх клінічних дослідженнях, не було зареєстровано жодних значущих побічних ефектів або випадків передозування препарату при його тривалому застосуванні. Важливим аспектом безпеки є відсутність значущих лікарських взаємодій Піаскледину з відомими препаратами. Особливо це важливо для літніх хворих, які приймають велику кількість препаратів для лікування супутніх захворювань.
Таким чином, Піаскледин продемонстрував вірогідний симптоматичний ефект при дегенеративно-дистрофічних змінах у суглобах та хребті, що розвивається в перші місяці застосування й наростає при тривалому лікуванні. На фоні прийому Піаскледину значно зменшується біль, покращується функціональний стан суглобів і хребта. Добра переносимість і можливість поєднання Піаскледину з будь-якими лікарськими засобами дозволяють використовувати його у хворих будь-якого віку, незалежно від наявності коморбідних станів, для зупинки прогресування дегенеративних змін у суглобах і, відповідно, зменшення ступеня вираженості болю в нижньому відділі спини. Препарат зручний для прийому — 1 капсула на день, що, безсумнівно, збільшує комплайєнс при його застосуванні хворими. Піаскледин приймають протягом 3–6 міс., курс лікування повторюють ще через 3–6 місяців.
1. Абакумов Р.М. Зміни опорно–рухового апарату при болю в попереку у спортсменів // Лікарська справа. — 2001. — № 1. — С. 120–123.
2. Алексеев В.В. Диагностика и лечение острых поясничных болей // Consilium Medicum. — 2009. — № 2. — С. 42–46.
3. Антонов И.П. Патогенез и диагностика остеохондроза позвоночника и его неврологических проявлений: состояние проблемы и перспективы изучения // Журнал невропатологии и психиатрии. — 1986. — № 4. — С. 481–488.
4. Баринов А.Н. Комплексное лечение боли // Русский медицинский журнал. — 2007. — Т. 15, № 4. — С. 215.
5. Барон Ральф. Современные средства диагностики боли при невропатии: от лаборатории к постели больного // Международный неврологический журнал. — 2007. — № 3(13). — С. 108–114.
6. Болевые синдромы в неврологической практике / Под ред. проф. В.Л. Голубева. — 4-е изд. — М.: МЕДпресс-информ, 2010. — 336 с.
7. Головченко Ю.И. О диагностике и классификации заболеваний периферического отдела нервной системы // Врачебное дело. — 1985. — № 7. — С. 98–102.
8. Дамулин И.В., Семенов П.А. Боли в спине: клинические и лечебные аспекты // Український неврологічний журнал. — 2011. — № 3. — С. 79–85.
9. Данилов А.Б. Страдание и хроническая боль // Русский медицинский журнал. — 2008. — Т. 16, № 4. — С. 7.
10. Данилов А.Б., Жаркова Т.Р. Невропатический компонент при радикулопатии: диагностика и лечение // Боль. — 2009. — № 4. — С. 33–37.
11. Данилов А.Б., Курганова Ю.М. Центральная сенситизация: клиническая значимость // Неврология и ревматология. — 2012. — № 1.
12. Кардаш А.М., Черновский В.И. и др. Клиника, дифференциальная диагностика и патогенез развития компрессионного рубцово–спаечного эпидурита в послеоперационном периоде после удаления грыжи дисков поясничного отдела позвоночника // Международный неврологический журнал. — 2011. — № 2(40). — С. 116–117
13. Мавров І.І., Мавров Г.І. Лікування хламідіозу та мікоплазмозу: інформаційно-методичний посібник для лікарів-дерматовенерологів. — Харків: Факт, 2000. — 24 с.
14. Мартынов Ю.С., Малкова Е.В., Чекнева Н.С. Изменения нервной системы при заболеваниях внутренних органов. — М.: Медицина, 1980. — 224 с.
15. Насонов Е.Л. Применение нестероидных противовоспалительных препаратов: терапевтические перспективы // Русский медицинский журнал. — 2002. — Т. 10, № 4. — С. 206–212.
16. Панченко Д.И. Заболевания нервных стволов. — К.: Здоров’я, 1966. — 212 с.
17. Парфенов В.А., Батишева Т.Т. Біль у спині: особливості патогенезу, діагностики та лікування // Сімейна медицина. — 2004. — № 2. — С. 22–25.
18. Поворознюк В.В., Орлик Т.В., Дудко О.Т. Лікування вертебрального больового синдрому при остеохондрозі шийно-грудного відділу хребта в жінок із клімактеричними розладами // Науково–практичний журнал. — 2003. — Т. 6, № 4. — С. 4–10.
19. Ситель А.Б., Тетерина Е.Б. Мидокалм в комплексном лечнии больных с компрессионными синдромами спондилогенных заболеваний // Мистецтво лікування. — 2003. — № 4. — С. 82–85.
20. Слободин Т.М. Механзмы формирования боли, методики ее исследования и способы коррекции алгий в практике врача-невролога // Здоров’я України. — Лютий 2011. — № 4(257). — С. 13.
21. Шостак Н.А., Правдюк Н.Г. Дегенеративное поражение позвоночника: представления о болезни, подходы к терапии (собственные данные) // Современная ревматология. — 2008. — № 3. — С. 30–36.
22. Altinen L., Saritas Z.K., Kose K.C. et al. Treatment with unsaponifiable extracts of avocado and soybean increases TGF-beta1 and TGF-beta2 levels in canine joint fluid // Tohocu J. Exp. Med. — 2007. — 211. —181–86.
23. Andersson G. Low back pain // Spin. — 1981. — Vol. 6(1). — Р. 60.
24. Blotman F., Maheu E., Wulwic A. et al. Efficacy and safety of avocado/soybean unsaponifiables in the treatment osteoarthritis of the knee and hip // Rev. Rhum. (Engl. Ed.). — 1997. — Vol. 64. — 825–34.
25. Brisby F.I., Byrod G., Olmarker K. et al. Nitric oxide as a mediator of nucleus pulposus–induced effects on spinal nerve roots // J. Orthop. Res. — 2000. — Vol. 18 — P. 815–820.
26. Cаssidy J.D., Carrol L.J., Cote P. Saskatchewan health and back pain survey. The prevalence of low back pain and related disability in Saaskathewan adults // Spine. — 2008. — 23. — 17. — P. 1860–1866.
27. Chiang C.Y., Li Z., Dostrovsky J.O., Sessle B.J. Central sensitization in medullary dorsal horn involves gap junctions and hemichannels // Neuroreport. — 2010. — 21. — 233–7.
28. Christensen R., Barteles E.M., Astrup A. et al. Symptomatic efficacy of avocado/soybean unsaponifiables(ASU) in Osteoarthritis (OA) patients: a meta-analysis of randomized controlled trials // Osteoarthritis Cartilage. — 2008. — 16(2). — 339–408.
29. Cohen M., Quintner J. The horse is dead: let myofascial pain syndrome rest in peace // Pain Med. — 2008. — Vol. 9(4). — 464–465.
30. Creed F. Somatization and Pain Syndromes // Functional Pain Syndromes: presentation and pathophysiology / Ed. by E. Mayer, C. Bushnell. — Seatle: IASP PRESS, 2009. — 227–245.
31. Graif M., Olchovcky D., Franke О. et al. Ultrasonic demonstration of iliopsoas hematoma causing femoral neuropathy // Jsr. J. Med. Sci. — 1982. — Vol. 18. — P. 967–968.
32. Hadler N. Arthritis and Allied conditions. — 13th еd. — Baltimore, 1997. — Vol. 2. — P. 1821–1833.
33. Henrotin Y.E., Labasse A.H., Jaspar J.M. et al. Effects of three avocado/soybean unsopanifiable miхtures on metalloproteinases, cytokines and prostaglandin E2 production by human articular chondrocytes // Clinical Rheum. — 1998. — 17. — 31–39.
34. Kaaria S., Solovieva S., Leino-Arjas P. Associations of low back pain with neck pain: a study of industrial employees with 5-, 10-, and 28-year follow-ups // Eur. J. Pain. — 2009. — Vol. 13(4). — P. 406–11.
35. Maheu E., Mazieres B., Valat J.-P. et al. Symptomatic efficacy of avocado/soybean unsaponifiables in the treatment of osteoarthritis of the knee and hip // Arthritis Rheum. — 1998. — Vol. 41. — Р. 81–91.
36. Maheu E., Cadet C., Marty M. et al. Randomised, controlled trial of avocado-soybean unsaponifiables (Piascledine) effect on structure modification in hip osteoarthritis: the ERADIAS study // Ann. Rheum. Dis. — 2013. 0:1-9. doi: 10.1136/annrheumdis-2012-202485.
37. Mense S. Peripheferal and central mechanisms of musculosceletal pain // Fundamentals of musculosceletal pain. — Seattle: IASP Press, 2008. — P. 55–62.
38. Lequesne M., Maheu E., Cadet C. et al. Structural effect of avocado/soybean unsopanifiables on joint space loss in osteoarthritis of hip // Arthritis Care Research. — 2002. — Vol. 47. — Р. 50–58.
39. Schwarzer A.C., Aprill C.N., Bogduk N. The sacroiliac joint in chronic low back pain // Spine. — 1995. — Vol. 20. — P. 31–37.
40. Takahashi H., Suguro Т., Okazima Y. et al. Inflammatory cytokines in the herniated disc of the lumbar spine // Spine. — 1996. — Vol. 21. — P. 218–24.
41. Van Kleef M., Barendse G.A., Kessels F. et al. Randomized trial of radiofrequency lumbar facet denervation for chronic low back pain // Spine. — 1999. — Vol. 24. — P. 1937.
42. Von Korff, Deyo R.A., Cherkin D. et al. Back pain in primary care: outcomes at one year // Spine. — 1993. — Vol. 18, № 7. — P. 855–862.
43. Wiesinger В., Malker H., Englund E. Back pain in relation to musculoskeletal disorders in the jaw-face: a matched case-control study // Pain. — 2007. — Vol. 131(3). — P. 311–319.
44. Shar R.V., Boswell M.V., Everett C.R. et al. Interventional techniques in the management of chronic spinal pain: Evidence-based practice guidelines // Pain Physician. — 2005. — 8. — P. 1–48.