Журнал «Боль. Суставы. Позвоночник» 4 (16) 2014
Вернуться к номеру
Новые направления в лечении остеоартроза в Украине
Авторы: Наталия Куприненко
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 47-50
В рамках конференции «Актуальные проблемы гериатрической ревмоортопедии», которая состоялась 22–24 октября в г. Киеве, прозвучало много докладов, касающихся вопросов лечения остеоартроза (ОА) и остеопороза. Одним из них был доклад ведущего научного сотрудника отдела клинической физиологии и патологии опорно-двигательного аппарата ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины», д.м.н. Н.В. Григорьевой, посвященный новым направлениям лечения остеоартроза, в частности эффективности и безопасности препарата Пиаскледин 300 при этом заболевании.
Остеоартрозы являются гетерогенной группой заболеваний суставов различной этиологии, но со сходными биологическими, морфологическими и клиническими признаками и исходом, приводящими к потере хряща и сопутствующему поражению других компонентов сустава (субхондральной кости, синовиальной оболочки, связок). Среди всех заболеваний суставов остеоартроз занимает первое место и встречается у 10–20 % населения земного шара. В структуре общей заболеваемости ОА диагностируется у 5,3–17,3 % больных, по частоте обнаружения в структуре ревматических заболеваний его доля составляет более 40–50 %. ОА чаще встречается в женской популяции, преимущественно в возрасте 30–50 лет, у 18 % больных первые признаки заболевания проявляются до 30 лет.
Факторами риска развития ОА являются избыточная масса тела, повреждение суставов, чрезмерные нагрузки на сустав, слабость связочного аппарата. К факторам, инициирующим старение хряща, относят повреждающую механическую нагрузку, нарушение гормонального статуса, генетические факторы, в результате чего появляются трещины в хряще, уменьшается количество хондроцитов, содержание воды и накапливаются гликозилированные продукты. Постепенно изменения в хряще становятся необратимыми. В суставном хряще накапливаются металлопротеиназы, которые катализируют деградацию протеогликана и коллагена. Синовиальная оболочка периодически воспаляется и продуцирует повышенное количество цитокинов — интерлейкина-1, -6, -15, -18 (ИЛ-1, ИЛ-6, ИЛ-15, ИЛ-18) и фактора некроза опухоли (TNF), которые индуцируют образование оксида азота и продукцию металлопротеиназ. Влияние ИЛ-6 и чрезмерная механическая нагрузка приводят к катаболизму цитокиновых рецепторов, что способствует увеличению деградации хрящевой ткани.
Исходя из факторов риска и патогенеза ОА, ключевыми позициями тактики лечения данного заболевания являются: механическая разгрузка пораженного сустава, купирование болевого синдрома и реактивного синовиита (назначение симптом-модифицирующих препаратов быстрого (НПВС, ацетаминофен, глюкокортикоиды) и медленного действия (глюкозамин и его производные, хондроитин сульфат, диацереин, гиалуроновая кислота, неомыляемые соединения масел авокадо и сои)) и предупреждение прогрессирования заболевания (применение структурно-модифицирующих средств замедленного действия).
Эффективность структурно-модифицирующих препаратов в последние годы изучается достаточно широко. В Рекомендациях EMEA (European Medicines Agency) 2010 года представлены четкие инструкции по оценке структурно-модифицирующего действия препаратов. Ключевые положения этих рекомендаций заключаются в том, что в связи с патологическими и функциональными различиями ОА коленного или тазобедренного суставов и ОА кистей экстраполяция результатов, полученных при гон- или коксартрозе, на ОА кистей (или наоборот, экстраполяция данных, полученных при ОА кистей, на пациентов с гон- и коксартрозом) не представляется возможной. Соединения, демонстрирующие эффективность при ОА тазобедренного или коленного сустава, могут быть зарегистрированы как «препараты для лечения ОА тазобедренного или коленного сустава». Соединения, показавшие эффективность для лечения ОА кистей, должны быть зарегистрированы как «препараты для лечения ОА кистей». Для получения индикации «для лечения ОА» в общем соединение должно продемонстрировать эффективность как при ОА кистей, так и при ОА коленного/тазобедренного суставов. Также в рекомендациях EMEA прописаны методы оценки эффективности препаратов. Указано, что оценка влияния препаратов при ОА кистей должна производиться путем оценивания прогрессирования заболевания в проксимальных и дистальных межфаланговых суставах либо совместно с оценкой в суставе большого пальца. Для ОА тазобедренного сустава наиболее важными критериями являются сужение суставной щели, краевые остеофиты и субхондральный склероз. Для ОА коленного сустава изучение симптомно- и структурно-модифицирующего влияния препаратов более предпочтительно для медиального тибиофеморального, чем для пателлофеморального варианта ОА. Для изучения структурно-модифицирующего влияния препаратов в качестве критериев включения пациентов в исследование рекомендуются 2-я или 3-я рентгенологическая стадия ОА по Kellgren — Lawrence (то есть должно быть достаточное оставшееся расстояние для возможности обнаружения ухудшения/прогрессирования ОА) или заранее определенная ширина суставной щели (в мм). Структурные изменения при ОА можно выявить с помощью рентгенографии путем измерения сужения суставной щели при ОА коленного или тазобедренного суставов (могут быть подтверждены и другими методами, которые, возможно, будут разработаны в будущем).
Аналогичные подходы изложены в рекомендациях Американского колледжа ревматологов (ACR) 2012 года, где представлены положения по терапии отдельно для ОА суставов кисти, ОА коленного сустава и ОА тазобедренного сустава. В рекомендациях EULAR 2003 года отдельными пунктами изложены положения по лечению гонартроза, в том числе указано, что симптоматические препараты замедленного действия (глюкозамина сульфат, хондроитина сульфат, неомыляемые соединения масел авокадо и сои, диацереин и гиалуроновая кислота) обладают симптоматическим эффектом и способностью модифицировать структуру хряща. В рекомендациях EULAR 2005 года выделены положения по лечению коксартроза, где касательно действия симптоматических препаратов замедленного действия на ОА данной локализации указано, что эти препараты обладают симптоматическим эффектом и низкой токсичностью, но их структурно-модифицирующий и фармакоэкономический эффекты недостаточно изучены. Рекомендации EULAR 2007 года в отношении применения симптоматических медленнодействующих препаратов (глюкозамина сульфат, хондроитина сульфат, неомыляемые соединения масел авокадо и сои, диацереин и гиалуронат для внутрисуставного введения) для лечения ОА кисти гласят, что эти препараты могут оказывать симптоматический эффект при низкой токсичности, но эффект их не является значительным, критерии подбора пациентов не определены, а клиническая сопоставимость структурно-модифицирующего действия и фармакоэкономического аспекта точно не установлена. Таким образом, четко демонстрируется необходимость дифференцированного подхода к назначению терапии ОА в зависимости от локализации поражения.
В последние годы активно исследуются симптоматические, симптом-модифицирующие и структурно-модифицирующие эффекты фитокомпонентов и растительных экстрактов в лечении остеоартроза. Например, проведены рандомизированные исследования (РИ) эффективности по сравнению с плацебо экстракта ивовой коры, порошка стеблей шиповника, имбиря и куркумы, бромелаина, мартинии душистой. В трехмесячном перекрестном РИ порошок шиповника в дозе 2500 мг/сут 2 р/день уменьшал боль более эффективно, чем плацебо, когда плацебо давалось первым. При применении порошка шиповника было зарегистрировано более выраженное уменьшение величин отдельных подшкал WOMAC, характеризующих функцию сустава и скованность, чем в группе плацебо. В нескольких исследованиях доказано, что применение экстракта корневищ имбиря более эффективно в уменьшении болевого синдрома, чем плацебо. В 4-месячном диацерин-контролируемом РИ у больных с обострением гон- и коксартроза показано, что прием 2,6 г/сут порошка был не менее эффективным в уменьшении болевого синдрома, чем 200 мг/сут диацерина.
Общеизвестна роль жирных кислот в процессе воспаления — повышенное содержание в биологических жидкостях и тканях омега-3 жирных кислот сопровождается снижением синтеза биологически активных веществ с провоспалительными свойствами, в частности лейкотриенов, простагландинов, интерлейкинов. В суставном хряще содержание арахидоновой кислоты, омега-6-предшественника провоспалительного эйкозаноида простагландина Е2, коррелирует с частотой ОА, а диета с очень низким содержанием омега-полиненасыщенных жирных кислот (wПНЖК) ведет к истощению синтеза протеогликанов. Природными источниками омега-ПНЖК являются растительные масла (кукурузное, льняное, соевое, каноловое), семена льна, кунжута, мака, тыквы, грецкие орехи, соевые бобы, темно-зеленые лиственные овощи, пророщенная пшеница, авокадо. Авокадо является одним из «лидеров» по содержанию ПНЖК — на их долю приходится 80 % общего содержания жиров.
Соевые бобы за счет содержания в них флавоноидов повышают уровень инсулиноподобного фактора роста 1, который является анаболическим фактором для хондроцитов. Соя является единственным растением, снабжающим человека высококачественным белком, наиболее приближенным по своему составу к белкам животного происхождения. Соевый жир по сравнению с животными жирами богаче ПНЖК, составляющими более 50 %.
Высокотехнологичным продуктом переработки масел авокадо и сои, обладающим структурно-модифицирующим эффектом при ОА, является оригинальный французский препарат Пиаскледин 300 (ASU). В Украине он начал применяться недавно, однако в других странах накоплены достаточно большой опыт его использования и доказательная база его эффективности, в результате чего Пиаскледин 300 внесен как в европейские, так и в международные рекомендации по лечению ОА (EULAR, OARSI).
Одним из основных механизмов действия Пиаскледина 300 является его влияние на экспрессию цитокинов. Пиаскледин ингибирует ИЛ-1, предотвращая его повреждающее действие на хондроциты и синовиоциты, стимулирует синтез коллагена и протеогликанов. Он угнетает ИЛ-1-cтимулированный синтез металлопротеиназ (коллагеназы и стромелизина) хондроцитами, экспрессию ИЛ-6 и ИЛ-8, а также простагландина Е2, что обусловливает как антикатаболическое действие на матрикс хряща, так и ингибицию «вторичного» воспаления в тканях сустава, а именно: в синовиальной оболочке, связках, субхондральной кости и непосредственно в гиалиновом хряще.
Пиаскледин 300 повышает экспрессию трансформирующего фактора роста бета-1 (TGF-бета-1), трансформирующего фактора роста бета-2 (TGF-бета-2) и ингибитора плазминогена 1 (PAI-1), стимулирует синтез протеогликанов и образование коллагеновых волокон, ингибирует и блокирует синтез ИЛ-1, оказывая положительный эффект на хондроциты и синовиоциты, угнетает синтез хондроцитами коллагеназы, стромелизина, ИЛ-6, ИЛ-8, ПГЕ-2.
В рандомизированном плацебо-контролируемом исследовании симптом-модифицирующего действия Пиаскледина, проведенном E. Maheu et al. с участием 164 пациентов с ОА коленного и тазобедренного суставов (длительность исследования 6 месяцев с последующим наблюдением за больными в течение 2 месяцев), оценка эффективности лечения проводилась по следующим критериям: функциональный индекс Лекена, интенсивность боли по ВАШ, общий балл недееспособности, уровень успешности лечения. Лечение Пиаскледином показало симптом-модифицирующий эффект (в отличие от плацебо) — было отмечено снижение боли по ВАШ более чем на 50 % и улучшение индекса Лекена более чем на 30 % по сравнению с исходным уровнем (рис. 1). Эффект Пиаскледина отмечался со второго месяца его приема и сохранялся еще на протяжении 2 месяцев по окончании курса лечения.
/49/49.jpg)
Также симптом-модифицирующий эффект Пиаскледина у пациентов с ОА коленного и тазобедренного суставов оценивался в проспективном многоцентровом рандомизированном плацебо-контролируемом исследовании Blotman et al. Пациенты с 1-го по 45-й дни исследования принимали Пиаскледин 300 мг/сут + НПВП либо плацебо + НПВП, а с 45-го по 90-й дни исследования принимали Пиаскледин 300 мг/сут + НПВП (по необходимости) либо плацебо + НПВП (по необходимости). За время проведения данного исследования 6 пациентов из 10 снизили дозу или отменили прием НПВП на фоне приема Пиаскледина, в то время как на фоне приема плацебо снизили дозу или отменили НПВП только 3 пациента из 10.
В сравнительном исследовании проф. K. Pavelka с участием 364 пациентов с ОА коленных суставов эффективность и безопасность Пиаскледина (300 мг/сут) изучалась в сравнении с хондроитина сульфатом (400 мг 3 р/сут) в течение 6 месяцев применения и еще 2 месяца после прекращения лечения. В середине и в конце исследования у больных обеих групп функциональные индексы WOMAC и Лекена уменьшились приблизительно на 50 %, а в течение последующих двух месяцев эти показатели продолжали снижаться, демонстрируя эффект последействия препарата. Переносимость лечения была хорошей в обеих группах — 94 % пациентов, принимавших Пиаскледин, и 96 % пациентов, получавших хондроитина сульфат, охарактеризовали свое состояние как «очень хорошее». Все пациенты отметили, что им удобнее было принимать 1 таблетку в сутки (Пиаскледин), чем 3 таблетки в сутки (хондроитина сульфат).
M. Lequesne и соавт. изучали структурно-модифицирующий эффект Пиаскледина в проспективном рандомизированном двойном слепом плацебо-контролируемом многоцентровом исследовании с участием 163 пациентов (средний возраст 63 года) с ОА тазобедренного сустава. Длительность исследования составила 2 года. До начала исследования все пациенты отмечали боль в тазобедренном суставе более 6 месяцев, высота суставной щели (ВСЩ) у них была более 1 мм, функциональный индекс Лекена ≥ 4. Первичной конечной точкой данного исследования было замедление сужения высоты суставной щели (определялось с помощью рентгенографии в начале исследования, через 1 и 2 года). Вторичными конечными точками выступали функциональная недостаточность (индекс Лекена), боль (по ВАШ), использование НПВП и общая оценка исследователя и пациента. Результаты проведенного исследования показали, что Пиаскледин значительно (в 2 раза) замедляет сужение суставной щели по сравнению с плацебо в группе пациентов с тяжелой формой заболевания (ВСЩ ≤ 2,45 мм) (р < 0,01).
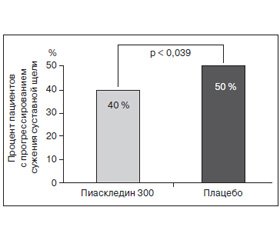
Структурное действие Пиаскледина изучалось и в трехлетнем проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании ERADIAS, в которое были включены 399 пациентов с первичным ОА тазобедренного сустава. На момент начала исследования у пациентов, несмотря на применение НПВП или анальгетиков, отмечался умеренный и выраженный болевой синдром (по ВАШ > 40 мм более 1 года), средняя ВСЩ составляла 2,8 ± 0,9 мм. В то время как по окончании исследования существенного различия между группами в изменении ВСЩ в общей популяции участников исследования не наблюдалось, процент прогрессоров был на 20 % ниже в группе Пиаскледина по сравнению с группой плацебо (р = 0,039) (рис. 2).
/50/50.jpg)
R. Christensen и соавт. (2008) провели метаанализ исследований Пиаскледина при ОА, в который включили 4 РКИ (624 пациента) длительностью от 3 до 24 месяцев. Все эти исследования продемонстрировали высокую эффективность в устранении болевого синдрома на фоне лечения Пиаскледином и хорошую переносимость и приверженность к лечению (только 3 % пациентов прекратили лечение).
Таким образом, уникальный состав (комплекс неомыляемых фитостеролов и жирных кислот) с двойным механизмом действия (хондропротекция и хондростимуляция), высокая эффективность в отношении симптомов ОА, доказанная способность замедлять прогрессирование ОА, отсутствие взаимодействия с другими препаратами, высокий уровень безопасности сделали Пиаскледин 300 признанным стандартом лечения ОА с 2003 года, входящим в число препаратов, рекомендованных EULAR и OARSI. Проведенные исследования также показали, что применение Пиаскледина 300 позволяет значительно снизить дозу или отменить прием НПВП, кардинально улучшить качество жизни пациентов с ОА коленных и тазобедренных суставов. На данный момент Пиаскледин 300 является уникальным препаратом, поскольку не имеет аналогов в Украине и в Европе.