Журнал «Здоровье ребенка» 1 (60) 2015
Вернуться к номеру
Активированные кислородсодержащие метаболиты организма человека при заболеваниях органов дыхания. Генераторы и генерация (часть 1)
Авторы: Абатуров А.Е. — ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. — Национальный медицинский университет им. А.А. Богомольца, г. Киев; Юлиш Е.И., Чернышова О.Е. — Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В обзоре даны общие представления об активированных кислородсодержащих метаболитах человеческого организма при заболеваниях органов дыхания.
В огляді подано загальні уявлення про активовані кисневмісні метаболіти людського організму при захворюваннях органів дихання.
This review gives a general idea of the activated oxygen-containing metabolites of the human body in respiratory diseases.
активированные кислородсодержащие метаболиты, заболевания органов дыхания.
активовані кисневмісні метаболіти, захворювання органів дихання.
activated oxygen-containing metabolites, respiratory diseases.
Статья опубликована на с. 173-180
Введение
При инфекционно-воспалительных заболеваниях бронхолегочной системы в ответ на провоспалительные стимулы эпителиальные клетки респираторного тракта, активированные альвеолярные макрофаги и нейтрофилы продуцируют супероксид анион-радикал (O2–•) и монооксид азота (NO), которые обладают мощными бактерицидными свойствами и являются важнейшими компонентами неспецифической противоинфекционной защиты человеческого организма [13, 41]. Активированные кислородсодержащие (АКМ) и азотсодержащие метаболиты (ААК) образуются в организме в результате нескольких химических реакций (табл. 1).
Общая характеристика активированных кислородсодержащих метаболитов
Считают, что в организме человека 2–5 % поглощенного кислорода превращается в АКМ. Активированные кислородсодержащие метаболиты — это свободные радикалы, у которых на внешней электронной оболочке находится неспаренный электрон. Основными представителями АКМ являются: радикальные супероксид анион-радикал (O2–•), гидроксильный (OH•) и гидропероксидный (HO2•) радикалы, карбонатный радикал (CO2•), RO2•, RO• и нерадикальные дериваты кислорода — перекись водорода (H2O2), синглетный кислород (1О2), озон (O3). Средняя концентрация АКМ в тканях человека в физиологических условиях составляет 10–8 ммоль. У млекопитающих основными генераторами АКМ являются фагоцитирующие клетки: гранулоциты, моноциты, макрофаги, нейтрофилы, эозинофилы. Мембраны фагоцитов содержат ферментативный комплекс — никотинамидадениндинуклеотидфосфат (НАДФН)-оксидазу. В фагоцитах активация комплекса НАДФН-оксидазы сопровождается развитием «окислительного взрыва» — избыточного образования O2–• [3, 39, 43]. Во время респираторного взрыва профессиональные фагоциты могут высвободить от 3 до 4 нмоль АКМ на каждый миллион клеток в минуту. Большая часть образованной и высвобожденной во внеклеточное пространство H2O2 диффундирует через плазматические мембраны в клетку [17]. Основными генераторами H2O2 в респираторном тракте являются фагоциты и эпителиоциты (табл. 2).
Активированные кислородсодержащие метаболиты являются важнейшими компонентами неспецифической защиты от инфекционных агентов. Концентрация АКМ во внутреннем пространстве фагосом достигает высокого уровня: супероксидного анион-радикала — 30 мкмоль, перекиси водорода при отсутствии миелопероксидазы — более 100 мкмоль [17]. Показано, что уровень содержания АКМ, в частности H2O2, в конденсате выдыхаемого воздуха у пациентов с острыми инфекционно-воспалительными заболеваниями респираторного тракта значительно выше, чем у здоровых людей [29]. Исследования содержания H2O2 в конденсате выдыхаемого воздуха у людей как в состоянии здоровья, так и при различных заболеваниях позволили установить, что хроническое воспаление и гипоксические состояния сопровождаются повышением концентрации H2O2 в выдыхаемом воздухе (табл. 3). Так, у больных бронхиальной астмой концентрация Н2О2 в конденсате выдыхаемого воздуха может быть в 6 раз, а у пациентов с хронической обструктивной болезнью легких (ХОБЛ) — в 20 раз выше, чем у здоровых людей [16, 23].
Длительное течение воспалительного процесса может привести к снижению количества реснитчатых клеток и, как следствие, дефициту бактерицидной активности бронхиального секрета. Превышение внутриклеточной концентрации Н2О2 уровня в 10 мкмоль/л токсично для эпителиоцитов [31].
Нарушение окислительно-восстановительного равновесия, обусловленное генерацией АКМ, активирует множество АКМ-сенситивных внутриклеточных сигнальных путей, которые индуцируют продукцию провоспалительных и апоптотических медиаторов, играющих ключевую роль в защите организма. Помимо активации фагоцитирующих клеток основными причинами, которые могут привести к значимому увеличению генерации АКМ, являются: нарушение транспорта электронов в электронтранспортной цепи митохондрий; индукция гиперметаболизма; возбуждение системы ксантин-ксантиноксидазы; увеличение пула ионов металлов с переменной валентностью. Высокий уровень концентрации АКМ обусловливает окисление липидов, белков и нуклеиновых кислот, лишая их первичной физиологической активности, и деградация молекул-мишеней. АКМ, вступая во взаимодействие с протеинами, липидами, нуклеиновыми кислотами клетки, инициируют вторичные свободнорадикальные реакции. Агрессивное действие АКМ может лежать в основе ускорения процесса старения и развития сердечно-сосудистых, аутоиммунных и других заболеваний [2, 11, 12, 15, 26].
Генераторы АКМ
Краткая характеристика НАДФН-оксидазы и других представителей семейства NOX
В клетке основным источником электронов является электронтранспортная цепь митохондрий (табл. 4).
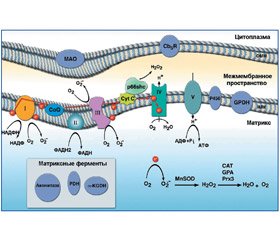
В связи с этим основное количество O2–• образуется в митохондриях (рис. 1) [8, 36].
В электронтранспортной цепи митохондрий, кроме 4-электронного восстановления О2 до Н2О, происходит и 1-, 2-, 3-электронное восстановление с образованием АКМ (рис. 2) [3, 6].
Генерация O2–• в организме человека также осуществляется ксантиноксидазой, ксантиндегидрогеназой, альдегидоксидазой, микросомальными монооксигеназами, цитохромом P450, тираминазой, липооксигеназой, циклооксигеназой и др. В настоящее время известно более 1000 ферментов класса оксидаз и оксигеназ и около 1200 генов, кодирующих их структуру. Донорами электронов являются ионы металлов с переменной валентностью, преимущественно Fe2+, а также Cu2+, которые включены в каталитический центр молекул ферментов. Из рецепторассоциированных генераторов O2–• определяющим ферментом является НАДФН-оксидаза, которая окисляет НАДФН до НАДФ+ за счет восстановления O2 до супероксид аниона-радикала: НАДФН + 2O2 НАДФ+ + 2O2–•. В отличие от других оксидоредуктаз НАДФН-оксидаза является «профессиональным» продуцентом АКМ [3, 4, 30, 34].
/177/177.jpg)
Мультикомпонентный флавожелезопротеид — НАДФН-оксидаза — терминальный ферментный электронный акцептор внутриклеточной электронтранспортной цепи митохондрий. Молекула НАДФН-оксидазы состоит из шести гетеросубъединиц, которые в неактивном состоянии пространственно разобщены во внутриклеточном континууме клетки (табл. 5) [22].
Такие субъединицы НАДФН-оксидазы, как большой гликопротеин gp91phox и маленький протеин p22phox, связаны с цитоплазматической мембраной клетки, а p67phox, p47phox, p40phox и представитель семейства Rho малых ГТФаз (Rac1 или Rac2) расположены в цитоплазме клетки [14, 35].
Две протеиновые мембраносвязанные оксидазные субъединицы НАДФН-оксидазы — gp91phox и p22phox — формируют гетеродимерный флавоцитохром b558 (Сytb558), который составляет каталитическое ядро фермента (рис. 3) и в отсутствие других цитоплазматических субъединиц НАДФН-оксидазы, играющих преимущественно регулирующую роль, пребывает в состоянии покоя [14, 21, 42].
Протеины Rac семейства Rho малых ГТФаз представляют собой молекулярные «выключатели», которые регулируют разнообразные внутриклеточные сигнальные пути, активирующие адгезию, фагоцитоз, цикличность жизни клетки, обеспечивающие взаимодействие мембранных рецепторов и цитоскелета клетки. В неактивном состоянии Rac находятся в тесной ассоциации с протеином RhoGDI. Активация Rac играет ключевую роль в процессе фагоцитоза и влияет на процесс активации киназ, участвующих в фосфорилировании компонентов НАДФН-оксидазы [20, 21].
В течение последнего десятилетия было продемонстрировано, что НАДФH-оксидазная активность характерна и для нефагоцитирующих клеток. Исследования данного феномена привело к открытию различных изоформ НАДФH-оксидазы, которые были объединены в семейство ферментов NOX. Семейство NOX представляют гомологические формы субъединицы gp91phox, физиологической функцией которых является генерация супероксид аниона-радикала [28, 38]. Семейство NOX включает в себя семь ферментов — NOXL, NOX2 (gp91phox), NOX3, NOX4, NOX5, DUOX1, и DUOX2. Молекулярная структура всех представителей семейства NOX состоит из 6 трансмембранных областей с двумя железосвязывающими регионами и длинного цитоплазматического C-терминального домена, который содержит флавинаденина динуклеотид (ФАД)- и НАДФ-связывающие регионы. Протеины NOX5, DUOX1 и DUOX2 отличаются удлиненным N-терминальным доменом и наличием внутриклеточных EF-рука-Ca2+-связывающих доменов (рис. 4) [9, 30].
Для ферментов семейства NOX характерна тканеспецифическая экспрессия. NOX1 преимущественно экспрессируется в толстой кишке и обнаруживается в эпителиоцитах респираторного тракта, в тканях матки и простаты; NOX2 (gp91phox) — в нейтрофилах, моноцитах, макрофагах, эозинофилах; NOX3 — исключительно в кортиевом органе, спиральных ганглиях внутреннего уха, эндотелиоцитах; NOX4 — в тканях почки, сердца, поджелудочной железы, поперечнополосатых и гладких мышцах, яичнике, яичках, эндотелии, остеокластах, фибробластах, астроцитах; NOX5 — в лимфоидных тканях и яичке, преимущественно в сперматоцитах; DUOX1 — в ткани щитовидной железы и в эпителии респираторного тракта, DUOX2 — в ткани щитовидной железы и в эпителии респираторного и пищеварительного тракта [25, 27]. Представители семейства NOX локализованы в различных компартментах клетки. Так, NOX1 находится в кавеолиновых ямках клеточной мембраны, NOX2 — в мембранных участках, формирующих фагосому, и на ламеллиподии.
Также NOX1 и NOX2 локализуются на мембранах «редоксом» — эндосом, ответственных за раннюю рецепторопосредованную сигнализацию в нефагоцитирующих клетках. Внутриклеточная локализация протеина NOX3 изучена недостаточно, он преимущественно связан с цитоплазматической мембраной. NOX4 идентифицируется на мембранах ядра и эндоплазматического ретикулума, где он взаимодействует с киназами и фосфатазами. NOX5 находится на внутренних мембранах клетки, DUOX1/2 — на цитоплазматической мембране клетки [9]. В отличие от NOX2 фагоцитирующих клеток другие изоформы NOX нефагоцитирующих клеток не ограничиваются локализацией на клеточной мембране [7]. Уровень экспрессии DUOX1 и DUOX2 эпителиоцитами респираторного тракта в 1000 раз выше, чем других изоформ NOX [37]. Краткая функциональная характеристика представителей семейства NOX представлена в табл. 6.
1. Абатуров А.Е. Активированные кислородсодержащие метаболиты — компоненты системы неспецифической защиты респираторного тракта // Здоровье ребенка. — 2009. — № 2 (17). — С. 120-125.
2. Барабой В.А. Стресс: природа, биологическая роль, механизмы, исходы. — К., 2006. — 424 с.
3. Донцов В.И. Активные формы кислорода как система: значение в физиологии, патологии и естественном старении / В.И. Донцов, В.Н. Крутько, Б.М. Мрикаев, С.В. Уханов // Труды ИСА РАН. — 2006. — Т. 19. — С. 51-69.
4. Ляхович В.В. Активированные кислородные метаболиты в монооксидазных реакциях / В.В. Ляхович, В.А. Вавилин, Н.К. Зенков, Е.Б. Меньщикова // Бюллетень СО РАМН. — 2005. — № 4 (118). — С. 7-12.
5. Apel K. Reactive oxygen species: metabolism, oxidative stress, and signal transduction / K. Apel, H. Hirt // Annu Rev. Plant Biol. 2004; 55: 373-99. doi: 10.1146/annurev.arplant.55.031903.141701.
6. Bartz R.R. Clinical review: oxygen as a signaling molecule / R.R. Bartz, C.A. Piantadosi // Crit. Care. 2010; 14(5): 234. doi: 10.1186/cc9185.
7. Bedard K. NOX family NADPH oxidases: not just in mammals / K. Bedard, B. Lardy, K.H. Krause // Biochimie. 2007 Sep; 89(9): 1107-12. doi:10.1016/j.biochi.2007.01.012.
8. Brand M.D. The sites and topology of mitochondrial superoxide production // Exp. Gerontol. 2010 Aug; 45(7–8): 466-72. doi: 10.1016/j.exger.2010.01.003.
9. Brown D.I. Nox proteins in signal transduction / D.I. Brown, K.K. Griendling // Free Radic. Biol. Med. 2009 Nov 1; 47(9): 1239-53. doi: 10.1016/j.freeradbiomed.2009.07.023.
10. Buettner G.R. Superoxide dismutase in redox biology: the roles of superoxide and hydrogen peroxide // Anticancer Agents Med. Chem. 2011 May 1; 11(4): 341-6. PMCID: PMC3131414.
11. Cadet J. Measurement of oxidatively generated base damage in cellular DNA / J. Cadet, T. Douki, J.L. Ravanat // Mutat. Res. 2011 Jun 3; 711(1–2): 3-12. doi: 10.1016/j.mrfmmm.2011.02.004.
12. Cadet J. Oxidatively generated base damage to cellular DNA / J. Cadet, T. Douki, J.L. Ravanat // Free Radic. Biol. Med. 2010 Jul 1; 49(1): 9-21. doi: 10.1016/j.freeradbiomed.2010.03.025.
13. Cathcart M.K. Regulation of Superoxide Anion Production by NADPH Oxidase in Monocytes/Macrophages // Arterioscler. Thromb. Vasc. Biol. 2004 Jan; 24(1): 23-8. doi: 10.1161/01.ATV.0000097769.47306.12.
14. Clark R.A. Mechanisms of Activation of NADPH Oxidases / R.A. Clark, T.K. Epperson, A.J. Valente // Jpn J. Infect. Dis. 2004 Oct; 57(5): S22-3.
15. Comhair S.A. Antioxidant responses to oxidant-mediated lung diseases / S.A. Comhair, S.C. Erzurum // Am. J. Physiol. Lung Cell. Mol. Physiol. 2002 Aug; 283(2): L246-55. doi: 10.1152/ajplung.00491.2001.
16. Dekhuijzen P.N. The role for N-acetylcysteine in the management of COPD / P.N. Dekhuijzen, W.J. van Beurden // Int. J. Chron. Obstruct. Pulmon. Dis. 2006; 1(2): 99-106. PMCID: PMC2706612.
17. Fang F.C. Antimicrobial actions of reactive oxygen species // MBio. 2011 Sep 6; 2(5). pii: e00141-11. doi: 10.1128/mBio.00141-11.
18. Finkel T. Signal transduction by reactive oxygen species // J. Cell Biol. 2011 Jul 11; 194(1): 7-15. doi: 10.1083/jcb.201102095.
19. Fischer H. Mechanisms and function of DUOX in epithelia of the lung // Antioxid. Redox Signal. 2009 Oct; 11(10): 2453-65. doi: 10.1089/ARS.2009.2558.
20. Groemping Y. Activation and assembly of the NADPH oxidase: a structural perspective / Y. Groemping, K. Rittinger // Biochem. J. 2005 Mar 15; 386 (Pt 3): 401-16. PMCID: PMC1134858
21. Hordijk P.L. Regulation of NADPH Oxidases: The Role of Rac Proteins // Circ. Res. 2006 Mar 3; 98(4): 453-62. doi: 10.1161/01.RES.0000204727.46710.5e.
22. Jiang J. TGF-2 reduces nitric oxide synthase mRNA through a ROCK-dependent pathway in airway epithelial cells / J. Jiang, S.C. George // Am. J. Physiol. Lung Cell. Mol. Physiol. 2011 Sep; 301(3): L361-7. doi: 10.1152/ajplung.00464.2010.
23. Jobsis Q. Hydrogen peroxide in exhaled air of healthy children: reference values / Q. Jobsis, H.C. Raatgeep, S.L. Schellekens, W.C. Hop, P.W. Hermans, J.C. de Jongste // Eur. Respir. J. 1998 Aug; 12(2): 483-5. PMID: 9727806.
24. Kanta J. The role of hydrogen peroxide and other reactive oxygen species in wound healing // Acta Medica (Hradec Kralove). 2011; 54(3): 97-101. PMID: 22250477.
25. Katsuyama M. NOX/NADPH oxidase, the superoxide-generating enzyme: its transcriptional regulation and physiological roles // J. Pharmacol. Sci. 2010; 114(2): 134-46. doi: http://dx.doi.org/10.1254/jphs.10R01CR.
26. Kottová M. Oxidative stress and its role in respiratory diseases / M. Kottová, J. Pourová, M. Voprsalová // Ceska Slov. Farm. 2007 Oct; 56(5): 215-9.
27. Lambeth J.D. Nox enzymes, ROS, and chronic disease: an example of antagonistic pleiotropy // Free Radic. Biol. Med. 2007 Aug 1; 43(3): 332-47. doi: 10.1016/j.freeradbiomed.2007.03.027
28. Lambeth J.D. Novel homologs of gp91phox / J.D. Lambeth, G. Cheng, R.S. Arnold, W.A. Edens // Trends Biochem. Sci. 2000 Oct; 25(10): 459-61. DOI: http://dx.doi.org/10.1016/S0968-0004(00)01658-3
29. Lang J.D. Oxidant-Antioxidant Balance in Acute Lung Injury / J.D. Lang, P.J. McArdle, P.J. O’Reilly, S. Matalon // Chest. 2002 Dec; 122 (6 Suppl.): 314S-320S. doi:10.1378/chest.122.6_suppl.314S
30. Lassègue B. NADPH oxidases: functions and pathologies in the vasculature / B. Lassègue, K.K. Griendling // Arterioscler. Thromb. Vasc. Biol. 2010 Apr; 30(4): 653-61. doi: 10.1161/ATVBAHA.108.181610.
31. Martin T.R. Recognition of bacterial endotoxin in the lungs // Am. J. Respir. Cell Mol. Biol. 2000 Aug; 23(2): 128-32. doi: 10.1165/ajrcmb.23.2.f189.
32. Migdal C. Espèces réactives de l’oxygène et stress oxidant / C. Migdal, M. Serres // Med. Sci. (Paris). 2011 Apr; 27(4): 405-12. doi: 10.1051/medsci/2011274017.
33. Nagaraja C. Hydrogen peroxide in exhaled breath condensate: A clinical study / C. Nagaraja, B.L. Shashibhushan, Sagar, M. Asif, P.H. Manjunath // Lung India. 2012 Apr; 29(2): 123-7. doi: 10.4103/0970-2113.95303.
34. Petry A. Receptor activation of NADPH oxidases / A. Petry, M. Weitnauer, A. Görlach // Antioxid. Redox Signal. 2010 Aug 15; 13(4): 467-87. doi: 10.1089/ars.2009.3026.
35. Rhee S.G. Cellular Regulation by Hydrogen Peroxide / S.G. Rhee, T.-S. Chang, Y.S. Bae, S.-R. Lee, S.W. Kang // J. Am. Soc. Nephrol. 2003 Aug; 14(8, Suppl. 3): S211-5. doi: 10.1097/01.ASN.0000077404.45564.7E.
36. Rigoulet M. Mitochondrial ROS generation and its regulation: mechanisms involved in H(2)O(2) signaling / M. Rigoulet, E.D. Yoboue, A. Devin // Antioxid. Redox Signal. 2011 Feb 1; 14(3): 459-68. doi: 10.1089/ars.2010.3363.
37. Schwarzer C. NADPH oxidase-dependent acid production in airway epithelial cells / C. Schwarzer, T.E. Machen, B. Illek, H. Fischer // J. Biol. Chem. 2004 Aug 27; 279(35): 36454-61. doi: 10.1074/jbc.M404983200
38. Shiose A. A novel superoxide-producing NAD(P)H oxidase in kidney / A. Shiose, J. Kuroda, K. Tsuruya, M. Hirai, H. Hirakata, S. Naito, M. Hattori, Y. Sakaki, H. Sumirnoto // J. Biol. Chem. 2001 Jan 12; 276(2): 1417-23. doi: 10.1074/jbc.M007597200.
39. Skólmowska M. Enzymosomy antyoksydacyjne — właściwości i zastosowanie / M. Skólmowska, M. Kmieć // Postepy Hig. Med. Dosw. (online). — 2011. — T. 65. — S. 640-644.
40. Van der Vliet A. NADPH oxidases in lung biology and pathology: host defense enzymes, and more // Free Radic. Biol. Med. 2008 Mar 15; 44(6): 938-55. doi: 10.1016/j.freeradbiomed.2007.11.016..
41. Van der Vliet A. Oxidants, nitrosants and the lung / A. Van der Vliet, C. E. Cross // Am. J. Med. 2000 Oct 1; 109(5): 398-421. doi: http://dx.doi.org/10.1016/S0002-9343(00)00479-4.
42. Werner E. GTPases and reactive oxygen species: switches for killing and signaling // J. Cell. Sci. 2004 Jan 15; 117(Pt 2): 143-53. doi: 10.1242/jcs.00937.
43. Zabłocka A. Dwa oblicza wolnych rodników tlenowych / A. Zabłocka, M. Janusz // Postepy Hig. Med. Dosw. (Online). — 2008. — T. 62. — S. 118-124.

/174/174.jpg)
/175/175.jpg)
/176/176.jpg)
/176/176_2.jpg)
/177/177_2.jpg)
/178/178.jpg)
/178/178_2.jpg)