Журнал «Здоровье ребенка» 2 (61) 2015
Вернуться к номеру
Кольцевидная поджелудочная железа, ассоциированная с TORCH-инфекцией
Авторы: Веселый С.В., Климанский Р.П., Латышов К.В. — Донецкий национальный медицинский университет им. М. Горького, г. Красный Лиман
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В статье приведены данные наблюдения за новорожденным ребенком с врожденным пороком развития желудочно-кишечного тракта (кольцевидная поджелудочная железа), недоношенностью III степени на фоне персистирующей цитомегаловирусной и токсоплазменной инфекции. Произведена успешная оперативная коррекция порока развития желудочно-кишечного тракта. Наблюдение в катамнезе — благоприятный исход.
У статті наведені дані спостереження за новонародженою дитиною з уродженими вадами розвитку шлунково-кишкового тракту (кільцеподібна підшлункова залоза), недоношеністю III ступеня на тлі персистуючої цитомегаловірусної та токсоплазмової інфекції. Проведена успішна оперативна корекція вади розвитку шлунково-кишкового тракту. Спостереження в катамнезі — сприятливий результат.
The article presents follow-up in a newborn child with a congenital malformation of the gastrointestinal tract (annular pancreas), III degree prematurity against the background of persistent cytomegalovirus and toxoplasmosis infections. A successful surgical correction of malformation of the gastrointestinal tract has been made. Follow-up observation has shown a favorable outcome.
TORCH-инфекции, кольцевидная поджелудочная железа, дети.
TORCH-інфекції, кільцеподібна підшлункова залоза, діти.
TORCH-infections, annular pancreas, children.
Статья опубликована на с. 193-195
В 1971 г. из множества инфекционных заболеваний была выделена группа вирусных, бактериальных и других инфекций. Эти возбудители, обладая значительным разнообразием структурных и биологических свойств, вызывают при внутриутробном заражении у детей сходные клинические проявления, а впоследствии и стойкие структурные дефекты различных органов и систем. Для обозначения инфекций этой группы была предложена аббревиатура TORCH-комплекс [1].
Наиболее значимыми представителями TORCH-комплекса являются цитомегаловирусная инфекция (ЦМВИ). Клинически выраженные формы ЦМВИ могут вызывать тяжелую патологию, вплоть до гибели ребенка [2]. Даже при бессимптомных формах у 5–15 % детей в ближайшие 1–2 года и в более поздние сроки жизни регистрируются нарушения центральной нервной системы (ЦНС), слуха, зрения, детский церебральный паралич, отставание в умственном развитии [3]. Вероятность инфицирования плода при латентном течении процесса практически отсутствует, при реактивации и персистенции составляет 0,5–7 %, а при первичном инфицировании — до 40 % [4].
Возбудитель токсоплазмоза (Toxoplasma gondii) относится к типу простейших, является внутриклеточным паразитом и имеет сложный цикл развития. При заражении матери во время беременности возможна трансплацентарная передача инфекции плоду. Число случаев врожденного токсоплазмоза колеблется от 1 на 1000 до 1 на 10 000 живорожденных. В то же время токсоплазмоз может передаваться через кровь [5].
Риск заражения и его исход зависят от срока беременности в момент заражения. Вероятность трансплацентарной передачи токсоплазмы плоду при заражении до 8 недель беременности составляет 17 %. Поражение плода на ранних сроках гестации чаще всего заканчивается его внутриутробной гибелью или приводит к возникновению серьезных аномалий развития. Это связано с тем, что иммунная система плода еще не развита и не способна формировать иммунный ответ. Вероятность инфицирования плода при заражении беременной в сроки беременности 8–18 недель составляет 25 % и приводит к патологии развития внутренних органов и головного мозга. При заражении в более поздние сроки вероятность трансплацентарной передачи токсоплазмы возрастает до 65 % — при заражении в сроки гестации 18–24 недели и до 80 % — при заражении после 24-й недели беременности. Такой высокий риск инфицирования плода связан с большей проницаемостью плаценты на поздних сроках гестационного периода. Инфицирование в поздние сроки внутриутробного периода приводит к развитию менее выраженных патологий плода и новорожденного, что связано с развитием у плода иммунной системы и формированием собственного иммунного ответа [6].
Врожденные пороки пищеварительной системы встречаются с частотой 3,4 случая на 100 перинатальных аутопсий и составляют 21,7 % всех аномалий развития в этот период [7, 8]. При некоторых пороках, которые формируются очень рано, в период органогенеза, непроходимость развивается еще внутриутробно, и ребенок рождается с симптомами кишечной непроходимости. Ряд авторов ассоциируют патологический органогенез кишечной трубки с TORCH-инфекцией [9–11].
Приводим клиническое наблюдение.
Больная С., родилась 10.01.2014 г. от 4-й беременности, протекавшей на фоне токсикоза беременных, угрозы прерывания в 16 недель. Вторая половина беременности протекала с угрозой преждевременных родов в 29–30 недель. Диагностированы миома матки, полипы цервикального канала. Роды II, плод в ягодичном предлежании, оценка по шкале Апгар 5–6 баллов. Масса при рождении 1350 г, рост — 42 см. Состояние при рождении тяжелое. В 1-е сутки в роддоме появились беспокойство, застойная рвота содержимым желудка и двенадцатиперстной кишки. Ребенок консультирован детским хирургом, заподозрена аномалия развития желудочно-кишечного тракта с проявлениями высокой кишечной непроходимости. По линии санавиации ребенок доставлен в отделение интенсивной терапии новорожденных областной детской клинической больницы (ОДКБ) г. Донецка.
При поступлении состояние ребенка тяжелое. Рефлексы периода новорожденности угнетены. Кожные покровы и видимые слизистые чистые, выражена бледность и сухость кожных покровов. Тургор и эластичность тканей снижены. Подкожная клетчатка развита умеренно. Периферические лимфатические узлы не увеличены. Большой родничок 2,5 х 2,5 см, не напряжен. Малый родничок 1 х 1 см. Носовое дыхание свободное. В легких аускультативно дыхание ослабленное. Частота дыхательных движений 42/мин. Тоны сердца ритмичные, глухие. Частота сердечных сокращений 152 уд/мин. Границы сердца в пределах нормы. Живот ладьевидной формы, асимметричный за счет контурации желудка на передней брюшной стенке, не участвует в акте дыхания. При пальпации живот мягкий, акт пальпации вызывает беспокойство у ребенка. Печень +3,5 см, селезенка и почки не увеличены. Перистальтика не выслушивается. Патологические образования не пальпируются. Стул скудный, мочеиспускание не нарушено.
На обзорной рентгенограмме органов брюшной полости (рис. 1) определяются два горизонтальных уровня в эпигастральной области, скудная пневматизация кишечника.
/97/97.jpg)
В анализе крови — анемия легкой степени. Ультразвуковое исследование органов брюшной полости: сонографические признаки умеренного увеличения печени. Эхокардиография: врожденный порок сердца (дефект межпредсердной перегородки, открытый артериальный проток). Консультация невролога: перинатальное гипоксически-ишемическое поражение ЦНС, синдром церебрального угнетения.
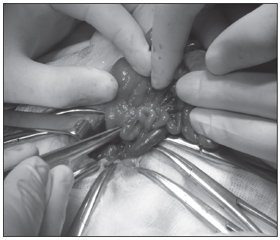
На основании клинических и рентгенологических данных диагностирована частичная врожденная высокая кишечная непроходимость. После проведения предоперационной подготовки 11.01.2014 г. произведено оперативное лечение. Верхнесрединная лапаротомия. При ревизии двенадцатиперстной кишки обнаружено, что последнюю кольцевидно огибает и деформирует поджелудочная железа (рис. 2). Попытка интубации двенадцатиперстной кишки орогастральным зондом безуспешна. С учетом компрессии двенадцатиперстной кишки кольцевидной поджелудочной железой и ее деформации произведено наложение обходного дуоденоеюноанастомоза.
/98/98.jpg)
Во время проведения оперативного лечения для определения ДНК вирусов TORCH-инфекции (полимеразная цепная реакция) взят биоматериал — содержимое просвета двенадцатиперстной кишки.
Диагноз после операции: множественные врожденные пороки развития. Частичная врожденная высокая кишечная непроходимость на почве кольцевидной поджелудочной железы. Дефект межпредсердной перегородки, открытый артериальный проток. Внутриутробная инфекция.
Результат проведенного исследования биологического материала, изъятого во время операции: выявлены ДНК цитомегаловируса и токсоплазмы. Таким образом, диагноз TORCH-инфекции подтвержден.
Послеоперационный период протекал тяжело. Больная получала инфузионную, дезагрегантную, ноотропную, антибактериальную, противовирусную и симптоматическую терапию. Рана зажила первичным натяжением. После набора веса 2500 г выписана в удовлетворительном состоянии на амбулаторное лечение. Рекомендовано наблюдение иммунолога, детского хирурга, кардиохирурга, проведение противовирусной терапии в течение 1 месяца. Осмотрена через 2 месяца после операции. Растет и развивается без особенностей, за истекшее время однократно перенесла острое респираторное заболевание без осложнений. Физическое и психомоторное развитие удовлетворительное.
Данное клиническое наблюдение является показательным с точки зрения ассоциативных связей TORCH-инфекции и врожденных пороков развития желудочно-кишечного тракта.
1. Сухих Г.Т. Иммунология беременности. — М.: РАМН, 2003.
2. Kenneson A., Cannon M.J. Review and metaanalysis of the epidemiology of congenital cytomegalovirus (CMV) infection // Rev. Med. Virol. — 2007. — № 17(4). — Р. 253–276.
3. Michaels M.G. Treatment of congenital cytomegalovirus: where are we now? // Expert. Rev. Anti. Infect. Ther. — 2007. — № 5(3). — Р. 441–448.
4. Цитомегаловирусная инфекция у детей раннего возраста (клиника, диагностика, современные возможности терапии): Руководство для врачей / Н.А. Коровина, А.Л. Заплатникова, А.В. Чебуркин, И.Н. Захарова. — М.: Медпрактика, 2001. — 64 с.
5. Gross U., Carsten G., Luder K. et al. Comparative Immunoglobulin G antibody profiles between mother and child for early diagnosis of congenital toxoplasmosis // J. Clin. Microbiol. — 2000. — № 38(10). — Р. 3619–3622.
6. Nielsen H.V., Schmidt D.R. Diagnosis of congenital toxoplasmosis by two-dimensional immunoblot differentiation of mother and child immunoglobulin G profiles // J. Clin. Microbiol. — 2005. — № 43(2). — Р. 711–715.
7. Москаленко В.З., Грона В.М., Веселий С.В. та ін. Природжені вади розвитку травного тракту. — Севастополь: Вебер, 2003. — 103 с.
8. Тератология человека: руководство для врачей / Под ред. Г.И. Лазюка. — М., 1991. — 480 с.
9. Yamamoto A.Y., Mussi-Pinhata M.M., Cristina P. et al. Congenital cytomegalovirus infection in preterm and full-term newborn infants from a population with a high seroprevalence rate // Pediatr. Infect. Dis. J. — 2001. — № 20(2). — Р. 188–192.
10. Нисевич Л.Л., Каск Л.Н., Адиева А.А., Кущ А.А. Перинатальные факторы риска инфицирования плода, патологии и смерти в перинатальном и младенческом возрасте // Вопр. акушерства, гинекологии и перинаталогии. — 2007. — № 6(4). — Р. 13–17.
11. Полетаев А.Б. Инфекции матери как причина патологии плода и новорожденного // Аллергология и иммунология. — 2001. — № 2(1). — Р. 110–116.