Журнал «Здоровье ребенка» 3 (63) 2015
Вернуться к номеру
Особливості гуморальної ланки імунної відповіді школярів, хворих на бронхіальну астму раннього початку, залежно від ацетиляторного поліморфізму
Авторы: Марусик У.І. — Буковинський державний медичний університет, м. Чернівці
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Метою роботи було оцінити окремі показники гуморальної ланки імунної системи в дітей шкільного віку, хворих на бронхіальну астму раннього початку, з урахуванням ацетиляторних фенотипів для покращення результатів лікування. Проведене комплексне обстеження 34 дітей шкільного віку, які хворіють на БА раннього початку (захворювання вперше проявлялось в ранньому віці). За перебігом захворювання хворих розподіляли на дві клінічні групи. До першої клінічної групи увійшли 16 пацієнтів, у яких визначали повільний тип ацетилювання (середній уміст ацетильованого сульфадимезину в сечі становив менше 75,0 %). Другу клінічну групу сформували 18 школярів, у яких відмічався швидкий тип ацетилювання (середній уміст ацетильованого сульфадимезину в сечі становив понад 75,0 %). Усім дітям проводили імунологічне дослідження крові ІІ–ІІІ рівнів. У результаті проведених досліджень встановлено, що наявність повільного типу ацетилювання в пацієнтів із бронхіальною астмою раннього початку підвищує ризик зниження вмісту інтерлейкіну-8 у сироватці крові до < 5,3 пг/мл з відношенням шансів (ВШ) 4,5 (95% довірчий інтервал: 2,3–8,9) та ризик реєстрації збільшеної концентрації ІЛ-4 понад 4,0 пг/мл (ВШ = 1,9), що пов’язано з атопічним запальним процесом в організмі та дозволяє персоналізувати лікувальну тактику в даних пацієнтів.
Целью работы было оценить отдельные показатели гуморального звена иммунной системы у детей школьного возраста, больных бронхиальной астмой раннего начала, с учетом ацетиляторных фенотипов для улучшения результатов лечения. Проведено комплексное обследование 34 детей школьного возраста, страдающих БА раннего начала (заболевание впервые проявлялось в раннем возрасте). По течению заболевания больных распределяли на две клинические группы. В первую клиническую группу вошли 16 пациентов, у которых определяли медленный тип ацетилирования (среднее содержание ацетилированного сульфадимезина в моче составляло менее 75,0 %). Вторую клиническую группу сформировали 18 школьников, у которых отмечался быстрый тип ацетилирования (среднее содержание ацетилированного сульфадимезина в моче составляло более 75,0 %). Всем детям проводили иммунологическое исследование крови II–III уровней. В результате проведенных исследований установлено, что наличие медленного типа ацетилирования у пациентов с бронхиальной астмой раннего начала повышает риск снижения содержания интерлейкина-8 в сыворотке крови до < 5,3 пг/мл при отношении шансов (ОШ) 4,5 (95% доверительный интервал: 2,3–8,9) и риск регистрации увеличенной концентрации ИЛ-4 более 4,0 пг/мл (ОШ = 1,9), что связано с атопическим воспалительным процессом организма и позволяет персонализировать лечебную тактику у данных пациентов.
The objective of the work was to study the individual indicators of the humoral immune system in school-age children with early-onset bronchial asthma (BA), considering acetylation phenotypes to improve treatment outcomes. There has been carried out a comprehensive examination of 34 school-age children with early-onset BA (disease first manifested at an early age). Depending on the course of the disease, patients were divided into two clinical groups. The first clinical group included 16 patients with slow acetylation (average content of acetylated sulfadimine in urine was less than 75.0 %). The second clinical group consisted of 18 pupils with fast acetylation (average level of acetylated sulfadimine in urine was over 75.0 %). All children underwent immunological blood test of II–III levels. The studies found that slow acetylation in patients with early-onset asthma increases the risk of reduction in the amount of interleukin-8 in blood serum < 5.3 pg/ml with odds ratio (OR) 4.5 (95% confident interval (CI): 2.3–8.9), as well as the risk of higher concentration of IL-4 more than 4.0 pg/ml (OR = 1.9) that is associated with atopic inflammation of the body and allows you to personalize treatment tactics in these patients.
бронхіальна астма, діти, ацетилювання, фенотипи, інтерлейкіни.
бронхиальная астма, дети, ацетилирование, фенотипы, интерлейкины.
bronchial asthma, children, acetylation, phenotypes, interleukins.
Статья опубликована на с. 22-25
Постановка проблеми й аналіз останніх досліджень
Попри багаторічні дослідження алергічних захворювань, що проводяться міжнародною спільнотою науковців, бронхіальна астма (БА) залишається актуальною медико-соціальною проблемою як в Україні, так і у світі, що зумовлено високою захворюваністю та смертністю, а також значними економічними витратами, пов’язаними з інвалідизацію хворих [1–3].
Згідно з даними епідеміологічних досліджень, від алергічних захворювань страждає до 25 % дітей і підлітків, тобто кожна четверта дитина, а від бронхіальної астми — кожна десята [4]. Відповідно до даних ВООЗ, поширеність бронхіальної астми серед дитячого населення становить 10 %. У різних регіонах України даний показник коливається від 5 до 9 % дитячої популяції [5]. Особливо гостро нині стоїть питання підвищення ефективності терапії даного захворювання та досягнення такого рівня контролю, що дозволяв би дитині вести активне соціальне життя.
На сьогодні відомо, що БА належить до мультифакторних захворювань, етіологія й патогенез яких визначаються складною взаємодією генетичних чинників і факторів навколишнього середовища [6]. Дослідження молекулярно-генетичних особливостей спадкової схильності бронхіальної астми, що широко проводяться останнім часом, зосереджені в основному на виявленні ролі окремих генів та кодованих ними ферментів у патогенезі розвитку даного захворювання, а також ефективності його терапії [7].
За даними літератури, саме поліморфізм генів, які кодують ферменти другої фази детоксикації ксенобіотиків, впливає на функціональність даних ферментів та підвищує генетичну схильність до окислювального стресу та БА [8].
Враховуючи дані літератури про асоціацію тяжкої бронхіальної астми з генетичним поліморфізмом N-ацетилтрансферази ферменту, що визначає особливість метаболічних процесів [9], ми вважали за доцільне оцінити особливості статусу гуморальної ланки імунітету в дітей, хворих на БА раннього початку, з урахуванням їх ацетиляторних фенотипів.
Мета дослідження: оцінити окремі показники гуморальної ланки імунної системи в дітей шкільного віку, хворих на бронхіальну астму раннього початку, з урахуванням ацетиляторних фенотипів для покращення результатів лікування.
Матеріал та методи дослідження
У пульмонологічному відділенні Обласної дитячої клінічної лікарні № 1 м. Чернівців у періоді ремісії комплексно обстежено 34 дитини шкільного віку, які хворіють на БА раннього початку (захворювання вперше проявлялось в ранньому віці). За перебігом захворювання хворих розподіляли на дві клінічні групи. До першої (І) клінічної групи увійшли 16 пацієнтів, у яких визначали повільний тип ацетилювання (середній вміст ацетильованого сульфадимезину в сечі становив менше 75,0 %). Другу (ІІ) клінічну групу сформували 18 школярів, у яких відмічався швидкий тип ацетилювання (середній вміст ацетильованого сульфадимезину в сечі становив понад 75,0 %). За основними клінічними ознаками групи були порівнянними.
Першу клінічну групу сформували 11 хлопчиків (68,7 %) та 5 дівчаток (31,3 %). До другої групи увійшло 13 хлопчиків (72,2 %, Pф > 0,05) та 5 дівчаток (27,8 %, Pф > 0,05). Середній вік хворих І групи становив 12,0 ± 0,7 року, а школярів ІІ групи — 11,4 ± 0,7 року (P > 0,05). До складу першої клінічної групи увійшли 50,0 % міських та сільських жителів. Другу групу сформували 12 осіб (66,6 %) — мешканців міст і міських поселень та 6 хворих (33,4 %, Pф > 0,05), які проживають у селах. Середній вік дебюту бронхіальної астми в дітей першої клінічної групи становив 3,6 ± 0,6 року, а у ІІ групі — 4,2 ± 0,4 року (P > 0,05).
Отже, за статтю, віком та місцем проживання клінічні групи порівняння вірогідно не відрізнялися.
Усім дітям проводили імунологічне дослідження крові ІІ–ІІІ рівнів. Уміст у сироватці крові імуноглобулінів класів A, G, M визначали методом радіальної імунодифузії за G. Mancini et al., а загального імуноглобуліну Е (IgЕ), інтерлейкіну-4 (ІЛ-4) та ІЛ-8 у сироватці крові — методом імуноферментного аналізу. Швидкість процесів ацетилювання досліджували за методом Пребстинг — Гаврилова в модифікації Тимофєєвої, зважаючи на те, що вона характеризувала особливості ІІ фази системи біотрансформації ксенобіотиків.
Статистичну обробку результатів дослідження здійснювали за допомогою методів варіаційної статистики, використовуючи статистичну програму StatSoft Statistica v. 5.0, та з позиції клінічної епідеміології з урахуванням абсолютного, відносного ризиків та відношення шансів (ВШ) із зазначенням 95% довірчого інтервалу (95% ДІ).
Результати дослідження та обговорення
Порівняльний аналіз показників гуморальної ланки імунітету в дітей із фенотипом БА раннього початку за різної активності N-ацетилтрансферази показав, що вміст ІЛ-8 в сироватці крові у хворих обох клінічних груп суттєво не відрізнявся, однак практично у три-чотири рази перевищував норму за даними виробника (2 пг/мл). Так, середній вміст IЛ-8 у сироватці крові осіб першої групи становив 6,8 ± 1,2 пг/мл та 8,7 ± 1,4 пг/мл (Р > 0,05) у пацієнтів, у яких реєструвався швидкий тип ацетилювання. Водночас майже в половини (42,8 %) дітей — «повільних ацетиляторів» відмічалося зниження рівня інтерлейкіну-8 у сироватці крові (менше ніж 5,3 пг/мл), тоді як у другій групі воно траплялося лише в 14,3 % випадків (Рф > 0,05). При цьому повільний тип ацетилювання в дітей, хворих на БА раннього початку, асоціювався зі зниженням концентрації інтерлейкіну-8 у сироватці крові (менше 5,3 пг/мл) відносно групи «швидких ацетиляторів» таким чином: відносний ризик — 1,8 (95% ДІ: 1,1–3,2), абсолютний ризик — 0,3 при відношенні шансів 4,5 (95% ДІ: 2,3–8,9).
Важливими індикаторами хронічного алергічного запалення при бронхіальній астмі є вміст IЛ-4, біологічний ефект якого пов’язаний із регуляцією синтезу імуноглобуліну Е та підтримкою еозинофільного запалення в респіраторному тракті [10]. Порівняльний аналіз вмісту даного цитокіну в сироватці крові школярів обох клінічних груп не виявив вірогідних відмінностей. Так, середня концентрація ІЛ-4 у сироватці крові дітей першої клінічної групи становила 8,8 ± 1,9 пг/мл, а в осіб другої групи — 8,5 ± 1,9 пг/мл (Р > 0,05). Попри відсутність вірогідних відмінностей у показниках середньої концентрації даного цитокіну в сироватці крові дітей із різними ацетиляторними фенотипами БА, практично в кожного другого пацієнта першої клінічної групи (44,4 %) реєструвався підвищений вміст ІЛ-4 (понад 4,0 пг/мл), тоді як у обстежених другої групи — лише у 28,6 % випадків (Рф > 0,05). Тенденція до підвищеного вмісту інтерлейкіну-4 у сироватці крові дітей, хворих на бронхіальну астму раннього початку із повільним типом ацетилювання, збігається з літературними даними, що відзначають чітку асоціацію між даним ацетиляторним фенотипом астми й атопічним запальним процесом організму [11, 12]. Водночас відмічено, що повільний тип ацетилювання в пацієнтів із фенотипом БА раннього початку практично удвічі збільшує ризик реєстрації підвищеної концентрації ІЛ-4 у сироватці крові відносно осіб другої групи. Зокрема, показник відношення шансів становить 1,9 (95% ДІ: 1,1–3,6).
Оскільки розвиток бронхіальної астми повсякчас асоціюється з вродженою, генетично детермінованою гіперпродукцією IgE [13], нами досліджено його вміст у сироватці крові обстежених дітей. Встановлено, що вміст загального IgE у сироватці крові у двох третин із обстежених нами хворих (77,8 %) перевищував популяційну норму здорових дітей (120 МО/мл), однак у пацієнтів першої клінічної групи він був дещо нижчим. Так, вміст імуноглобуліну E у сироватці крові школярів із повільним ацетиляторним фенотипом становив 515,2 МО/мл, а в осіб другої клінічної групи — 705,1 МО/мл (Р > 0,05). Проте концентрація IgE, що перевищувала 800,0 МО/мл, реєструвалась у 66,7 % дітей першої клінічної групи та лише у 44,4 % випадків — у другій (Р > 0,05) групі порівняння.
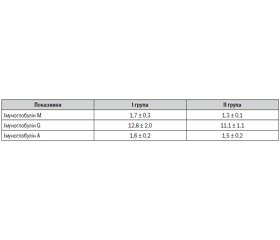
Згідно з даними літератури [14], Т-хелпери 2-го порядку активують перетворення загальних імуноглобулінів М та G в IgЕ, а вміст імуноглобуліну А опосередковано вказує на активність запального процесу в організмі. Виходячи з цього, проведено аналіз концентрації даних імуноглобулінів в сироватці крові, результати якого наведені в табл. 1.
Незважаючи на те, що між групами не виявлено вірогідної відмінності за рівнем IgМ у сироватці крові, його значення, що перевищували 1,7 мг/мл, реєструвались у кожної четвертої обстеженої дитини (25,0 %) першої групи на противагу 13,0 % осіб другої групи (Рф > 0,05).
Наявність повільного ацетиляторного фенотипу БА раннього початку асоціювалася з підвищенням до зазначеного вище рівня імуноглобуліну М сироватки крові таким чином: атрибутивний ризик — 0,2, відносний ризик — 1,4 (95% ДІ: 0,7–2,6) при відношенні шансів 2,2 (95% ДІ: 1,1–4,7).
Водночас у половини пацієнтів першої групи спостерігався підвищений вміст IgА у сироватці крові порівняно з дітьми зі швидким ацетиляторним фенотипом БА раннього початку. Так, концентрація імуноглобуліну А в сироватці крові вище 1,3 мг/мл визначалася у 58,3 % школярів із середнім вмістом ацетиляторного сульфадимезину в сечі менше 75 % та лише в 40,0 % осіб (Рф > 0,05) другої клінічної групи.
Отже, у більшості пацієнтів із повільним ацетиляторним фенотипом бронхіальної астми раннього початку відмічається підвищена концентрація імуноглобулінів G, М, А та ІЛ-4 у сироватці крові, що опосередковано свідчить про вираженість атопічного запального процесу в даної когорти осіб.
Висновки
1. Наявність повільного типу ацетилювання у пацієнтів із бронхіальною астмою раннього початку підвищує ризик зниження вмісту інтерлейкіну-8 у сироватці крові < 5,3 пг/мл із відношенням шансів 4,5 (95% ДІ: 2,3–8,9).
2. При повільному ацетиляторному фенотипі бронхіальної астми раннього початку зростає ризик реєстрації збільшеної концентрації ІЛ-4 понад 4,0 пг/мл (ВШ = 1,9), що пов’язано з атопічним запальним процесом організму та дозволяє персоналізувати лікувальну тактику в даних пацієнтів.
1. World Health Organization. Bronchial asthma. Fact Sheet NE 307. — Geneva: World Health Organization, 2008.
2. Kim H.Y. The many paths to asthma: phenotype shaped by innate and adaptive immunity / H.Y. Kim, R.H. DeKruyff, D.T. Umetsu // Nat. Immunol. — 2010. — Vol. 11 (7). — P. 577-584.
3. Yang I.V. Epigenetics and prenatal influences on asthma and allergic airway disease / I.V. Yang // Breath. — 2014. — Vol. 10, № 1. — P. 25-31.
4. Фактори ризику виникнення бронхіальної астми у дітей / В.П. Костроміна, О.О. Речкіна К. О. Мельник [та ін.] // Астма та алергія. — 2013. — № 2. — С. 21-24.
5. Гнатейко О.З. Деякі аспекти проблеми ранньої діагностики бронхіальної астми в дітей / О.З. Гнатейко, О.М. Садова // Здоровье ребенка. — 2009. — № 5 (20). — С. 34-38.
6. Полиморфизм ксенобиотиков метаболизма генов глутатион-S-трансферазы (GSTT1, GSTM1) и цитохрома P450 (CYP2E1 и CYP2C19) у пациентов с атопической бронхиальной астмой / Е.Ю. Брагина, М.Б. Фрейдин, И.А. Тен [и др.] // Бюллетень со РАМН. — 2005. — № 13. — С. 121-125.
7. Study on possible role of CYP1A1, GSTT1, GSTM1, GSTP1, NAT2 and ADRB2 genes polymorphisms in bronchial asthma development in children / P.F. Tatarskyy, N.G. Chumachenko, A.M. Kucherenko [at al.] // Biopolymers and Cell. — 2011. — Vol. 27. № 1. — С. 66-73.
8. Barta J. N-Acetyltransferases as markers for asthma and allergic / J. Barta, B. Ghosh // Atopic disorders current drug metabolism. — 2008. — Vol. 9, № 6. — Р. 546-553.
9. Ортеменка Є.П. Значимость показателей гиперреактивности дыхательных путей в диагностике эозинофильного фенотипа бронхиальной астмы у детей в зависимости от ацетиляторного полиморфизма / Є.П. Ортеменка // Межрегиональный сборник научных работ с международным участием (к 70-летию образования Ярославского медицинского института) [«Актуальные вопросы современной педиатрии»] / Под ред. В.И. Марушкова, И.М. Мельниковой, Ю.Л. Мизерницкого. — Ярославль: Аверс Плюс, 2014. — С. 192-195.
10. Golden M.P. Leukotrienes / M.P. Golden, W.R. Henderson // The New England Journal of Medicine. — 2009. — № 357. — P. 1841-1854.
11. Association between the N-acetylation genetic polymorphism and bronchial asthma / M. Nacak, A.S. Aynacioglu, A. Filiz [еt al.] // Br. J. Clin. Oharmacol. — 2002. — Vol. 54 (6). — P. 671-674.
12. Batra J. Arylamine N-acetyltransferase gene polymorphism: markers for atopic asthma, serum Ig E and blood eosinophil counts / J. Batra, S.K. Sharma, B. Ghosh // Molecular Biology. — 2009. — Vol. 43 (1). — P. 55-67.
13. IgE in childhood asthma: relevance of demographic characteristics and polysensitisation / M. Silvestri, A. Pistorio, E. Battistini [et al.] // Arch. Dis. Child. — 2010. — № 95. — P. 979-984.
14. Kim H. Asthma / H. Kim, J. Mazza // Allergy, Asthma and Clinical Immunology. — 2011. — Vol. 7, № 1. — P. 1102-1111.

/29/29.jpg)