Журнал «Здоровье ребенка» 3 (63) 2015
Вернуться к номеру
Небажані ефекти базисної терапії у дітей, хворих на алергічну бронхіальну астму
Авторы: Дудник В.М., Хромих К.В. — Вінницький національний медичний університет ім. М.І. Пирогова
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Мета роботи — визначити наявність небажаних ефектів базисної терапії у дітей, хворих на алергічну бронхіальну астму (БА).
Матеріали та методи. Обстежено 224 дитини з алергічною БА віком від 6 до 17 років із визначенням вмісту гомоцистеїну та судинного ендотеліального фактора росту, проведенням ультрасонографії сонної та плечової артерій на апараті Philips HD11 XE у В-режимі з кольоровим допплерівським картуванням потоків.
Результати. Порівнюючи показники вмісту гомоцистеїну та судинний ендотеліальний фактор росту у дітей, хворих на БА, залежно від наявності базисної протизапальної терапії (БПЗТ), нами було встановлено, що їх уміст вірогідно нижчий у дітей, які не отримували БПЗТ (р < 0,05). Лікування середніми та високими дозами інгаляційних глюкокортикоїдів є чинником ризику підвищення вмісту гомоцистеїну (ОR 1,504; 95% CI 1,141–7,519 та ОR 2,456; 95% CI 1,427–29,343 відповідно). Вміст судинного ендотеліального фактора росту вірогідно підвищується при застосуванні низьких (OR 1,385; 95% CI 1,117–4,602) та середніх (OR 2,462; 95% CI 1,200–30,275) доз інгаляційних глюкокортикоїдів. Потовщення комплексу інтими-медії понад 0,9 мм (OR 1,157; 95% CI 1,080–4,777) не мало дозозалежного ефекту.
Цель работы — определить наличие нежелательных эффектов базисной терапии у детей, больных аллергической бронхиальной астмой (БА).
Материалы и методы. Обследовано 224 ребенка с аллергической БА в возрасте от 6 до 17 лет с определением содержания гомоцистеина и сосудистого эндотелиального фактора роста, проведением ультрасонографии сонной и плечевой артерий на аппарате Philips HD11 XE, в В-режиме с цветным допплеровским картированием потоков.
Результаты. Сравнивая показатели содержания гомоцистеина и сосудистого эндотелиального фактора роста у детей, больных БА, в зависимости от наличия базисной терапии, мы установили, что их содержание достоверно ниже у детей, не получавших базисной терапии (р < 0,05). Определено, что лечение средними и высокими дозами ингаляционных глюкокортикоидов является фактором риска повышения содержания гомоцистеина (ОR 1, 504; 95% CI 1,141–7,519 и ОR 2,456; 95% CI 1,427–29,343 соответственно). Содержание сосудистого эндотелиального фактора роста достоверно повышается при применении низких (OR 1,385; 95% CI 1,117–4,602) и средних (OR 2,462; 95% CI 1,200–30,275) доз ингаляционных глюкокортикоидов. Утолщение комплекса интима-медиа свыше 0,9 мм (OR 1,157; 95% CI 1,080–4,777) не имело дозозависимого эффекта.
Objective — to detect side effects of basic therapy in children with allergic bronchial asthma (BA).
Materials and Methods. The study involved 224 children with allergic BA aged 6 to 17 years, with evaluation of homocysteine and vascular endothelial growth factor levels, ultrasonography of the carotid and brachial artery on Philips HD11 XE device in B-mode with color Doppler flow mapping.
Results. When comparing content of homocysteine and vascular endothelial growth factor in children with BA depending on basic anti-inflammatory therapy (BAIT), we have found that their content is significantly lower in children who did not receive BAIT (p < 0.05). Treatment with average and high doses of inhaled glucocorticoids is a risk factor for increase in homocysteine level (odds ration (OR) 1.504; 95% CI (confident interval) 1.141–7.519, and OR 2.456; 95% CI 1.427–29.343, respectively). The content of vascular endothelial growth factor significantly increased with the use of low (OR 1.385; 95% CI 1.117–4.602) and average (OR 2.462; 95% CI 1.200–30.275) doses of inhaled glucocorticoids. Intima-media thickening more than 0.9 mm (OR 1.157; 95% CI 1.080–4.777) hadn’t dose-dependent effect.
діти, бронхіальна астма, ендотеліальна дисфункція, небажані ефекти лікування.
дети, бронхиальная астма, эндотелиальная дисфункция, нежелательные эффекты лечения.
children, bronchial asthma, endothelial dysfunction, adverse effects of treatment.
Статья опубликована на с. 35-40
Актуальність проблеми
За останні роки в усьому світі, в тому числі й Україні, спостерігається тенденція до зростання захворюваності на бронхіальну астму (БА) дітей, зміщення її початку на більш ранній вік та більш тяжкий перебіг. Низка досліджень, здійснених згідно з рекомендаціями Європейського товариства пульмонологів, свідчить про те, що близько 7 % дитячого населення страждає від БА [2].
Незважаючи на численні дослідження щодо патогенезу БА, останнім часом значна увага приділяється ролі ендотеліальної дисфункції в механізмах розвитку та можливостях контролю цього захворювання. Відома велика кількість чинників, що характеризують стан судинного ендотелію, але нами були обрані саме гомоцистеїн через його зв’язок з оксидативним стресом (у процесі окислення гомоцистеїну утворюються аніон О– і гідроксильний іон ОН–, які ініціюють перекисне окислення ліпідів, що призводить до ураження ендотеліальних клітин і утворення окислених ліпопротеїдів плазми крові) та судинний ендотеліальний фактор росту (VEGF) — специфічний міоген ендотеліальних клітин судин, що стимулює ангіогенез, сприяє набряку, розширенню судин та звуженню діаметра дихальних шляхів [7, 8].
Відзначено, що на стан судинного ендотелію впливає низка тригерних чинників: імунокомплексних, інфекційних, механічних, обмінних, що сприяють підвищеній продукції вазоконстрикторів, ендотелінів і коагулянтів [1]. Окрім зазначених чинників, які стимулюють розвиток ендотеліальної дисфункції, важливу роль відіграє можливість розвитку небажаних наслідків базисної фармакотерапії, особливо це стосується тривалого застосування глюкокортикоїдної терапії [3]. Інгаляційні глюкокортикоїди (ІГК) можуть впливати на бронхіальну мікроциркуляцію інгібуванням продукції проангіогенних цитокінів/хемокінів та через супресивну дію на імунні клітини, які експресують проангіогенні молекули (VEGF; фактор росту, що виділяється тромбоцитами (PDGF або тимідинфосфорилази); фактор росту фібробластів (FGF-1, FGF-2); ангіопоетин-1). Механізм впливу ІГК на судинну стінку до кінця не з’ясований, його пов’язують із гальмуванням вивільнення ліпідних медіаторів і активаторів кінінової системи, зниженням активності гіалуронідази [4, 5].
Тобто, окрім необхідності контролю БА, постає питання безпеки використання значної кількості препаратів базисної протизапальної терапії (БПЗТ). У першу чергу це стосується застосування найбільш частих та ефективних засобів БПЗТ — ІГК, дієвість і дозування яких викликає низку дискусійних питань.
Саме тому метою роботи було визначення небажаних ефектів базисної терапії, зокрема її впливу на ендотелій судин, у дітей, хворих на алергічну БА.
Матеріали та методи
Нами було обстежено 224 дитини з алергічною БА у періоді загострення захворювання віком від 6 до 17 років (середній вік 9,42 ± 3,43 року). Діти були поділені на дві групи: основну групу становили хворі на БА, які отримували БПЗТ (n = 138), у групу порівняння увійшли пацієнти, які не отримували БПЗТ (n = 86), причому обидві групи були рандомізовані за тяжкістю та тривалістю захворювання. При проведенні базисної терапії ІГК враховувалась також тривалість застосування препаратів БПЗТ: до 1 року, від 1 до 5 років та понад 5 років. Верифікацію діагнозу БА проводили відповідно до наказу МОЗ України № 868 від 08.10.2013 р. з бронхіальної астми у дітей, з огляду на рекомендації «Глобальної ініціативи з бронхіальної астми» (Global Initiative for Asthma, GINA, 2010) та рекомендації, затверджені на ХІІ з’їзді педіатрів України (Київ, 2010). Матеріали дослідження не заперечують основним біоетичним нормам Ґельсінкської декларації, прийнятої Генеральною асамблеєю Всесвітньої медичної асоціації, Конвенції Ради Європи про права людини та біомедицину (1977), відповідним положенням Всесвітньої організації охорони здоров’я, Міжнародної ради медичних наукових товариств, Міжнародному кодексу медичної етики (1983) та законам України. Як контрольну групу обстежено 40 здорових дітей, яким було проведено весь спектр клінічного, біохімічного та інструментального дослідження.
Гомоцистеїн визначали методом рідинної хроматографії на апараті Hewlett Packard (США) після послідовної обробки робочого розчину трибутилфосфіном та парахлормеркурибензоатом за методом О.О. Пентюка (2003). Ранжування рівнів гомоцистеїну проводили відповідно до рекомендацій D.W. Jacobsen (1998): маргінальний рівень гомоцистеїну — 10–15 мкмоль/л, легка форма гіпергомоцистеїнемії — 15–25 мкмоль/л, середня форма гіпергомоцистеїнемії — 25–50 мкмоль/л, тяжка форма гіпергомоцистеїнемії — понад 50 мкмоль/л. Медіана — 17,36 [11,3–24,5] мкмоль/л. VEGF у сироватці крові визначали методом імуноферментного аналізу (ELISA) з використанням стандартних наборів фірми IBL International (Німеччина). Розподіл рівнів здійснювали за допомогою статистичного методу поділу варіаційних рядів на квартилі: І квартиль — менше ніж 248,45 пг/мл, ІІ квартиль — 248,45–431,66 пг/мл, ІІІ квартиль — 431,66–654,21 пг/мл, ІV квартиль — понад 654,21 пг/мл. Медіана — 431,66 [238,04–658,09] пг/мл.
Ультрасонографію (УСГ) сонної та плечової артерій проводили на апараті Philips HD11 XE у В-режимі з кольоровим допплерівським картуванням потоків лінійним датчиком у діапазоні 5–10 МГц, оптимально 7 МГц. Оцінювали товщину комплексу інтими-медії (ТКІМ) з обох сторін, а також швидкісні та якісні показники УСГ плечової артерії: пікова систолічна та максимальна кінцева діастолічна швидкості кровотоку (Vps та Ved), усереднена за часом максимальна швидкість кровотоку (TAMX), усереднена за часом середня швидкість кровотоку (TAV), систолодіастолічне співвідношення (S/D), індекс пульсації (PI), індекс периферичного опору (RI), час прискорення (AT).
Згідно з Глобальною стратегією лікування та профілактики БА (2011) виділяють низькі, середні та великі добові дози ІГК залежно від виду діючої речовини, що було основою поділу обстежених дітей на відповідні групи. Так, для будесоніду та беклометазону дипропіонату низькими добовими дозами є дози 100–200 мкг, середніми — 200–400 мкг, високими — понад 400 мкг, а для флютиказону пропіонату низькою добовою дозою є доза у 100–200 мкг, середня — 200–500 мкг, висока — понад 500 мкг.
Статистична обробка отриманих даних була проведена за допомогою програми IBM SPSS Statistics, версія 20 (2013), із застосуванням параметричних і непараметричних методів оцінки результатів. Розраховувалась середня арифметична величина (М) та стандартна помилка показників (m). Для визначення динаміки зміни показників застосовували критерії порівнянь для пов’язаних вибірок: критерій Стьюдента (у разі нормального закону розподілу), Т-критерій Вілкоксона (у разі відмінності закону розподілу від нормального). Для аналізу взаємозв’язків між двома незалежними величинами використовувався критерій кореляції Спірмена. Оцінку ступеня впливу факторних ознак проводили за показником відношення шансів (OR) із довірчим інтервалом (CI) 95 %.
Результати та їх обговорення
Діти, хворі на БА, мали ряд небажаних ефектів лікування, серед яких — орофарингеальний кандидоз, дисфонія, рефлекторний кашель і бронхоспазм, затримка росту та активація герпесвірусної інфекції, що виникали при використанні ІГК упродовж 1–5 років на 12,49–33,3 % частіше, ніж у дітей із тривалістю лікування до року (р < 0,05). Активація герпесвірусної інфекції на фоні прийому ІГК була наявна у 47,37 ± 11,45 % та 36,84 ± 11,07 % пацієнтів із тривалістю застосування препаратів від 1 до 5 років та понад 5 років відповідно. Що стосується затримки росту дітей, хворих на БА, які отримували БПЗТ ІГК, то вірогідно (р = 0,014) частіше таке ускладнення мали пацієнти, які застосовували ІГК від 1 до 5 років (66,67 ± 5,22 %). Проаналізувавши вміст гомоцистеїну та VEGF у сироватці крові дітей, хворих на БА, залежно від ступеня тяжкості захворювання та наявності БПЗТ, нами було встановлено, що у пацієнтів основної групи вміст обраних маркерів ендотеліальної дисфункції був вірогідно (р < 0,05) вищим, ніж у дітей із групи порівняння, незалежно від тяжкості захворювання (табл. 1).
Нами встановлено, що вміст гомоцистеїну та VEGF залежав від тривалості застосування БПЗТ. Так, у пацієнтів, які користувались ІГК понад 5 років, уміст гомоцистеїну та VEGF на 16,81 та 22,33 % відповідно більший, ніж у хворих, які отримували таке лікування низькими дозами препаратів (табл. 2).
БПЗТ у дітей, хворих на БА, різнилась за групами отриманих препаратів, саме тому нами було оцінено вміст гомоцистеїну та VEGF залежно від видів даного лікування. Так, уміст біохімічних маркерів ендотеліальної дисфункції при використанні простих ІГК був на 15,09 та 15,14 % відповідно вищим, ніж при терапії антагоністами лейкотрієнових рецепторів (табл. 3). Встановлено, що вірогідність збільшення вмісту гомоцистеїну та VEGF вища при застосуванні ІГК (OR 1,963; 95% CI 1,861–4,476 та OR 1,595; 95% CI 1,072–3,532 відповідно), ніж при використанні антагоністів лейкотрієнових рецепторів (OR 0,771; 95% CI 0,398–1,494 та OR 1,07; 95% CI 1,053–2,075 відповідно).
Відзначалось вірогідне збільшення вмісту гомоцистеїну на 21,92 % при порівнянні між застосуванням комбінації ІГК із бета-2-агоністами тривалої дії та антагоністами лейкотрієнових рецепторів. Зазначено, що використання антагоністів лейкотрієнових рецепторів також супроводжується вірогідним (р < 0,001) збільшенням вмісту VEGF порівняно зі здоровими дітьми (табл. 4). Вірогідність його підвищення була вищою при застосуванні комбінації ІГК з антагоністами лейкотрієнових рецепторів (OR 2,276; 95% CI 1,375–4,334), ніж при використанні ІГК із бета-2-агоністами тривалої дії (OR 1,185; 95% CI 1,025–5,620).
Вміст біохімічних маркерів ендотеліальної дисфункції у дітей основної групи, які отримували низькі дози простих ІГК, був на 18, 93 та 25,09 % відповідно нижчим, ніж у пацієнтів, які отримували високі дози простих препаратів БПЗТ (табл. 5).
Вміст гомоцистеїну та VEGF у сироватці крові дітей, хворих на БА, які отримували комбіновані ІГК, був вірогідно (р < 0,05) вищим у пацієнтів, які застосовували високі дози препаратів (на 18,99 та 23,61 % відповідно), ніж у тих, хто використовував низькі дози ІГК (табл. 6).
Існує зворотний середньої сили зв’язок між рівнем гомоцистеїну та застосуванням низьких (rxy = –0,358 (р = 0,032)) та середніх і високих (rxy = –0,454 (р < 0,001)) доз ІГК, причому сила зв’язку зростає зі збільшенням дози препарату (табл. 7).
Лікування середніми та високими дозами ІГК є чинником ризику підвищення вмісту гомоцистеїну понад 17,36 [11,3–24,5] мкмоль/л (ОR 1, 504; 95% CI 1,141–7,519 та ОR 2,456; 95% CI 1,427–29,343 відповідно). Що стосується зростання вмісту VEGF понад 431,66 [238,04–658,09] пг/мл, то він вірогідно підвищується при застосуванні низьких (OR 1,385; 95% CI 1,117–4,602) та середніх (OR 2,462; 95% CI 1,200–30,275) доз ІГК.
Проаналізувавши залежність між УСГ-індексами та групами отриманих препаратів, ми встановили, що при застосуванні ІГК пацієнти мали на 3,05–7,01 % вищі показники, ніж при використанні антагоністів лейкотрієнових рецепторів. Так, відзначено, що TAV та SD вірогідно (р < 0,01) відрізнялись у хворих, які отримували ІГК, та тих, хто застосовував антагоністи лейкотрієнових рецепторів (табл. 8).
Серед дітей, хворих на БА, які отримували комбіновану терапію, на 4,57–13,82 % вищі показники УСГ спостерігались у хворих, які використовували ІГК у поєднанні з антагоністами лейкотрієнових рецепторів, ніж у тих, хто користувався ІГК у поєднанні з бета-2-агоністами тривалої дії. Так, відзначена вірогідна (р < 0,05) різниця між TAV та SD у дітей, хворих на БА, які користувались комбінованою терапією ІГК із антагоністами лейкотрієнових рецепторів та бета-2-агоністами тривалої дії (табл. 9).
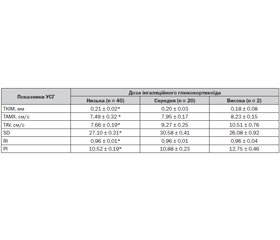
Провівши порівняння УСГ-індексів ендотеліальної дисфункції з дозами використаного ІГК, ми встановили, що на 8,99–27,12 % наведені індекси були більші при використанні високих доз препарату, ніж низьких, та на 3,31–17,37 % вищі, ніж при застосуванні середніх доз (табл. 10).
Нами було встановлено, що появу змін на УСГ можуть провокувати будь-які дози ІГК, зокрема підвищення таких показників, як TAV (OR 1,714; 95% CI 1,214–4,118) та PI (OR 1,267; 95% CI 1,010–3,144) при застосуванні лише низьких доз ІГК, та зміна TAV (OR 1,217; 95% CI 1,080–1,684), SD (OR 2,806; 95% CI 2,309–25,476) та RI (OR1,041; 95% CI1,015–2,406) при використанні високих доз ІГК.
Проаналізувавши залежність показників УСГ плечової артерії від рівня гомоцистеїну у дітей, хворих на БА, ми встановили, що SD (32,89 ± 0,41), TAV (9,00 ± 0,24) та PІ (10,87 ± 0,22) більші на 18,76; 12,99 та 9,51 % відповідно у дітей із середньою формою гіпергомоцистеїнемії від таких у здорових дітей (36,36 ± 0,83; 6,66 ± 0,38 та 6,82 ± 0,48 відповідно).
Порівнюючи вміст VEGF у сироватці крові дітей, хворих на БА, з показниками УСГ плечової артерії, ми відзначили, що такі індекси, як TAV (9,5 ± 0,39), SD (30,18 ± 0,62) та PІ (10,42 ± 0,36), відрізнялись на 16,11; 10,64 та 4,52 % у дітей, хворих на БА, в яких наявний вміст VEGF на рівні ІІІ–ІV квартилів, порівняно зі здоровими дітьми (6,66 ± 0,38; 36,36 ± 0,83 та 6,82 ± 0,48 відповідно).
Встановлено, що факторами ризику щодо появи такого прояву ендотеліальної дисфункції, як потовщення КІМ у дітей, хворих на БА, були зростання вмісту в сироватці крові гомоцистеїну понад 17,36 [11,3–24,5] мкмоль/л (ОR 1,253; 95% CI 1,005–1,562) та VEGF понад 431,66 [238,04–658,09] пг/мл (OR 2,211; 95% CI 1,484–10,092). Також відзначено, що такі показники УСГ плечової артерії, як TAMX (OR 1,455; 95% CI 1,179–2,944) та RI (OR 2,100; 95% CI 1,879–5,019), вірогідно змінюються при збільшенні вмісту VEGF понад 431,66 [238,04–658,09] пг/мл.
Висновки
1. У дітей, хворих на БА, виявлено ряд небажаних ефектів лікування, серед яких — орофарингеальний кандидоз, дисфонія, рефлекторний кашель і бронхоспазм, затримка росту та активація герпесвірусної інфекції, що виникали при використанні ІГК упродовж 1–5 років на 12,49–33,3 % частіше, ніж у дітей із тривалістю лікування до року.
2. Використання антагоністів лейкотрієнових рецепторів поглиблює ендотеліальну дисфункцію, притаманну даному захворюванню, що супроводжується підвищенням вмісту гомоцистеїну та VEGF, однак її вираженість найбільш істотна (вища на 15,14 %) при застосуванні ІГК і вірогідно відрізняється у дітей, які не отримували БПЗТ (р < 0,05).
3. Нами виявлено, що не тільки високі, але й середні дози ІГК проведеної БПЗТ є факторами ризику підвищення вмісту гомоцистеїну в сироватці крові хворих на БА (ОR 2,456; 95% CI 1,427–29,343 та ОR 1, 504; 95% CI 1,141–7,519 відповідно). Що стосується зростання вмісту VEGF понад 431,66 [238,0–658,09] пг/мл, то він вірогідно підвищується вже при застосуванні низьких (OR 1,385; 95% CI 1,117–4,602) та середніх (OR 2,462; 95% CI 1,200–30,275) доз ІГК.
4. Наявність ендотеліальної дисфункції у дітей з БА за ультрасонографічними показниками не мала дозозалежного ефекту при використанні ІГК, а саме: підвищення TAV (OR 1,714; 95% CI 1,214–4,118) та PI (OR 1,267; 95% CI 1,010–3,144) з’являється навіть при їх застосуванні в низьких дозах. Відзначено, що одним із факторів ризику потовщення комплексу інтими-медії у дітей, хворих на БА, було зростання вмісту гомоцистеїну (ОR 2,317 95% CI 1,082–3,596) та VEGF (ОR 2,941; 95% CI 1,498–17,362).
1. Антипкiн Ю.Г., Гончаренко Н.І., Тарасюк Б.А. Лазерна допплерівська флоуметрія у дослідженні ендотеліальної функції у дітей з бронхіальною астмою // Журнал АМН України. — 2010. — № 2(16). — С. 307-312.
2. Регеда М.С., Регеда М.М., Фурдичко Л.О., Колішецька М.А., Мироненко С.І. Бронхіальна астма. — Львів, 2012. — С. 147.
3. Adams N., Bestall J.M., Jones P.W. Cochrane Database // Syst. Rev. — 2002. — 1. — CD002310.
4. O’Sullivan S., Akveld M., Burke C.M., Poulter L.W. Effect of Montelukast to Inhaled Fluticasone Propionate on Airway Inflammation // Am. J. Respir. Crit. Care Med. — 2003. — 167. — 745-50.
5. Pauwels R., Pedersen S., Busse W. et al. Early intervention with budesonide in mild persistent asthma: a randomized, double-blind trial // Lancet. — 2003. — 361. — 1071-76.
6. Tawakol A., Omland T., Gerhard M. et al. Hyperhomocyst(e)inemia is associate with impaired endothelium-dependant vasodilatation in humans // Circulation. — 1997. — 95. — 1119-21.
7. Wanner A., Mendes E.S. Airway Endothelial Dysfunction in Asthma and Chronic Obstructive Pulmonary Disease: A Challenge for Future Research // Am. J. of Respiratory and Crit. Care Med. — 2010. — 182. — 1344-1351.

/36/36.jpg)
/37/37.jpg)
/38/38.jpg)