Статтю опубліковано на с. 63-67
Дефекты межпредсердной перегородки (ДМПП) — это группа врожденных пороков сердца (ВПС), для которых характерно наличие врожденного аномального сообщения между левым и правым предсердием.
Согласно МКБ-10, выделяют Q 21.1. Дефект межпредсердной перегородки. Дефект коронарного синуса незаращенный или такой, который сохранился: овальное отверстие, вторичное отверстие (тип ІІ). Дефект венозного синуса.
Первое упоминание о ДМПП встречается в работах Галена. Подробное описание дефекта межпредсердной перегородки принадлежит К. Rokitansky (1875).
Частота ДМПП в детском возрасте составляет 1 случай на 1500 живорожденных, или 7 % среди всех ВПС. Около 15–30 % здоровых детей и подростков имеют нефункционирующее овальное окно, при котором клапан овального окна не срастается с перегородкой. В таких случаях сердечный катетер, введенный в правое предсердие, может быть проведен через овальное окно в левое предсердие.
Анатомическая характеристика дефектов межпредсердной перегородки разнообразна и заключается не только в величине и количестве отверстий, но и в их локализации. Расположение дефекта может быть различным. Выделяют следующие основные морфологические типы ДМПП:
1. Первичный ДМПП — возникает при неполном слиянии эндокардиальных подушечек с первичной перегородкой. Так как эндокардиальные подушечки формируют митральный и трикуспидальный клапаны, первичный ДМПП часто сочетается с расщеплением передней митральной створки, и, как правило, это большой по размеру дефект (1/3–1/2 часть перегородки), локализующийся в нижней части перегородки. Наблюдается в 15 % среди всех анатомических вариантов ДМПП. Первичный ДМПП характеризуется отсутствием ткани в нижней части перегородки, в месте прикрепления митрального и трехстворчатого клапанов, межпредсердной и межжелудочковой перегородок.
2. Вторичный ДМПП — наиболее частый (70–80 % среди всех форм ДМПП) и более благоприятный по течению дефект. Он находится в области овального окна и возникает в результате недоразвития вторичной межпредсердной перегородки либо фенестрации, резорбции первичной перегородки. Размеры вторичного дефекта могут варьировать от 2 до 30 мм в диаметре.
3. Дефект межпредсердной перегородки коронарного синуса представляет собой дефект стенки коронарного синуса, обусловливающий сброс крови из левого предсердия в коронарный синус и затем в правое предсердие. Отмечается в 10 % от всех вариантов ДМПП.
4. Дефект межпредсердной перегородки венозного синуса, встречающийся в 10 % среди всех анатомических вариантов ДМПП, локализуется в задней части перегородки в области верхней полой вены. Этот порок может сочетаться с частичным аномальным дренажем легочных вен.
5. Общее предсердие (отсутствие межпредсердной перегородки) может быть отнесено к пятому типу ДМПП.
Открытое овальное окно, наблюдающееся у 25–30 % взрослого населения, не является истинным дефектом перегородки, обусловленным недостаточностью ее ткани, и поэтому не может быть отнесено к ДМПП. Многие авторы рассматривают открытое овальное окно как нормальный анатомический вариант развития перегородки. При этой аномалии не возникают нарушения гемодинамики и не требуется хирургическое лечение.
Гемодинамика. Вследствие большей емкости и растяжимости правого предсердия давление в нем на 3–5 мм рт.ст. ниже, чем в левом. Поэтому при дефекте межпредсердной перегородки происходит сброс крови из левого предсердия в правое (рис. 1).
При межпредсердных сообщениях большого размера влияние на величину сброса крови в основном оказывают соотношение сопротивления предсерд–но-желудочковых отверстий, пластическое сопротивление и объем заполнения желудочков сердца, состояние которых непостоянно. В зависимости от этого в различные периоды жизни и течения заболевания изменяется и объем сброса. Уменьшение сброса наступает при нарушении эластичности правого желудочка и вследствие гипертрофии мио–карда и повышения диастолического давления в нем. Наличие большого дефекта при условии уравновешенного давления в полостях предсердий может способствовать забросу венозной крови в левое предсердие. Наиболее часто легкая степень гипо–ксемии выявляется у больных с дефектом, расположенным у устья полых вен.
Сброс крови слева направо благодаря большой резервной возможности и низкой сопротивляемости сосудистого русла легких не приводит к быстрому и значительному повышению давления в правом желудочке. Возрастают объемная нагрузка и работа правого желудочка. При этом фиброзное кольцо легочной артерии не растягивается в достаточной степени. Возникает несоответствие между площадью отверстия клапана легочной артерии и объемом выброса правого желудочка. Это приводит к относительному стенозу легочной артерии (функциональный порок). За счет этого и появляется главный аускультативный признак порока — систолический шум над легочной артерией.
Длительное поступление большого количества крови в сосуды легких отражается на динамике кровообращения малого круга и постепенно приводит к развитию легочной гипертензии. Небольшое повышение давления до 35–40 мм рт.ст. — нередкое явление при этом пороке, наблюдающееся тогда, когда объем поступающей крови в малый круг кровообращения превышает норму в 3 раза и более. Сосудистое сопротивление в этих случаях остается нормальным или даже слегка сниженным.
При длительном течении заболевания возникает спазм сосудов малого круга кровообращения, при длительном существовании которого формируется гипертрофия стенок легочных артерий, а затем возникает склерозирование этих сосудов. По мере уменьшения емкости бассейна малого круга кровообращения происходят увеличение общего периферического сопротивления и повышение давления в легочной артерии. Таким образом, нагрузка на правый желудочек постепенно увеличивается, что приводит к повышению диастолического давления в нем. При этом снижается разница давлений между правым предсердием и правым желудочком в диастолу. Давление в правом предсердии постепенно будет расти, а значит, снижается разница давлений между предсердиями. Объем сброса крови между предсердиями уменьшается, то есть постепенно снижается объемная перегрузка правых отделов сердца. Во время крика, натуживания, физической нагрузки (физиологические ситуации повышения давления в легочной артерии) давление в правом предсердии может становиться большим, чем в левом, и происходит обратный сброс крови справа налево. При выраженном склерозе системы легочной артерии давление в правом предсердии постоянно превышает давление в левом, поэтому развивается постоянный обратный сброс крови (синдром Эйзенменгера).
Сочетание с другими пороками. Может наблюдаться при синдроме Дауна и других пороках сердца и сосудов.
Клиника ДМПП разнообразна и зависит от гемодинамических расстройств, определяющихся сбросом крови через дефект слева направо, перегрузкой правых отделов сердца и малого круга кровообращения. При небольших дефектах больные жалоб не предъявляют, и порок обычно выявляется при случайном обследовании. По сравнению с другими ВПС аускультативные признаки ДМПП слабо выражены. При значительных дефектах основными жалобами являются одышка и повышенная утомляемость, частые бронхиты и пневмонии в анамнезе. Порок распознается при рождении или на первом году жизни у 40 % больных. Обычно он диагностируется между вторым и пятым годами жизни.
Ранняя неонатальная и постнатальная диагностика. Диагностика ДМПП в неонатальном периоде практически идентична таковой у детей старшего возраста. Границы сердца перкуторно смещаются вправо за счет увеличения правого предсердия и правого желудочка. При пальпации области сердца не определяется систолическое дрожание. Аускультативно выявляемый систолический шум средней интенсивности с максимальным звучанием во ІІ–ІІІ межреберьях слева не обусловлен наличием и объемом артериально-венозного сброса крови, а является результатом объемной перегрузки правого желудочка и наличия относительного стеноза легочной артерии. Иногда (в 10 % случаев) может регистрироваться шум недостаточности клапанов легочной артерии, короткий диастолический шум на основании сердца.
У новорожденного с ДМПП второй тон над легочной артерией не акцентуирован, но широкий и расщепленный. На фонокардиографии определяется высокочастотный систолический шум, занимающий обычно первую половину систолы. Характерно расщепление второго тона, которое в отличие от физиологического расщепления постоянно. У новорожденных электрокардиограмма не информативна, так как характерная при ДМПП гипертрофия миокарда правого желудочка у них наблюдается в норме. В 50 % случаев выявляют блокаду правой ножки пучка Гиса и иногда (7 %) — увеличение периода атриовентрикулярного проведения до 0,24 с.
Ультразвуковое исследование наиболее информативно в постановке диагноза ДМПП, с его помощью выявляют: непосредственную визуализацию дефекта, увеличение размеров правого желудочка и правого предсердия, парадоксальный характер движения межжелудочковой перегородки, наблюдаемый при выраженном артериовенозном сбросе при отсутствии легочной гипертензии (рис. 2).
В раннем неонатальном периоде в связи с длительно сохраняющимися высокими цифрами легочного систолического давления и небольшим объемом шунтируемой крови парадоксальный характер движения межжелудочковой перегородки обычно не выявляется.
У новорожденных ДМПП редко осложняется недостаточностью кровообращения. При большом ДМПП толчком к развитию недостаточности кровообращения могут быть пневмония, острое респираторное заболевание, которые характерны для больных ВПС с обогащением малого круга крово–обращения, в том числе для пациентов с ДМПП.
Критерии постнатальной диагностики следующие:
I. Анамнестические: наличие в генеалогическом анамнезе врожденных либо приобретенных заболеваний сердечно-сосудистой системы, заболевания матери во время беременности, особенно в первом триместре, воздействие на беременную токсических, химических и др. факторов, радиоактивного излучения, неблагоприятный акушерский анамнез (аборты, выкидыши), ранняя либо поздняя беременность, большая разница в возрасте родителей, кровнородственные браки, приступы цианоза, асфиксии в периоде новорожденности, отставание в физическом развитии, частые пневмонии, бронхиты у ребенка.
ІІ. Клинические:
— отставание в физическом развитии, быстрая утомляемость, одышка, сердцебиение при физической нагрузке;
— бледность кожи и видимых слизистых оболочек;
— могут наблюдаться усиленный правожелудочковый сердечный толчок, пальпируемая пульсация легочной артерии;
— границы сердца нормальные либо увеличены вправо и вверх за счет правого предсердия, но при больших дефектах и у детей старшего возраста выявляется также расширение левой границы сердца, обычно за счет правого желудочка, оттесняющего левый желудочек кзади; систолический шум небольшой интенсивности во ІІ–ІІІ межреберьях слева у грудины, умеренно иррадиирующий к левой ключице и реже — к 5-й точке; может выслушиваться незначительный диастолический шум, возникающий в результате относительной недостаточности клапана легочной артерии или относительного трикуспидального стеноза;
— акцент и раздвоение второго тона над легочной артерией из-за гиперволемии и повышения давления в малом круге кровообращения и более позднего закрытия пульмонального клапана, особенно у детей более старшего возраста; первый тон чаще усилен, что обусловлено недогруженностью левого желудочка и усиленным сокращением перегруженного объемом правого желудочка, ускоренным закрытием трикуспидального клапана.
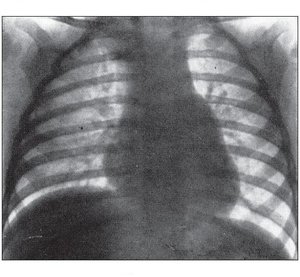
ІІІ. Параклинические: на ЭКГ: наиболее характерно отклонение электрической оси сердца вправо, признаки гипертрофии правого желудочка, неполная блокада правой ножки пучка Гиса; увеличение, заострение зубца Р во II и III отведениях; отклонение электрической оси сердца влево против часовой стрелки во фронтальной плоскости характерно для первичного ДМПП. На ФКГ: систолический шум ромбовидной или веретенообразной формы, средней либо малой амплитуды с максимальной точкой выраженности во ІІ–ІІІ межреберьях слева у грудины; расщепление и увеличение амплитуды второго тона над легочной артерией; ЭхоКГ: дилатация правого желудочка и правого предсердия, уменьшенная полость левого желудочка, парадоксальное или неопределенное движение межжелудочковой перегородки. Рентгенологические критерии: легочный рисунок у большинства больных усилен и обогащен за счет артериального русла; тени корней легких и ветвей легочной артерии расширены; отмечаются увеличение тени сердца за счет правых отделов, выбухание дуги легочной артерии (рис. 3), смещение вверх правого кардиовазального угла; при малых дефектах выявляется лишь умеренное усиление легочного рисунка при нормальных размерах сердца.
/63-67/66.jpg)
Дифференциальную диагностику проводят с функциональным систолическим шумом, изолированным стенозом легочной артерии, триадой Фалло, болезнью Эбштейна, аномальным дренажом легочных вен.
Лечение. Оптимальный возраст пациентов для хирургической коррекции — 2–12 лет. Новорожденные с ДМПП и застойной сердечной недостаточностью, а также дети с большим ДМПП, с возникшей сердечной недостаточностью должны получать медикаментозную терапию с включением дигоксина, диуретиков и ингибиторов ангиотензинпревращающего фермента.
Прогноз. Около 15 % вторичных ДМПП размером 6 мм и менее закрываются спонтанно. Если к 5–6-летнему возрасту не наступает спонтанного закрытия дефекта, показана консультация кардиохирурга для определения сроков оперативного лечения. Вторичный ДМПП характеризуется благоприятным естественным течением в первые две-три декады жизни, однако средняя продолжительность жизни составляет 36–40 лет. Среди пациентов, проживших 70 лет и более, большинство становятся тяжелыми инвалидами в возрасте старше 50 лет.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. Публикация не имеет связи с плановыми научно-исследовательскими работами, фондами, грантами.
Список литературы
1. Берман Р.Э. Педиатрия по Нельсону. В 5 т.: Пер. с англ. / Р.Э. Берман, Р.М. Клигман, Х.Б. Дженсон; под ред. А.А. Баранова. — М.: ООО «Рид Элсивер», 2009. — Т. 4. — 1112 с.: ил. — Перевод изд. Nelson Textbook of Pediatrics, 17th ed. / Richard E. Behrman, Robert M. Kliegman, Hal B. Jenson (с. 603-744).
2. Болезни сердца и сосудов. Руководство Европейского общества кардиологов / Под ред. А. Дж. Кэмма, Т.Ф. Люшера, П.В. Серруиса: Пер. с англ. под ред. Е.В. Шляхто. — М.: –ГЭОТАР-Медиа, 2011. — 2294 с.
3. Волосовець О.П. Стан надання медичної допомоги дітям із кардіоревматологічною патологією / О.П. Волосовець // Здоровье ребенка. — 2015. — № 5. — С. 125-133.
4. Воробьев А.С. Амбулаторная эхокардиография у детей: Руководство для врачей / А.С. Воробьев. — СПб.: СпецЛит, 2010. — 643 с.: ил.
5. Врожденные пороки развития: Доклад Секретариата: ЕВ 126/10 / 126-я сессия Исполнительного комитета ВОЗ: пункт 4.7 предварительной повестки дня, 3 декабря 2009 г., Женева. — Женева, 2009. — 9 с.
6. Врожденные пороки развития: Практ. рук. / В.Н. Запорожан, И.Л. Бабий, С.Р. Галич [и др.]. — Одесса: ОНМедУ, 2012. — 320 с.
7. Діагностика та моніторинг вроджених вад серця у новонароджених: Навч. посібник / О.П. Волосовець, Г.С. Сенаторова, М.О. Гончарь, А.Д. Бойченко. — Х., 2013. — 108 с.
8. Кардиология детского возраста / Под ред. А.Д. Царегородцева, Ю.М. Белозерова, Л.В. Брегель. — М.: ГЭОТАР-Медиа, 2014. — 784 с.
9. Кардиология и ревматология детского возраста / Под ред. Г.А. Самсыгиной, М.Ю. Щербаковой. — 2-е изд. — М.: Медпрактика, 2009. — 319 с.
10. Мутафьян О.А. Детская кардиология / О.А. Мутафьян. — М.: ГЭОТАР-Медиа, 2009. — 504 с.
11. Мутафьян О.А. Пороки сердца у детей и подростков / О.А. Мутафьян. — М.: ГЭОТАР-Медиа, 2009. — 560 с.
12. Райдинг Э. Эхография: Практ. рук. / Э. Райдинг; пер. с англ. — М.: МЕДпресс-информ, 2010. — 169 с.
13. Черная Н.Л. Новорожденный ребенок. Основы оценки состояния здоровья и рекомендации по профилактике его нарушений: Рук-во для врачей / Н.Л. Черная, В.В. Шилкин. — СПб.: СпецЛит, 2009. — 352 с.
14. Шарыкин А.С. Врожденные пороки сердца: Руководство для педиатров, кардиологов, неонатологов / А.С. Шарыкин. — 2-е изд. — М.: Бином, 2009. — 384 с.
15. Nisli K. Prevalence of congenital heart defects in patients with Down’s syndrome / K. Nisli // Jornal de pediatria (Rio J.). — 2009 Sep — Oct. — 85(5). — 377-8. — doi: 10.2223/JPED.1940.
16. Levels and trends in child mortality: report UNISEF / WHO, World Bank, UN. — New York: UNISEF, 2012.

/63-67/64.jpg)
/63-67/65.jpg)
/63-67/66.jpg)