Статтю опубліковано на с. 115-120
Введение
В современном мире, по мнению экспертов ВОЗ, предупреждение таких опасных форм поведения, как злоупотребление табаком, алкоголем, является важнейшим направлением сохранения здоровья детей и подростков [1]. Эпидемиологические исследования свидетельствуют о том, что происходит постоянное увеличение количества летальных исходов заболеваний, ассоциированных со злоупотреблением алкоголем и табакокурением [21, 39] В многочисленных исследованиях продемонстрировано системное неблагоприятное влияние злоупотребления алкоголем и табакокурения на развитие плода и состояние здоровья человека [4, 8]. В последнее время было продемонстрировано влияние злоупотребления алкоголем и табакокурения родителей на эпигенетические механизмы развития ребенка [11, 30].
Употребление алкоголя
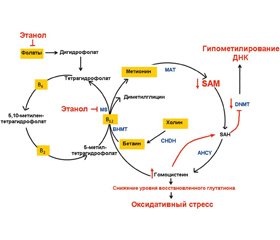
Этиловый спирт и его метаболиты оказывают не–посредственное влияние на эпигенетические механизмы, преимущественно нарушая метилирование ДНК [13]. Алкоголь-ассоциированные изменения функционирования эпигенетических механизмов обусловлены нарушениями C1-метаболизма. Этанол подавляет транспорт фолиевой кислоты, ингибирует метионинсинтетазу (MS), что обусловливает снижение уровня концентрации метионина и основного донора метильной группы — S-аденозилметионина (SAM) и повышение содержания S-аденозилгомоцистеина (SAH) в организме, индуцируя глобальное гипометилирование ДНК (рис. 1) [15, 28, 32].
/115-120/116-1.jpg)
Действие этанола приводит к нарушению транссульфирования адеметионина и, как следствие, к снижению концентрации SAM и увеличению содержания гомоцистеина, что приводит к снижению активности метилирования ДНК [41]. Также установлено, что хроническое употребление алкоголя сопровождается снижением экспрессии генов ДНК-метилтрансфераз DNMT3a, DNMT3b, обусловливающим глобальное гипометилирование ДНК [27]. Однако этаноловый спирт может индуцировать сайт-специфическое метилирование и ацетилирование гистоновых белков [7]. Целевыми генами действия этилового спирта в перинатальном периоде жизни являются преимущественно гены, участвующие в нейрогенезе (табл. 1).
/115-120/117-1.jpg)
Влияние употребления алкоголя родителями до зачатия и матерью во время беременности на состояние здоровья потомков характеризуется устойчивыми постнатальными последствиями, ведущими из которых являются алкогольный синдром плода (fetal alcohol syndrome — FAS) и нейроповеденческий дефицит. Алкоголь-ассоциированные расстройства плода лежат в основе большинства случаев умственной отсталости у детей [2, 20, 24, 40].
Влияние употребления родителями алкоголя на геномный импринтинг потомков представлено в табл. 2.
/115-120/118-1.jpg)
Malini Krishnamoorthy и соавт. [14] показали, что употребление алкоголя женщинами во время беременности сопровождается усилением экспрессии импринтированного гена субъединицы инотропного рецептора GABRB3, что может привести к нарушению развития центральной нервной системы. Также употребление алкоголя женщинами во время беременности приводит к снижению метилирования импринтинг-контролирующей области 2 (ICR2) гена KCNQ1OT1 и дифференциально метилированной области (DMR) гена PEG3 материнской аллели у детей. Гипометилирование ICR2 гена KCNQ1OT1, которая регулирует моноаллельную экспрессию нескольких генов, расположенных в импринтированном кластере KCNQ1/KCNQ1OT1, ассоциировано с развитием синдрома Беквита — Видемана. Гипометилирование ICR материнской аллели гена PEG3 может изменить экспрессию нескольких импринтированных генов в данном регионе генома. Учитывая, что ген PEG3 экспрессируется отцовской аллелью и не экспрессируется материнской аллелью, алкоголь-ассоциированное деметилирование, вероятно, приводит к дерепрессии гена PEG3 материнской аллели, обусловливая биаллельную экспрессию гена PEG3, что сопровождается увеличением количества транскриптов PEG3. Считают, что увеличение экспрессии мРНК PEG3 ассоциировано с задержкой внутриутробного развития (ЗВУР) [23].
В экспериментальных исследованиях показано, что этиловый спирт обусловливает развитие нарушений функционирования нескольких импринтированных генов (Gabra5, NDN, Peg3, Snrpn, H19) в клетках головного мозга. Так, внутрибрюшинное введение 25% раствора алкоголя в дозе 0,03 мл/кг беременным мышам C57B16/J в ранний гестационный период приводит к значительному снижению экспрессии гена субъединицы ГАМК-рецепторов Gabra5 ткани головного мозга 10-дневных эмбрионов. По мнению Laura Toso и соавт. [36], алкоголь-ассоциированное подавление экспрессии Gabra5 обусловливает снижение потенциала обучения. Christina R. Tyler и Andrea M. Allan [37] установили, что пероральное введение алкоголя мышиным самкам C57BL/6 в дозе 7 г/кг в сутки на протяжении 7 дней до спаривания и 15–17 дней после спаривания приводит к повышению уровня экспрессии гена некдина (necdin — NDN) в клетках-предшественниках нейронов головного мозга эмбрионов.
Назначение этанолового спирта каждые 2 дня в течение 4 недель до спаривания внутрь мышиным самцам (Swiss albino mice origin) способствовало гиперметилированию ДНК генов H19 и Peg3 генома сперматоцитов. У эмбрионов, зачатых данными мужскими особями, наблюдается гиперметилирование гена Snrpn и CpG7 и CpG11 области DMR гена Peg3 нейронов коры головного мозга, которое не сопровождается изменением экспрессии [18, 19]. Введение внутрь этанола мышиным самцам на протяжении 5 недель до спаривания приводит к снижению уровня метилирования ICR гена H19 в клетках соматических тканей потомства, которое коррелирует со степенью постнатальной рестрикции роста [13, 34].
Табакокурение
Несмотря на многочисленные научные и популярные предупреждения о вреде воздействия табачного дыма на состояние здоровья, согласно данным Всемирной организации здравоохранения, примерно 30 % всех мужчин систематически курят. Курильщики среди мужчин репродуктивного возраста (20–39 лет) составляют около 46 %. Около 20 % всех женщин во время беременности курят. Абсолютное число курильщиков увеличилось с 721 миллиона, зарегистрированных в 1980 году, до 967 миллионов в 2012 году [7, 17]. Курение женщинами во время беременности приводит к повышению риска преждевременных родов, задержки внутриутробного развития (ЗВУР), возникновению нарушений нейрогенеза, респираторной дисфункции плода. Примерно 20 % случаев ЗВУР ассоциированы с курением матери, и 2 % случаев ЗВУР ассоциированы с курением отца и связанным с ним аномальным метилированием гена IGF2 [26, 29].
Сигаретный дым содержит более 7000 различных химических веществ, многие из которых могут оказывать влияние на эпигенетические механизмы, индуцируя возникновение глобальных и сайт-специфических изменений метилирования ДНК [5, 10, 34].
Сравнительный анализ показал, что курение во время беременности сопровождается выраженным нарушением функционирования 193 генов клеток периферической крови женщин, 329 генов клеток плаценты и 49 генов клеток пуповинной крови [38]. Курение может вызвать изменения ДНК, воспроизводимые в последующем потомстве. Лонгитюдное (на протяжении 17 лет) исследование метилирования ДНК клеток крови у детей, рожденных курящими матерями, показало, что сайты CpG некоторых генов характеризуются обратимостью нарушений метилирования (GFI1, KLF13 и ATP9A), в то время как у других генов (АХРР, MYO1G, CYP1A1 и CNTNAP2) нарушения метилирования, ассоциированные с курением, отличаются высокой степенью сохранности. Негативное влияние курения матерей на процессы метилирования ДНК генома потомков значительно выше, чем курения отцов [31]. Потенциальные последствия таких эпигенетических модификаций в настоящее время изучены недостаточно [16].
Влияние табакокурения родителей на геномный импринтинг потомков представлено в табл. 3.
Susan K. Murphy и соавт. [26] продемонстрировали, что у детей, рожденных курящими матерями, наблюдается более высокая степень метилирования DMR гена IGF2, чем у тех детей, матери которых никогда не курили или бросили курить во время беременности. Повышение уровня метилирования, ассоциированного с курением, DMR гена IGF2 наиболее выражен у детей мужского пола. Ассоциированное с курением матери аномальное метилирование DMR гена IGF2 в 20 % случаев сопровождается ЗВУР плода. В то же время курение матери не влияет на уровень метилирования DMR гена H19 у детей.
Согласно результатам проведенного в Норвегии когортного исследования матери и ребенка (Mother and Child Cohort Study — MoBa), курение матери во время беременности ассоциировано со снижением метилирования семи из восьми CpG гена ДНК-связывающего репрессора транскрипции GFI1 (growth factor independent 1 transcription repressor) клеток пуповинной крови. Репрессор транскрипции GFI1 принимает активное участие в регуляции гемопоэза. Степень метилирования CpG гена GFI1 находится в обратно пропорциональном соотношении с уровнем метаболита никотина — котинина в материнской периферической крови, то есть нарушение метаболизации никотина сопряжено с ингибированием метилирования ДНК [10]. Продукт гена Gtl2 играет важную роль в эмбриональном развитии. Так, установлено, что делеция гена Gtl2 материнской аллели приводит к развитию дефектов скелетных мышц и к перинатальной гибели мышей [42].
Christina A. Markunas и соавт. [22] продемонстрировали, что в клетках периферической крови детей, родители которых являются активными курильщиками, наблюдается более высокий уровень метилирования CpG ДНК гена MEG3 материнской аллели, чем у детей некурящих родителей. Известно, что нкРНК, которую кодирует импринтированный ген MEG3, экпрессируемый материнской аллелью, участвует в эмбриональном развитии и, взаимодействуя с цАМФ, p53, MDM2 (murine double minute 2) и фактором роста дифференциации 15 (growth differentiation factor 15 — GDF15), играет определенную роль в контроле пролиферации клеток, а также в онкогенезе [3]. Курение матери во время беременности сопровождается подавлением экспрессии гена MEG3 в клетках ткани плаценты и сопряженной с уровнем ингибирования данного гена задержкой внутриутробного развития [25]. Ying-Chun Hu и соавт. [9] показали, что снижение экспрессии гена MEG3, наблюдаемое при курении, обусловлено гиперметилированием ДНК материнской аллели. Авторы продемонстрировали, что в ответ на влияние табачного дыма происходит подавление экспрессии гена MEG3 в иммортализованных бронхиальных эпителиальных клетках человека, а применение ингибитора метилирования цитозина — 5-аза-2-дезоксицитидина — способствует возобновлению его экспрессии. По всей вероятности, снижение экспрессии гена MEG3 у новорожденных детей, матери которых курили во время беременности, связано с табакозависимым повышенным уровнем метилирования ДНК. Гиперметилирование MEG3-DMR у новорожденных ингибирует связывание фактора CTCF, обусловливая как снижение экспрессии гена MEG3 и других генов, экспрессируемых материнской аллелью, так и усиление экспрессии генов данного импринтированного кластера, экспрессируемых отцовской аллелью [12].
Заключение
Таким образом, злоупотребление алкоголем и табакокурение родителей оказывают неблагоприятное воздействие на развитие плода и состояние здоровья ребенка, в частности, нарушая процессы метилирования ДНК импринтированных генов. Эпигенетические нарушения, ассоциированные с действием алкоголя и табакокурения, сопровождаются увеличением риска задержки внутриутробного развития и возникновением патологических отклонений в нейрогенезе плода.
Список литературы
1. Европейская стратегия «Здоровье и развитие детей и подростков». Европейское региональное бюро ВОЗ. — М., 2006.
2. Basavarajappa B.S. Fetal Alcohol Spectrum Disorder. Potential Role of Endocannabinoids Signaling // Brain Sci. — 2015 Oct 29. — 5(4). — 456-93. doi: 10.3390/brainsci5040456.
3. Benetatos L., Vartholomatos G., Hatzimichael E. MEG3 imprinted gene contribution in tumorigenesis // Int. J. Cancer. — 2011 Aug 15. — 129(4). — 773-9. doi: 10.1002/ijc.26052.
4. Caputo C., Wood E., Jabbour L. Impact of fetal alcohol exposure on body systems: A systematic review // Birth Defects Res. C Embryo Today. — 2016 Jun. — 108(2). — 174-80. doi: 10.1002/bdrc.21129.
5. Cuozzo C. DNA damage, homology-directed repair, and DNA methylation / C. Cuozzo, A. Porcellini, T. Angrisano et al. // PLoS Ge–net. — 2007 Jul. — 3(7). — e110. doi: 10.1371/journal.pgen.0030110.
6. Finegersh A., Homanics G.E. Acute ethanol alters multiple histone modifications at model gene promoters in the cerebral cortex // Alcohol Clin. Exp. Res. — 2014 Jul. — 38(7). — 1865-73. doi: 10.1111/acer.12465.
7. Harlev A. Smoking and Male Infertility: An Evidence-Based Review / A. Harlev, A. Agarwal, S.O. Gunes et al. // World J. Mens Health. — 2015 Dec. — 33(3). — 143-60. doi: 10.5534/wjmh.2015.33.3.143.
8. Holbrook B.D. The effects of nicotine on human fetal development // Birth Defects Res. C Embryo Today. — 2016 Jun. — 108(2). — 181-92. doi: 10.1002/bdrc.21128.
9. Hu Y.C. Alteration of transcriptional profile in human bronchial epithelial cells induced by cigarette smoke condensate / Y.C. Hu, Z.H. Yang, K.J. Zhong et al. // Toxicol. Lett. — 2009 Oct 8. — 190(1). — 23-31. doi: 10.1016/j.toxlet.2009.06.860.
10. Joubert B.R. 450K epigenome-wide scan identifies differential DNA methylation in newborns related to maternal smoking during pregnancy / B.R. Joubert, S.E. Håberg, R.M. Nilsen et al. // Environ Health Perspect. — 2012 Oct. — 120(10). — 1425-31. doi: 10.1289/ehp.1205412.
11. Joubert B.R. DNA Methylation in Newborns and Maternal Smoking in Pregnancy: Genome-wide Consortium Meta-analysis / B.R. Joubert, J.F. Felix, P. Yousefi et al. // Am. J. Hum. Genet. — 2016 Apr 7. — 98(4). — 680-96. doi: 10.1016/j.ajhg.2016.02.019.
12. Kagami M. The IG-DMR and the MEG3-DMR at human chromosome 14q32.2: hierarchical interaction and distinct functional properties as imprinting control centers / M. Kagami, M.J. O'Sullivan, A.J. Green et al. // PLoS Genet. — 2010 Jun 17. — 6(6). — e1000992. doi: 10.1371/journal.pgen.1000992.
13. Knezovich J.G., Ramsay M. The effect of preconception paternal alcohol exposure on epigenetic remodeling of the h19 and rasgrf1 imprinting control regions in mouse offspring // Front Genet. — 2012 Feb 22. — 3. — 10. doi: 10.3389/fgene.2012.00010.
14. Krishnamoorthy M. GABRB3 gene expression increases upon ethanol exposure in human embryonic stem cells / M. Krishnamoorthy, B.A. Gerwe, C.D. Scharer et al. // J. Recept Signal Transduct Res. — 2011. — 31. — 206 — 13. doi: 10.3109/10799893.2011.569723.
15. Kruman I.I., Fowler A.K. Impaired one carbon metabolism and DNA methylation in alcohol toxicity // J. Neurochem. — 2014 Jun. — 129(5). — 770-80. doi: 10.1111/jnc.12677.
16. Lee K.W. Prenatal exposure to maternal cigarette smoking and DNA methylation. — epigenome-wide association in a discovery sample of adolescents and replication in an independent cohort at birth through 17 years of age / K.W. Lee, R. Richmond, P. Hu et al. // Environ Health Perspect. — 2015 Feb. — 123(2). — 193-9. doi: 10.1289/ehp.1408614.
17. Leung L.W., Davies G.A. Smoking Cessation Strategies in Pregnancy // J. Obstet. Gynaecol. Can. — 2015 Sep. — 37(9). — 791-7. PMID: 26605448.
18. Liang F. Chronic exposure to ethanol in male mice may be associated with hearing loss in offspring / F. Liang, L. Diao, N. Jiang et al. // Asian J. Androl. — 2015 Nov-Dec. — 17(6). — 985-90. doi: 10.4103/1008-682X.160267.
19. Liang F. Paternal ethanol exposure and behavioral abnormities in offspring: associated alterations in imprinted gene methylation / F. Liang, L. Diao, J. Liu et al. // Neuropharmacology. — 2014 Jun. — 81. — 126-33. doi: 10.1016/j.neuropharm.2014.01.025.
20. Lindinger N.M. Theory of Mind in Children with Fetal Alcohol Spectrum Disorders / Lindinger N.M., Malcolm-Smith S., Dodge N.C. et al. // Alcohol Clin. Exp. Res. — 2016 Feb. — 40(2). — 367-76. doi: 10.1111/acer.12961.
21. Litten R.Z. Discovery, Development, and Adoption of Medications to Treat Alcohol Use Disorder: Goals for the Phases of Medications Development / R.Z. Litten, D.E. Falk, M.L. Ryan, J.B. Fertig // Alcohol Clin Exp Res. 2016 Jul. — 40(7). — 1368-79. doi: 10.1111/acer.13093.
22. Markunas C.A. Identification of DNA methylation changes in newborns related to maternal smoking during pregnancy / C.A. Markunas, Z. Xu, S. Harlid et al. // Environ Health Perspect. — 2014 Oct. — 122(10). — 1147-53. doi: 10.1289/ehp.1307892.
23. Masemola M.L. Reduced DNA methylation at the PEG3 DMR and KvDMR1 loci in children exposed to alcohol in utero: a South African Fetal Alcohol Syndrome cohort study / M.L. Masemola, L. van der Merwe, Z. Lombard et al. // Front Genet. — 2015 Mar 10. — 6. — 85. doi: 10.3389/fgene.2015.00085.
24. Mason S., Zhou F.C. Editorial: Genetics and epigenetics of fetal alcohol spectrum disorders // Front Genet. — 2015 Apr 16. — 6. — 146. doi: 10.3389/fgene.2015.00146.
25. McMinn J. Unbalanced placental expression of imprinted genes in human intrauterine growth restriction / J. McMinn, M. Wei, N. Schupf et al. // Placenta. — 2006 Jun-Jul. — 27(6–7). — 540-9. doi: 10.1016/j.placenta.2005.07.004.
26. Murphy S.K. Gender-specific methylation differences in relation to prenatal exposure to cigarette smoke / S.K. Murphy, A. Adigun, Z. Huang et al. // Gene. — 2012 Feb 15. — 494(1). — 36-43. doi: 10.1016/j.gene.2011.11.062.
27. Nagre N.N. CB1-receptor knockout neonatal mice are protected against ethanol-induced impairments of DNMT1, DNMT3A, and DNA methylation / N.N. Nagre, S. Subbanna, M. Shivakumar, D. Psychoyos, B.S. Basavarajappa // J. Neurochem. — 2015 Feb. — 132(4). — 429-42. doi: 10.1111/jnc.13006.
28. Ono H. Association of dietary and genetic factors related to one-carbon metabolism with global methylation level of leukocyte DNA / H. Ono, M. Iwasaki, A. Kuchiba et al. // Cancer Sci. — 2012 Dec. — 103(12). — 2159-64. doi: 10.1111/cas.12013.
29. Polańska K., Jurewicz J., Hanke W. Smoking and alcohol drinking during pregnancy as the risk factors for poor child neurodevelopment: A review of epidemiological studies // Int. J. Occup. Med. Environ Health. — 2015. — 28(3). — 419-43. doi: 10.13075/ijomeh.1896.00424.
30. Resendiz M. Epigenetic regulation of the neural transcriptome and alcohol interference during development / M. Resendiz, S. Mason, C.L. Lo, F.C. Zhou // Front Genet. — 2014 Aug 26. — 5. — 285. doi: 10.3389/fgene.2014.00285.
31. Richmond R.C. Prenatal exposure to maternal smoking and offspring DNA methylation across the lifecourse: findings from the Avon Longitudinal Study of Parents and Children (ALSPAC) / R.C. Richmond, A.J. Simpkin, G. Woodward et al. // Hum. Mol. Genet. — 2015 Apr 15. — 24(8). — 2201-17. doi: 10.1093/hmg/ddu739.
32. Schernhammer E.S. Dietary folate, alcohol and B vitamins in relation to LINE‑1 hypomethylation in colon cancer / E.S. Schernhammer, E. Giovannucci, T. Kawasaki et al. // Gut. 2010 Jun. — 59(6). — 794-9. doi: 10.1136/gut.2009.183707.
33. Stone W.L., Bailey B., Khraisha N. The pathophysiology of smoking during pregnancy: a systems biology approach // Front Biosci (Elite Ed). — 2014 Jun 1. — 6. — 318-28. PMID: 24896208.
34. Stouder C., Somm E., Paoloni-Giacobino A. Prenatal exposure to ethanol: a specific effect on the H19 gene in sperm // Reprod Toxicol. — 2011 May. — 31(4). — 507-12. doi: 10.1016/j.reprotox.2011.02.009.
35. Suter M.A., Anders A.M., Aagaard K.M. Maternal smoking as a model for environmental epigenetic changes affecting birthweight and fetal programming // Mol. Hum. Reprod. — 2013 Jan. — 19(1). — 1-6. doi: 10.1093/molehr/gas050.
36. Toso L. Prenatal alcohol exposure alters GABA(A)alpha5 expression: a mechanism of alcohol-induced learning dysfunction / L. Toso, R. Roberson, J. Woodard et al. // Am. J. Obstet Gynecol. — 2006 Aug. — 195(2). — 522-7. doi: 10.1016/j.ajog.2006.01.098.
37. Tyler C.R., Allan A.M. Prenatal alcohol exposure alters expression of neurogenesis-related genes in an ex vivo cell culture mo–del // Alcohol. — 2014 Aug. — 48(5). — 483-92. doi: 10.1016/j.alcohol.2014.06.001.
38. Votavova H. Transcriptome alterations in maternal and fetal cells induced by tobacco smoke / H. Votavova, M. Dostalova Mer–kerova, K. Fejglova et al. // Placenta. — 2011 Oct. — 32(10). — 763-70. doi: 10.1016/j.placenta.2011.06.022.
39. Watanabe M. Smoking: additional burden on aging and death // Genes Environ. — 2016 Jan 22. — 38. — 3. doi: 10.1186/s41021-016-0029-9.
40. Wilhelm C.J., Guizzetti M. Fetal Alcohol Spectrum Disorders: An Overview from the Glia Perspective // Front Integr. Neurosci. — 2016 Jan 11. — 9. — 65. doi: 10.3389/fnint.2015.00065.
41. Zakhari S. Alcohol metabolism and epigenetics changes // Alcohol Res. — 2013. — 35(1). — 6-16. PMC: 3860421.
42. Zhou Y. Activation of paternally expressed genes and perinatal death caused by deletion of the Gtl2 gene / Y. Zhou, P. Cheunsuchon, Y. Nakayama et al. // Development. — 2010 Aug. — 137(16). — 2643-52. doi: 10.1242/dev.045724.

/115-120/116-1.jpg)
/115-120/117-1.jpg)
/115-120/118-1.jpg)
/115-120/119-1.jpg)