Статтю опубліковано на с. 121-127
Введение
Деградация перекиси водорода (H2O2) является важнейшим процессом, характеризующим аэробную форму жизнедеятельности [2, 3]. В системе внутриклеточной антиоксидантной защиты супер–оксиддисмутазы передают эстафету каталазе. Каталаза (H2O2 : H2O2 — оксиредуктаза, КФ 1.11.1.6) является одним из самых активных ферментов в организме. Она разлагает H2O2 и относится к ферментному классу гидропероксидаз. Основным неферментативным инактиватором H2O2 внутри клетки является ключевой компонент антиоксидантной защиты респираторного тракта — глутатион, функционирование которого дополняет действие каталазы.
Краткая характеристика каталазы
Каталаза (CAT) является хромопротеидом с молекулярной массой около 240 кДа. Первичная структура мономерной молекулы CAT представляет аминокислотную цепь из 526 остатков с группами гема и НАДФН. Протеин CAT является гомотетрамером и имеет форму симметричного тетраэдра [34, 40]. Каждая субъединица содержит большой и малый домен. Большой домен характеризуется наличием антипараллельных бета-складок, спиральных включений, а малый домен — четырех альфа-спиралей. Четыре субъединицы молекулы каталазы сложены таким образом, что N-терминальный регион аминокислотной цепи каждой субъединицы проходит сквозь петлю, связывающую гемсодержащий домен одной субъединицы с доменом, включающим спиральный участок соседней субъединицы. Внутри гомотетрамера имеются значительного размера каналы и полости (самая большая радиусом ~7 A). Полости не сообщаются с поверхностью молекулы и, вероятно, обеспечивают диффузию субстрата к активному центру. Два канала, главный и минорный, подходят к дистальной полости, где размещаются субстрат, продукты реакции или ингибитор. Главный канал имеет форму конуса, который сужается при приближении к месту реакции, так что доступ к гему для больших молекул ограничен, а для пероксида водорода — свободен [1].
Каталаза в основном локализуется в пероксисомах, частично — в микросомах и в меньшей мере — в цитоплазме клетки. Полагают, что CAT не имеет высокого сродства к H2O2 и не может эффективно обезвреживать это соединение при низких концентрациях, характерных для физиологических условий цитоплазмы клеток. Поэтому CAT эффективно функционирует только при высоких концентрациях H2O2. В пероксисомах, которые характеризуются особенно высоким уровнем концентрации H2O2, отмечается значительная активность CAT. В митохондриях, с учетом того, что у них отсутствует CAT, нейтрализация H2O2 осуществляется глутатионом с участием глутатионпероксидазы или пероксиредо–ксина [4, 15, 28, 39].
Каталитический цикл каталазы
В респираторном тракте CAT конститутивно экспрессируется в эпителиоцитах и макрофагах [21]. В зависимости от концентрации H2O2 в окружающей среде CAT может выполнять каталазную
и/или пероксидазную функцию (рис. 1).
При высоких концентрациях Н2О2 преобладает каталазная активность: 2H2O2 • 2H2O + O2. Каталитический процесс проходит в два этапа:
1) H2O2 + Fe3+ – CAT • H2O + O = Fe4+ – CAT;
2) H2O2 + O = Fe4+ – CAT • H2O + Fe3+ – CAT.
Каталаза отличается высокой каталитической активностью — одна ее молекула за одну секунду может разложить 44 000 молекул Н2О2. Скорость катализа практически определяется только скоростью диффузии субстрата к активному центру фермента. Субстратами в пероксидазной реакции могут быть этанол, метанол, формиат, формальдегид и другие доноры водорода [26, 34].
Инактивация перекиси водорода и вторичных радикалов
Для нейтрализации H2O2 и вторичных радикалов, образующихся во время оксидантного стресса, клетки респираторного тракта располагают глутатионовой, селензависимыми ферментными системами (тиоредоксиновая, глутаредоксиновая) и селеннезависимой (пероксиредоксиновая) системой. Глутатионовая система в антиоксидантной защите органов дыхания на данном этапе играет центральную роль. В зависимости от участия селена различают селензависимые и селеннезависимые антиоксидантные системы [9, 23, 36].
Селензависимые антиоксидантные молекулярные системы
Селен был открыт шведским химиком Йенсом Якобом Берцелиусом в 1817 году и признан в 1957 году важнейшим микроэлементом для жизнедеятельности человека. В настоящее время у человека идентифицировано 25 генов, кодирующих селенсодержащие протеины (табл. 1).
/121-127/123-1.jpg)
Присутствие селена практически в 20 раз увеличивает каталитическую активность цистеиновых ферментов. Несколько селенопротеинов являются активными антиоксидантными ферментами — глутатионпероксидазы, тиоредоксинредуктазы [24, 32]. Основной молекулярной формой, которая связывает селен в организме человека, является селеноцистеин (selenocysteine/Sec/U-21 аминокислота) — цистеин, отличающийся от обычного тем, что вместо атома серы в его состав входит атом селена (Se). Высокая каталитическая активность селенсодержащих антиоксидантных ферментов обусловлена тем, что селеноцистеин (Sec) по нуклеофильности превосходит нормальный цистеин. Селен значительно быстрее возвращается из окисленной формы (Sec-SeO2–) в восстановленную (Sec-Se), чем сера (Cys-SO2– • Cys-SH) (рис. 2) [7, 18].
Благодаря этим свойствам Sec может катализировать окисление тиольных групп в восстановительной среде цитоплазмы, где соотношение восстановленной и окисленной форм глутатиона (GSH/GSSG) составляет 30/100, а окислительно-восстановительный потенциал равен примерно –230 мВ [38].
Перекись водорода в цитоплазме клетки из-за быстрой кинетики окисления селена в первую очередь, прежде чем сможет провзаимодействовать с другими потенциальными объектами, реагирует с Sec-содержащими протеинами, образуя селененовую кислоту, которая в присутствии 10–20 ммоль глутатиона устанавливает дисульфидные связи. В связи с этим селенопротеины активно участвуют в регуляции образования дисульфидных связей и, как следствие, в контроле функциональной активности протеинов. Быстрое потребление Н2О2 селенопротеинами лимитирует продолжительность и ограничивает радиус действия Н2О2 [16].
Система глутатиона
Глутатион (GSH) является жизненно необходимым компонентом и бронхоальвеолярного секрета, в котором он защищает эпителий респираторного тракта от повреждающего действия активированных кислородсодержащих метаболитов (АКМ) и активированных азотсодержащих метаболитов (ААМ) [12, 25, 30, 33, 37].
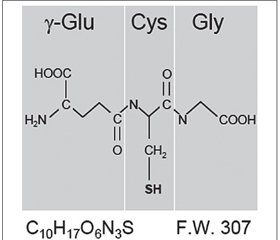
В 1888 году Joseph-Charles-François de Rey-Pailhade обнаружил, что клетки дрожжей содержат вещество, в результате спонтанной реакции которого с элементарной серой образуется сероводород. Данное вещество он назвал «филотион» (от греческого φιλοσ — любовь и θείο — сера). В 1929 году Фредерик Гоуленд Хопкинс, удостоенный Нобелевской премии, установил, что филотион, получивший к тому времени название «глутатион», является трипептидом, который состоит из остатков глутаминовой кислоты, цистеина и глицина (рис. 3) [14].
Физиологическая значимость GSH в функционировании внутриклеточной редокс-системы подчеркивается его высокой внутриклеточной концентрацией. Она намного выше, чем концентрация любых других компонентов редокс-системы внутри клетки, в частности внутриклеточная концентрация тиоредоксина в 100–1000 раз ниже, чем GSH. Молекула GSH характеризуется относительно большим отрицательным значением окислительно-восстановительного потенциала (Еh = –240 мВ) [27].
/121-127/124-3.jpg)
Система GSH, которая состоит из глутатиона (γ-L-глутамил-L-цистеинилглицина — 2-амино-5-{[2-[(карбоксиметил)амино]-1-(меркаптометил)-2-оксоэтил]амино}-5-оксопентановой кислоты), глутатионзависимых ферментов — глутатионпероксидазы (GPX), глутатионредуктазы (GR), глутатионтрансферазы (GST), глутаредоксинов (GRX, КФ 1.20.4.1), является центральным механизмом утилизации Н2О2, функционирование которого дополняет действие САТ. В отличие от САТ система GSH способна нейтрализовать и различные виды токсичных перекисей липидов. Глутатион в качестве носителя активных тиольных групп цистеиновых остатков функционирует как антиоксидант, непосредственно взаимодействуя с АКМ, ААМ, или действует как кофактор различных ферментов [8, 13, 30]. Благодаря своей высокой внутриклеточной концентрации, GSH в клетке выполняет роль жертвенного нуклеофила или скавенджера активных радикалов. Глутатион также участвует в детоксикации продуктов перекисного окисления липидов. Учитывая, что пептидазы клетки расщепляют пептидные связи, образованные α-карбоксильными, а не γ-карбоксильными группами аминокислот, молекула GSH относительно устойчива во внутриклеточной среде [10, 19].
Содержание глутатиона в респираторном тракте
Во внеклеточной среде, в том числе и в бронхоальвеолярном просвете, GSH является участником антиоксидантной защиты эпителиоцитов органов дыхания и протеинов бронхоальвеолярной жидкости, экстрацеллюлярного пространства от действия оксидантов. Глутатион экстрацеллюлярного пространства используется и как источник цистеина для синтеза de novo. Показано, что для бронхоальвеолярной жидкости, особенно в регионе газообмена, характерен высокий уровень концентрации GSH. Даже при физиологических условиях в бронхоальвеолярной жидкости содержание GSH в 7 раз больше, чем во всей ткани легкого. Во время окислительного стресса в несколько раз ускоряется оборот GSH в бронхоальвеолярной жидкости [20]. Уровень содержания GSH в бронхоальвеолярной жидкости ассоциирован с риском развития и тяжестью ряда заболеваний органов дыхания. Так, у больных бронхиальной астмой с высокой концентрацией GSH в бронхоальвеолярной жидкости отмечается более низкий уровень гиперреактивности бронхиального дерева, а высокая концентрация окисленной формы глутатиона (GSSG) сопровождается более тяжелым течением заболевания [5]. Низкий уровень концентрации GSH в бронхоальвеолярной жидкости наблюдается у больных муковисцидозом, идиопатическим фиброзирующим альвеолитом [20]. Уровень концентрации GSH внутри клетки колеблется от 1 до 10 мМ (табл. 2).
/121-127/125-1.jpg)
Молекула GSH существует в двух окислительно-восстановительных формах: в восстановленной (GSH) и окисленной форме в виде глутатиондисульфида (GSSG). В физиологических условиях соотношение GSH/GSSG составляет 100/1. Отношение GSH/GSSG отражает баланс активности окислительных и восстановительных реакций или, другими словами, окислительно-восстановительный статус клетки. Показано, что высокий уровень GSSG в мокроте больных может служить маркером окислительного стресса при заболеваниях органов дыхания [6, 10, 19].
Различные компартменты клетки отличаются друг от друга по содержанию глутатиона и соотношению его GSH и GSSG форм. В физиологических условиях практически во всех регионах и органеллах клетки восстановленная форма преобладает над окисленной, исключением является эндоплазматический ретикулум. В последнем высокое содержание GSSG обеспечивает условия для формирования дисульфидных связей при организации пространственной структуры белка. Особенно высоко содержание GSH в ядре клетки. Это оберегает от окисления сульфгидрильные группы белков, которые необходимы для обеспечения экспрессии генов и репарации ДНК, а также выполняет функции донора водорода для рибонуклеотидредуктазы, которая катализирует редукцию дезокси- и рибонуклеотидов. Максимальная концентрация GSH характерна для митохондрий — 10–15 % от его общего внутриклеточного пула [17, 27, 31].
Обмен глутатиона
Процесс синтеза GSH состоит из двух ферментативных реакций, катализируемых глутаматцистеинлигазой (GCL, КФ 6.3.2.2) и GSH-синтетазой (GS, КФ 6.3.2.3). Первый этап синтеза GSH осуществляет GCL, которая лигирует глутамат и цистеин. На втором этапе синтеза к цистеинилглутамату GS присоединяет глициновый остаток, формируя молекулу GSH. Оба этапа синтеза GSH являются АТФ-зависимыми процессами (рис. 4) [11, 29].
Окисленная форма глутатиона GSSG и глутатионовые S-конъюгаты экспортируются из клетки при помощи протеинов, ассоциированных с мультилекарственной резистентностью (MRP). В настоящее время идентифицировано девять протеинов MRP, которые участвуют в трансмембранном транспорте разнообразных субстратов [29].
Расщепление внеклеточного GSH происходит при помощи γ-глутамилтрансферазы (GGT), которая является гетеродимерным гликопротеином. GGT, гидролизуя пептидную связь между остатками глутамата и цистеина, катализирует деградацию внеклеточного GSH, приводящую к высвобождению цистеинил-глицина (CG) и глутамата. В последующем цистеинилглицин расщепляется мембранной дипептидазой на цистеин и глицин, которые, как правило, поступают внутрь клетки (рис. 5) [22, 29, 35].
Список литературы
1. Владимиров Ю.А. Зачем нужна белковая кристаллография // Природа. — 2003. — № 11. — С. 26-34.
2. Костюк В.А. Биорадикалы и биоантиоксиданты / В.А. Костюк, А.И. Потапович. — Минск: БГУ, 2004. — 174 с.
3. Москалев А.А. Старение и гены. — СПб.: Наука, 2008. — 358 с.
4. Чеснокова Н.П. Молекулярно-клеточные механизмы инактивации свободных радикалов в биологических системах / Н.П. Чеснокова, Е.В. Понукалина, М.Н. Бизенкова // Успехи современного естествознания. — 2006. — № 7. — C. 29-36.
5. Airway glutathione homeostasis is altered in children with severe asthma: evidence for oxidant stress / A.M. Fitzpatrick, W.G. Teague, F. Holguin et al. // J. Allergy Clin. Immunol. — 2009. — Vol. 123, № 1. — P. 146-152.e8. doi: 10.1016/j.jaci.2008.10.047.
6. Biswas S.K. Environmental toxicity, redox signaling and lung inflammation: the role of glutathione / S.K. Biswas, I. Rahman // Mol. Aspects Med. — 2009. — Vol. 30, № 1–2. — P. 60-76. doi: 10.1016/j.mam.2008.07.001. Epub 2008 Aug 8.
7. Biosynthesis of selenocysteine, the 21st amino acid in the genetic code, and a novel pathway for cysteine biosynthesis / A.A. Turanov, X.M. Xu, B.A. Carlson et al. // Adv. Nutr. — 2011. — Vol. 2, № 2. — P. 122-128. doi: 10.3945/an.110.000265. Epub 2011 Mar 10.
8. Cooper A.J. Reversible and irreversible protein glutathionylation: biological and clinical aspects / A.J. Cooper, J.T. Pinto, P.S. Callery // Expert. Opin. Drug Metab. Toxicol. — 2011. — Vol. 7, № 7. — P. 891-910. doi: 10.1517/17425255.2011.577738. Epub 2011 May 11.
9. Deneke S.M. Thiol-based antioxidants // Curr. Top. Cell Regul. — 2000. — Vol. 36. — P. 151-180. PMID: 10842751.
10. Dietary sulfur amino acid effects on fasting plasma cysteine/cystine redox potential in humans / D.P. Jones, Y. Park, N. Gletsu-Miller et al. // Nutrition. — 2011. — Vol. 27, № 2. — P. 199-205. doi: 10.1016/j.nut.2010.01.014. Epub 2010 May 14.
11. Forman H.J. Glutathione: overview of its protective roles, measurement, and biosynthesis / H.J. Forman, H. Zhang, A. Rinna // Mol. Aspects Med. — 2009. — Vol. 30, № 1–2. — P. 1-12. doi: 10.1016/j.mam.2008.08.006. Epub 2008 Aug 30.
12. Giordano G. Assessment of glutathione homeostasis / G. Giordano, C.C. White, L.G. Costa // Methods Mol. Biol. — 2011. — Vol. 758. — P. 205-214. doi: 10.1007/978-1-61779-170-3_14.
13. Glutathione, stress responses, and redox signaling in lung inflammation / I. Rahman, S.K. Biswas, L.A. Jimenez et al. // Antioxid. Redox Signal. — 2005. — Vol. 7, № 1–2. — P. 42-59. doi: 10.1089/ars.2005.7.42
14. Noctor G., Queval G., Mhamdi A. Glutathione // Arabidopsis Book. — 2011. — Vol. 9. — P. e0142. doi: 10.1199/tab.0142. Epub 2011 Feb 18.
15. Goyal M.M. Human catalase: looking for complete identity / M.M. Goyal, A. Basak // Protein. Cell. — 2010. — Vol. 1, № 10. — P. 888-897. doi: 10.1007/s13238-010-0113-z. Epub 2010 Nov 9.
16. Hawkes W.C. Regulation of redox signaling by selenoproteins / W.C. Hawkes, Z. Alkan // Biol. Trace Elem. Res. — 2010. — Vol. 134, № 3. — P. 235-251. doi: 10.1007/s12011-010-8656-7. Epub 2010 Mar 20.
17. Holmgren A. The use of thiols by ribonucleotide reductase / A. Holmgren, R. Sengupta // Free Radic. Biol. Med. — 2010. — Vol. 49, № 11. — P. 1617-1628. doi: 10.1016/j.freeradbiomed.2010.09.005. Epub 2010 Sep 16.
18. Hondal R.J. Differing views of the role of selenium in thioredoxin reductase / R.J. Hondal, E.L. Ruggles // Amino Acids. — 2011. — Vol. 41, № 1. — P. 73-89. doi: 10.1007/s00726-010-0494-6. Epub 2010 Feb 21.
19. Jones D.P. Redox compartmentalization and cellular stress / D.P. Jones, Y.M. Go // Diabetes Obes. Metab. — 2010. — Vol. 12, Suppl. 2. — P. 116-125. doi: 10.1111/j.1463-1326.2010.01266.x.
20. Joyce-Brady M. Inhibiting Glutathione Metabolism in Lung Lining Fluid as a Strategy to Augment Antioxidant Defense / M. Joyce-Brady, J. Hiratake // Curr. Enzym. Inhib. — 2011. — Vol. 7, № 2. — P. 71-78. doi: 10.2174/157340811796575308.
21. Kaarteenaho-Wiik R. Distribution of antioxidant enzymes in developing human lung, respiratory distress syndrome, and bronchopulmonary dysplasia / R. Kaarteenaho-Wiik, V.L. Kinnula // J. Histochem. Cytochem. — 2004. — Vol. 52, № 9. — P. 1231-1240. doi: 10.1369/jhc.4A6291.2004.
22. Keppler D. Multidrug resistance proteins (MRPs, ABCCs): importance for pathophysiology and drug therapy // Handb. Exp. Pharmacol. — 2011. — Vol. 201. — P. 299-323. doi: 10.1007/978-3-642-14541-4_8.
23. Koháryová M., Kolárová M. Oxidative stress and thioredoxin system / M. Koháryová, M. Kolárová // Gen. Physiol. Biophys. — 2008. — Vol. 27, № 2. — P. 71-84. PMID: 18645221.
24. Lu J. Selenoproteins / J. Lu, A. Holmgren // J. Biol. Chem. — 2009. — Vol. 284, № 2. — P. 723-727. doi: 10.1074/jbc.R800045200. Epub 2008 Aug 29.
25. Lushchak V.I. Glutathione homeostasis and functions: potential targets for medical interventions // J. Amino Acids. — 2012. — Vol. 2012. ID 736837. doi: 10.1155/2012/736837. Epub 2012 Feb 28.
26. Mechanisms of catalase activity of heme peroxidases / J. Vla–sits, C. Jakopitsch, M. Bernroitner et al. // Arch. Biochem. Biophys. — 2010. — Vol. 500, № 1. — P. 74-81. doi: 10.1016/j.abb.2010.04.018. Epub 2010 Apr 29.
27. Mitochondrial glutathione, a key survival antioxidant / M. Marí, A. Morales, A. Colell et al. // Antioxid. Redox Signal. — 2009. — Vol. 11, № 11. — P. 2685-2700. doi: 10.1089/ARS.2009.2695.
28. Molecular evolution of hydrogen peroxide degrading enzymes / M. Zámocký, B. Gasselhuber, P.G. Furtmüller, C. Obinger // Arch. Biochem. Biophys. — 2012, Sep 15. — Vol. 525, № 2. — P. 131-144. doi: 10.1016/j.abb.2012.01.017. Epub 2012 Feb 7.
29. Plasma membrane glutathione transporters and their roles in cell physiology and pathophysiology / N. Ballatori, S.M. Krance, R. Marchan, C.L. Hammond // Mol. Aspects Med. — 2009. — Vol. 30, № 1–2. — P. 13-28. doi: 10.1016/j.mam.2008.08.004. Epub 2008 Aug 26.
30. Rahman I. Oxidant and antioxidant balance in the airways and airway diseases / I. Rahman, S.K. Biswas, A. Kode // Eur. J. Pharmacol. — 2006. — Vol. 533, № 1–3. — P. 222-239. doi: 10.1016/j.ejphar.2005.12.087
31. Redox homeostasis in mycobacteria: the key to tuberculosis control? / A. Kumar, A. Farhana, L. Guidry et al. // Expert. Rev. Mol. Med. — 2011. — Vol. 13. — P. e39. doi: 10.1017/S1462399411002079.
32. Reeves M.A. The human selenoproteome: recent insights into functions and regulation / M.A. Reeves, P.R. Hoffmann // Cell Mol. Life Sci. — 2009. — Vol. 66, № 15. — P. 2457-2478. doi: 10.1007/s00018-009-0032-4. Epub 2009 Apr 28.
33. Reynaert N.L. Glutathione biochemistry in asthma // Biochim. Biophys. Acta. — 2011. — Vol. 1810, № 11. — P. 1045-1051. doi: 10.1016/j.bbagen.2011.01.010. Epub 2011 Jan 31.
34. Ścibior D. Katalaza — budowa, właściwości, funkcje / D. Ścibior, H. Czeczot // Postepy Hig. Med. Dosw. (Online). — 2006. — T. 60. — S. 170-180. PMID: 16618987.
35. S-glutathionylation: from molecular mechanisms to health outcomes / Y. Xiong, J.D. Uys, K.D. Tew, D.M. Townsend // Antioxid. Redox. Signal. — 2011. — Vol. 15, № 1. — P. 233-270. doi: 10.1089/ars.2010.3540. Epub 2011 May 25.
36. Thioredoxin 1 delivery as new therapeutics / H. Nakamura, Y. Hoshino, H. Okuyama et al. // Adv. Drug. Deliv. Rev. — 2009. — Vol. 61, № 4. — P. 303-309. PMID: 19385090.
37. Townsend D.M. The importance of glutathione in human di–sease / D.M. Townsend, K.D. Tew, H. Tapiero // Biomed. Pharmacother. — 2003. — Vol. 57, № 3–4. — P. 145-155. PMID:12818476.
38. Wouters M.A. Disulfides as redox switches: from molecular mechanisms to functional significance / M.A. Wouters, S.W. Fan, N.L. Haworth // Antioxid. Redox Signal. — 2010. — Vol. 12, № 1. — P. 53-91. doi: 10.1089/ARS.2009.2510.
39. Zámocký M. Understanding the structure and function of catalases: clues from molecular evolution and in vitro mutagenesis / M. Zámocký, F. Koller // Prog. Biophys Mol. Biol. — 1999. — Vol. 72, № 1. — P. 19-66. PMID:10446501.
40. http://en.wikipedia.org/wiki/File: PDB_7cat_EBI.jpg

/121-127/122-1.jpg)
/121-127/123-1.jpg)
/121-127/124-1.jpg)
/121-127/124-2.jpg)
/121-127/124-3.jpg)
/121-127/125-1.jpg)