Резюме
Матеріали та методи. На моделі імплантації сітчастих каркасних і безкаркасних протезів у зрілих щурів-самців лінії Wistar вивчено вплив застосування колагену тваринного походження на формування сполучної тканини в зоні розташування сітчастого протеза. Щурам, які були розподілені на 3 групи, у передочеревинний шар імплантували поліпропіленову сітку з каркасом і без нього. Тваринам основної та контрольної груп імплантували поліпропіленову сітку з каркасом. Щурів основної групи годували препаратом колаген у дозі 100 мг на 1 кг маси тіла протягом 1,5 місяця, контрольна група колаген не отримувала. Щурам порівняльної групи імплантували безкаркасну сітку. У кожній групі забір матеріалу здійснювали через 15, 30 і 90 діб. Поліпропіленову сітку видаляли разом з оточуючими тканинами та досліджували. Результати. Через 15 діб навколо сітки виявлено початкове формування тонкої сполучнотканинної капсули, великої кількості клітин запального інфільтрату та розсіяних молодих фібробластів та лаброцитів, більш виражених у групі з вживанням колагену. Через 3 місяці кількість цих клітин у всіх групах була однаковою. На 30-ту добу виявлені зміни відповідали проліферативній фазі заживлення ран. Установлено переважання волокнистих елементів матриксу над клітинними. В основній групі кількість еластичних волокон більша. В основній групі при забарвлюванні зрізів за методом Ван Гізона виявлені новоутворені волокна щільної сполучної тканини навколо сітки мають однакову невелику середню товщину та узгоджений рисунок. В інших двох групах спостерігались волокна як украй тонкі, так і у вигляді широких смуг та переважало хаотичне їх розташування. При аналізі васкуляризації тканин навколо введеної сітки в основній групі тварин відзначається збільшення (на 19,6 %) середньої кількості судин у вогнищі експерименту, що в подальшому зберігається. Висновки. Застосування колагену стимулює неоангіогенез, профілактує ішемізацію тканин у зоні алотрансплантатів за рахунок збільшення кровоносного русла та зберігає функціонуючими значну частину новоутворених судин. Використання колагену оптимізує утворення достатньої кількості зрілої сполучної тканини в періімплантаційній зоні без погіршення механічних властивостей алопротезу. Застосування колагену дозволяє збільшити біологічну сумісність і покращити приживлюваність сітчастих алотрансплантатів.
Материалы и методы. На модели имплантации сетчатых каркасных и бескаркасных протезов у зрелых крыс-самцов линии Wistar изучено влияние применения коллагена животного происхождения на формирование соединительной ткани в зоне расположения сетчатого протеза. Крысам, которые были распределены в 3 группы, в предбрюшинный слой имплантировали полипропиленовую сетку с каркасом и без него. Животным основной и контрольной групп имплантировали полипропиленовую сетку с каркасом. Крыс основной группы кормили препаратом коллаген в дозе 100 мг на 1 кг массы тела в течение 1,5 месяца, контрольная группа коллаген не получала. Крысам сравнительной группы имплантировали бескаркасную сетку. В каждой группе забор материала выполняли через 15, 30 и 90 суток. Полипропиленовую сетку удаляли вместе с окружающими тканями и исследовали. Результаты. Через 15 суток вокруг сетки обнаружено первоначальное формирование тонкой соединительнотканной капсулы, большого количества клеток воспалительного инфильтрата и рассеянных молодых фибробластов и лаброцитов, более выраженных в группе с применением коллагена. Через 3 месяца количество этих клеток во всех группах было одинаковым. На 30-е сутки обнаруженные изменения соответствовали пролиферативной фазе заживления ран. В основной группе количество эластичных волокон больше. В основной группе при окраске срезов по методу Ван Гизона выявленные волокна плотной соединительной ткани вокруг сетки имеют одинаковую небольшую среднюю толщину и согласованный рисунок. В других группах наблюдались волокна как крайне тонкие, так и в виде широких полос и преобладало хаотичное их расположение. При анализе васкуляризации тканей вокруг введенной сетки в основной группе животных отмечается увеличение (на 19,6 %) среднего количества сосудов в очаге эксперимента, которое в дальнейшем сохраняется. Выводы. Применение коллагена стимулирует неоангиогенез, профилактирует ишемизацию тканей в зоне аллотрансплантатов за счет увеличения кровеносного русла и сохраняет функционирующим значительную часть новообразованных сосудов. Использование коллагена оптимизирует образование достаточного количества зрелой соединительной ткани в периимплантационной зоне без ухудшения механических свойств аллопротеза. Применение коллагена позволяет увеличить биологическую совместимость и улучшить приживаемость сетчатых аллотрансплантатов.
Background. The problem of surgical treatment of ventral hernias remains relevant at the present time. The actual problem is choosing the best plastic material, meeting the requirements of an ideal prosthesis. Widely used polypropylene, due to reactions of implantation, causes formation of coarse connective tissue capsule, which deforms prosthesis. The question of minimizing the reaction of the body to the polypropylene implantation is not resolved, so finding ways to improve engraftment of polypropylene prosthesis continues. In this sense, the use of oral collagen is of high interest from the standpoint of studying the impact of animal collagen on the formation of complete connective tissue. However, the similarity of anterior abdominal wall structure in rats and humans allow for extrapolation of experimental data on humans. The aim of our work was to study the effect of using animal collagen on connective tissue formation in the area of the mesh prosthesis in experiments on rats. Materials and methods. Experimental studies were conducted on adult male Wistar white rats, in the preperitoneal layer of which a polypropylene mesh was implanted, with frame and without it; the animals were divided into 3 groups. The main and control group of animals were implanted a polypropylene mesh with frame. The main group received collagen preparation at a dose of 100 mg per 1 kg of body weight for 1.5 months, the control group did not receive collagen. Frameless mesh has been implanted in comparison group. In each group, sampling was performed after 15, 30 and 90 days. Polypropylene mesh was removed together with the surrounding tissues (subcutaneous tissue, fascia, muscle tissue, peritoneum) and investigated. Results. During the study of histological preparations in 15 days, we have found the initial formation of a thin connective tissue capsule around the mesh, where among a large number of cells of the inflammatory infiltrate and disseminated young fibroblasts and labrocytes, there was a number of newly formed blood vessels (capillaries). In the group with the use of collagen, a number of cells of inflammatory infiltrate was higher due to more expressive infiltration by lymphocytes and plasmocytes and a significant increase in the number of macrophags. In 3 months, the number of these cells in each group was the same. On day 30, the changes corresponded to the proliferative phase of wound healing. There was found a prevalence of fibrous matrix elements over the cell ones. In the study group, the number of elastic fibers was greater. Thin elastic fibers have a large number of branches, their number is increasing at the periphery of scar tissue, perivascularly and around collagen fibers; and in the study group, they are in all zones of the formed connective tissue, with a predominance on the periphery, their number is higher, there is a large number of branches and anastomoses. When staining by Van Gieson, we have revealed a dense connective tissue proliferation around the frame, and in the study group, newly formed fibers have equally low average thickness and agreed picture. In the other two groups, extremely thin fibers and broad stripes were observed, and the chaotic arrangement of the stripes predominated. When analyzing the vascularization of tissues around the mesh, in the main group of animals, starting from day 15, a significant increase (19.6 %) was noted in the average number of vessels in the focus of the experiment. In the future, this relationship remains. Obviously, the use of collagen stimulates the formation of new microvessels. Conclusions. Implantation of mesh cause transient inflammatory response expressed slightly, with the subsequent formation of a thin layer of connective tissue that can grow through the mesh, thus, combining it with the surrounding tissues. Mesh retains its softness and elasticity and doesn’t prevent normal wound healing process. The material is not absorbed, nor is destroyed and is no less strong under the influence of enzymes of surrounding tissues. Thus, our experimental study has allowed to document the following statement: collagen stimulates formation of new vessels, prevents ischemia of tissue in the area of allograft by increasing circulatory bed and keeps functioning a significant part of the newly formed vessels; the use of collagen optimizes the formation of a sufficient number of mature connective tissue in periimplant zone without deterioration of mechanical properties of allograft; the use of collagen can increase the biological compatibility and improve engraftment of mesh implants.
Вступ
Проблема хірургічного лікування вентральних гриж залишається актуальною і сьогодні. Також важливим є питання вибору оптимального пластичного матеріалу, що відповідає вимогам ідеального протеза. Широко використовуваний поліпропілен через виражені реакції імплантації викликає формування грубої сполучнотканинної капсули, що зморщує протез [3, 5]. Не вирішене питання мінімізації реакції організму на імплантацію поліпропілену, тому пошук шляхів покращання приживлення поліпропіленового протеза триває [7, 8]. З огляду на це використання перорального препарату колаген викликає неабиякий інтерес з точки зору вивчення впливу тваринного колагену на формування повноцінної сполучної тканини. Відомо, що передня черевна стінка щурів складається зі шкіри, апоневрозу, поперечносмугастих м’язів із фасціями та очеревини. Сполучна тканина заочеревинного шару складається з волокон колагену (що можуть формуватися у хвилеподібні, спірально криві, круглі чи пласкі пучки завтовшки від 1 до 150 мкм, що не розгалужуються), невеликої кількості еластичних волокон (тонкі, часто розгалужуються та анастомозують між собою) та подовженої форми фібробластів між ними, міжклітинної сполучної речовини, судин та нервів. Волокна можуть мати оформлений (орієнтований), неорієнтований та змішаний типи розташування. Колагенові волокна визначають міцність сполучної тканини (рубця), а еластичні — пружність та еластичність [1, 6]. Саме тому використання перорального препарату колаген викликає великий інтерес із точки зору вивчення впливу тваринного колагену на формування повноцінної сполучної тканини в щурів. У той же час схожість будови передньої черевної стінки щурів та людини дозволяє провести екстраполяцію експериментальних даних на людину [2, 4].
Мета роботи: вивчити вплив колагену тваринного походження на формування сполучної тканини в зоні розташування сітчастого протеза в експерименті на щурах.
Матеріали та методи
Експериментальне дослідження проведено на дорослих самцях білих щурів лінії Wistar. Тварини розподілені на 3 групи, кожна з яких поділена на 3 підгрупи.
1-ша група (основна) — тварини, у яких армований металевим каркасом поліпропіленовий імплантат розташовували в передочеревинному шарі передньої черевної стінки і яких годували колагеном у вигляді порошку в дозі 100 мг на 1 кг маси тіла протягом 1,5 місяця; група розподілена на 3 підгрупи: 1А — забір матеріалу здійснювали через 15 діб, 1В — через 30 діб, 1С — через 90 діб.
2-га група (контрольна) — тварини, у яких армований металевим каркасом поліпропіленовий імплантат розташовували в передочеревинному шарі передньої черевної стінки, по краях швами не фіксували; група розподілена на 3 підгрупи: 2А — забір матеріалу здійснювали через 15 діб, 2В — через 30 діб, 2С — через 90 діб.
3-тя група (порівняльна) — тварини, у яких поліпропіленовий імплантат розташовували в передочеревинному шарі передньої черевної стінки максимально рівно, по краях фіксували швами; група розподілена на 3 підгрупи: 3А — забір матеріалу здійснювали через 15 діб, 3В — через 30 діб, 3С — через 90 діб.
Розподіл тварин за групами та строками виведення з експерименту показано в табл. 1.
Дослідження виконали відповідно до «Правил проведення робіт із застосуванням лабораторних тварин». Знеболювання досягалось внутрішньочеревинним введенням розчину тіопенталу натрію в розрахунку 2,5 мг на 100 г маси тіла тварини. Використовували дрібнопористу стерильну поліпропіленову сітку з каркасом із нітинолу та без нього.
Імплантація сітчастого протеза проводилася в передочеревинний шар по зовнішньому краю піхви прямого м’яза. Останній розміщували так, щоб матеріал максимально контактував із такими анатомічними утвореннями, як очеревина, апоневроз, м’язи живота. Каркасну сітку не фіксували, безкаркасну сітку фіксували вузловими швами до м’язів по кутах сітки.
Евтаназію виконували на 15, 30, 90-ту добу шляхом введення летальної дози тіопенталу натрію 30 мг на 100 г маси тіла тварини. Поліпропіленову сітку видаляли разом із оточуючими тканинами (підшкірна клітковина, фасція, м’язова тканина, очеревина) та досліджували.
Отриманий матеріал за загальноприйнятими методиками фіксували і забарвлювали. Зрілість колагенових волокон визначалася за методом Ван Гізона та Хейла.
Результати та обговорення
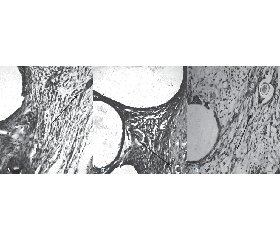
При дослідженні гістологічних препаратів через 15 діб навколо сітки (як стороннього об’єкта) документовано початкове формування тонкої сполучнотканинної капсули, де серед великої кількості клітин запального інфільтрату (переважно лімфоцити, плазмоцити із великою домішкою нейтрофільних гранулоцитів, макрофагів й гемосидерофагів) та розсіяних молодих фібробластів та лаброцитів знаходиться досить велика кількість новоутворених судин (капілярів). У групі використання колагену кількість клітин запального інфільтрату більша за рахунок вираженої інфільтрації лімфоцитами та плазмоцитами і значного збільшення кількості макрофагів, що може бути розцінено як один із факторів сприяння росту судин і як прояв місцевих імунорегуляторних реакцій (рис. 1). Через 3 місяці кількість цих клітин у всіх групах була однаковою.
При перегляді гістопрепаратів двох груп (конт–рольної та порівняльної) візуалізовано тонкі колагеновмісні фібрили (у средньому завтовшки 1–3 мкм), розташовані невпорядковано як у зоні сітки, так і навколо неї. У групі використання каркасної сітки та вживання препарату колаген основної речовини дещо більше, добре розвинуте мікроциркуляторне русло, а новоутворені капіляри мають поперечну орієнтацію до поверхні черевної стінки. Загалом в інших двох групах неоколагеногенез був подібний. Також вираженими були набряк міжклітинного матриксу, повнокров’я судин та стази в них (рис. 2).
На 30-ту добу виявлені зміни відповідали проліферативній фазі заживлення ран. Установлено переважання волокнистих елементів матриксу над клітинними. На межі з м’язами черевної стінки виявляються нечисленні, з невеликою кількістю розгалужень еластичні волокна. Причому в основній групі кількість еластичних волокон більша.
У щурів, виведених з експерименту на 90-ту добу, у стадію перебудови рубця, площа зон товстих пучків колагену за умов майже повної відсутності фібробластів зменшилась, причому за рахунок контракції колагенових волокон. Тонкі еластичні волокна утворюють дуже багато розгалужень, їх кількість збільшується на периферії рубцевої тканини, периваскулярно та навколо колагенових волокон, причому в основній групі вони є у всіх зонах утвореної сполучної тканини з переважанням на периферії та їх кількість більша, спостерігається багато гілок та анастомозів.
При забарвлюванні зрізів за методом Ван Гізона нами було виявлено розростання щільної сполучної тканини навколо сітки, причому в основній групі новоутворені волокна мають однакову невелику середню товщину та узгоджений рисунок. У інших двох групах спостерігались як украй тонкі волокна, так і широкі смуги та переважало хаотичне розташування полос.
Наші дослідження свідчать (та це й відповідає загальним уявленням про патогенез), що як результат появи численних фібробластів у місцях введення сітки виникають поля фіброзу. Установлено, що при застосуванні препарату колаген фіброз займає меншу площу, а новоутворені полоси колагену мають впорядковану структуру, меншу товщину, більшу щільність. Еластичні волокна спостерігаються в більшій кількості не лише по периферії сполучної тканини, а й в центральних ділянках та формують виражений сітчастий рисунок.
Визначено також середнє значення щільності відкладення колагену, вираженість запальної інфільтрації навколо сітки в балах від 0 до 10 (табл. 2), щільності у сформованій сполучній тканині капілярів.
Виявлено більш виражене відкладення колагену в основній групі через 15 днів, що досягає максимуму на 30-ту добу. При дослідженні через 3 місяці відмічається більш виражене відкладення колагену в контрольній і порівняльній групах за рахунок вираженого фіброзу по периферії протеза, при цьому в основній групі розподіл колагенових волокон рівномірний (табл. 3).
При дослідженні васкуляризації тканин навколо введеної сітки отримано дані (табл. 4), що були проаналізовані.
Було підраховано по 10 полів зору діаметром 1 мм (окуляр 10, об’єктив 20) у кожному випадку всіх груп. Середнє значення визначалось у кожній групі всіх етапів експерименту.
При введенні сітки з подальшим прийомом колагену вже починаючи з 15-ї доби відзначається значне збільшення (на 19,6 %) середньої кількості судин у вогнищі експерименту. У подальшому це співвідношення зберігається. Очевидно, що прийом колагену стимулює неоангіогенез.
Вимір середнього діаметра артеріол та венул показує поступове синхронне збільшення просвіту всіх видів дрібних судин, що непрямо свідчить про збільшення кровопостачання навколо сітки.
Висновки
Імплантація поліпропіленової сітки викликає транзиторну запальну реакцію, виражену незначною мірою, із подальшим утворенням тонкого шару сполучної тканини, що може проростати крізь сітку, поєднуючи, таким чином, сітку з оточуючими тканинами. Сітка зберігає свою еластичність і м’якість і не заважає процесам нормального загоєння рани. Матеріал не розсмоктується, а також не руйнується і не стає менш міцним під впливом ферментів оточуючих тканин.
Таким чином, проведене експериментальне дослідження дозволило документально підтвердити такі твердження:
1) застосування колагену стимулює неоангіогенез, профілактує ішемізацію тканин у зоні алотрансплантатів за рахунок збільшення кровоносного русла та зберігає функціонуючими значну частину новоутворених судин;
2) використання колагену оптимізує утворення достатньої кількості зрілої сполучної тканини в періімплантаційній зоні без погіршення механічних властивостей алопротеза;
3) застосування дозволяє збільшити біологічну сумісність і покращити приживлюваність сітчастих алотрансплантатів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Автандилов Г.Г. Медицинская морфометрия: Руководство. — М.: Медицина, 1990. — 384 с., ил.
2. Ноздрачев А.Д., Поляков Е.Л. Анатомия крысы (лабораторные животные) / Под ред. академика А.Д. Ноздрачева. — СПб.: Лань, 2001. — 464 с., ил.
3. Гостевской A.A. Обоснование и оценка эффективности новых материалов и методов в лечении послеоперационных вентральных грыж (клинико-экспериментальное исследование): Автореф. дис… д-ра мед. наук / A.A. Гостевской. — СПб., 2008. — 16 с.
4. Баранник М.И. Патоморфологические изменения тканей на имплантацию биопластических и синтетических материалов в зависимости от их физического состояния: Дис… д-ра мед. наук. — Новосибирск, 2014. — С. 152-162.
5. Милица H.H. Грыжа и грыжевая болезнь: новый взгляд на патогенез заболеваний / H.H. Милица, Ю.Д. Торопов, К.Н. Милица // Клін. xipypг. — 2009. — № 1. — С. 35-37.
6. Сорокина I.B. Морфологічні особливості репаративних процесів передньої черевної стінки при експериментальному використанні алопластичних матеріалів / I.B. Сорокина, H.I. Горголь, К.Н. Милица // Світ медицини та бюлогії. — 2008. — № 2. — С. 93-96.
7. Casanova A.B. Collagen in the transversalis fascia of patients with indirect inguinal hernia: a case-control study / A.B. Casanova, E.N. Trindade, M.R.M. Trindade // Am. J. Surg. — 2009. — Vol. 198, № 1. — P. 1-5.
8. Hernia a collagen disease? / R. Rosch et al. // European Surgery. — 2003. — Vol. 35, № l. — P. 11-15.
9. Takaoka R. Vascularization around poly(tetra–fluoroe–thy–lene) mesh with coating of gelatin hydrogel incorporating basic fibroblast growth factor / R. Takaoka, Y. Hikasa, Y. Tabata // J. Biomater. Sci. Polym. Ed. — 2009. — Vol. 20, № 10. — P. 1483-1494.

/13-1.gif)
/14-1.gif)
/15-1.gif)
/15-2.gif)