Вступ
Муковісцидоз являє собою складне хронічне захворювання, що характеризується прогресуючою дисфункцією різних органів і систем, у тому числі серцево-судинної системи [1, 2]. Протягом останніх чотирьох десятиліть проведені клініко-експериментальні дослідження вказують на специфічне залучення міокарда в патологічний процес при муковісцидозі [2]. В умовах хронічної гіпоксії та кисневого голодування в міокарді запускається каскад патологічних реакцій і процесів, що обумовлюють його ремоделювання [3]. При цьому на ранніх стадіях зміни в лівому шлуночку не корелюють з функціональним станом правого шлуночка і легень [4]. Структурно-геометрична перебудова серця, що відбувається при ремоделюванні міокарда, лежить в основі змін механічної активності лівого шлуночка, що призводить до його функціональних порушень [5]. Приєднання ускладнень з боку серцево-судинної системи призводить до інвалідизації хворих і погіршує прогноз для життя [6]. У зв’язку з цим необхідна рання діагностика гемодинамічних розладів і порушень функції серця. На думку ряду авторів, порушення діастолічної функції шлуночків серця є ранньою ознакою його ураження, що може передувати систолічній дисфункції і має важливе значення в патогенезі серцевої недостатності [7, 8].
Мета дослідження — вивчення структурно-функціональних особливостей міокарда лівого шлуночка та загальних сонних артерій у дітей, хворих на муковісцидоз.
Матеріали та методи
Під спостереженням перебували 72 дитини, хворі на муковісцидоз, віком від 3 до 15 років (середній вік — 10,0 ± 0,6 року). Контрольну групу становили 68 здорових дітей, репрезентативних за віком і статтю.
Усім дітям проведено ультразвукове дослідження серця за стандартною методикою з використанням еходопплерокардіографа Medisson 8000 та фазованого датчика 2–5 ф АС (США) з оцінкою маси міокарда лівого шлуночка (ММЛШ), яку визначали в грамах (г) згідно з The Fourth Report on the Diagnosis, Evaluation and Treatment of High Blood Pressure in Children and Adolescents [9]. Для вивчення процесів ремоделювання міокарда розраховували індекс маси МЛШ (ІММЛШ) як відношення ММЛШ/зріст у метрах [2, 7]. Геометрію МЛШ визначали за співвідношенням ІММЛШ і відносної товщини стінок, при цьому виділяли нормальну геометрію, концентричне ремоделювання, концентричну гіпертрофію та ексцентричну гіпертрофію МЛШ [10].
Діастолічну функцію ЛШ оцінювали за величиною трансмітрального діастолічного кровотоку в імпульсному допплерівському режимі з визначенням показників швидкості раннього діастолічного наповнення ЛШ — VmReacE, швидкості пізнього діастолічного наповнення ЛШ — VmReacА, їх співвідношення — Е/А, часу уповільнення раннього діастолічного наповнення ЛШ — DecTime, часу ізоволюметричного розслаблення — IVRT, часу ізоволюметричного скорочення — IVCT.
З метою діагностики доклінічної стадії діастолічної дисфункції ЛШ визначали функціональний індекс відповідності (ФІВ) за методикою А.Н. Ро–зенбаума і В.Т. Коваля (2010) [11]. Для цього вираховували нормований коефіцієнт (Кн) як співвідношення ударного об’єму (УО) до ММЛШ у контрольній групі, який незалежно від віку в середньому становив 0,8. Після цього розраховували коефіцієнт відповідності (Кв) між УО та ММЛШ у групах хворих і за величиною функціонального індексу відповідності, вираженою співвідношенням Кв/Кн, визначали стан МЛШ. ІВ вважали нормальним при його значеннях від 0,8 до 1,2. За наявності величини ФІВ понад 1,2 встановлювали ранню стадію дисфункції ЛШ із характерним для неї гіперкінетичним типом гемодинаміки, при величині ФІВ від 0,8 до 1,2 встановлювали нормальний стан міокарда, при величині ФІВ менше 0,8 діагностували діастолічну дисфункцію ЛШ.
Дуплексне сканування сонної артерії з визначенням її радіуса (мм) проводилося широкосмужним датчиком з частотою випромінювання 5–10 MHz на апараті Medisson 8000 (США). Вимірювання товщини комплексу інтима-медіа (КІМ) стінки сон–ної артерії проводилося у В-режимі за стандартною методикою, описаною P. Pignollii та співавт. (1986): у загальній сонній артерії на 1,0–1,5 см проксимально від її біфуркації по задній (щодо датчика) стінці артерії [12]. У подальшому визначалися гемодинамічні внутрішньосудинні параметри, що дозволяють опосередковано судити про величину периферичного опору та еластичні властивості судин: Vmax — пікова систолічна швидкість кровотоку (см/с), Vmin — кінцева діастолічна швидкість кровотоку (см/с), S/D — систолодіастолічне співвідношення, що відображає еластичні властивості судинної стінки, R1 — індекс резистивності як показник судинного опору, Р1 — пульсаційний індекс, що відображає опір судин. Для оцінки впливу руху крові на судинну стінку досліджувалось напруження зміщення на ендотелії загальної сонної артерії (τ), яке розраховувалося (у припущенні пуазейлевської течії) за формулою [13]:
/8-1.jpg)
де η — в’язкість крові (в середньому 0,05 Пз); V — максимальна швидкість кровотоку в загальній сон–ній артерії; D — діаметр артерії у сантиметрах.
Отримані результати опрацьовано методом варіаційної статистики з використанням пакета аналізу програми Statisticа for Windows 6.0 з обчисленням середнього арифметичного (М), середнього квадратичного відхилення (σ) і середніх помилок (m). Зв’язок між показниками оцінювали за допомогою кореляційного аналізу Пірсона (r). Для оцінки відмінностей показників у порівнюваних групах використовувався t-критерій Стьюдента. Оцінка відмінностей для малих вибірок проводилася із застосуванням непараметричного U-критерію Манна — Уїтні. Відмінності вважали вірогідними при р < 0,05.
Результати та обговорення
Проведений аналіз структурно-функціональних змін МЛШ у дітей, хворих на муковісцидоз, показав, що 42 (58 %) пацієнти мали ознаки ремоделювання МЛШ, серед яких у 17 (24,0 %) хворих морфометричні параметри МЛШ відповідали критеріям ексцентричної гіпертрофії, у 14 (24 %) хворих — концентричного ремоделювання, а в 11 (15 %) пацієнтів спостерігалася концентрична гіпертрофія ЛШ. Виявлені зміни геометрії МЛШ у хворих на муковісцидоз посилювалися при збільшенні тяжкості перебігу захворювання.
Вважається, що гіпертрофія МЛШ є одним з адаптаційно-пристосувальних механізмів, який дозволяє міокарду справитися з підвищеним навантаженням в умовах легеневої гіпертензії. В той же час гіпертрофія МЛШ обумовлює високий ризик кардіоваскулярних ускладнень, що пов’язано з порушенням коронарної гемодинаміки, розвитком систолічної та діастолічної дисфункції серця та хронічної серцевої недостатності [14].
Проведена оцінка діастолічної функції ЛШ за стандартною методикою не виявила вірогідних відмінностей від аналогічних показників контрольної групи як у загальній групі, так і в порівнянні з тяжкістю перебігу захворювання. Натомість визначення показника ФІВ у середньому по групі виявило його зниження в 1,2 раза від значення контрольної групи (0,83 ± 0,02 ум.од. проти 0,99 ± 0,02 ум.од., відповідно р < 0,05).
Індивідуальний аналіз встановив, що ознаки дисфункції МЛШ спостерігалися у 28 (38,9 %) пацієнтів із муковісцидозом, серед яких в 1 (1,4 %) хворого встановлено порушення за гіперкінетичним типом, тоді як у 27 (37,5 %) дітей було зареєстровано зниження ФІВ, що свідчило про ранні ознаки діастолічної дисфункції ЛШ. Найгірші показники ФІВ було зареєстровано у хворих із тяжким перебігом захворювання. Якщо у хворих з легким перебігом муковісцидозу зниження показника ФІВ спостерігалося в 29,4 % пацієнтів, то у дітей з середньотяжким і тяжким перебігом захворювання значення ФІВ менше 0,8 ум.од. реєструвалося у 47,4 % та 54,8 % пацієнтів відповідно. При цьому середні значення ФІВ становили відповідно 0,83 ± 0,04 ум.од.,
0,80 ± 0,05 ум.од. та 0,79 ± 0,05 ум.од. проти 0,99 ± 0,02 ум.од. у контролі (р < 0,05).
Зважаючи на те, що досліджувані групи були неоднорідні за віком, у процесі подальшої роботи було проаналізовано зміни показника ФІВ у групах спостереження залежно від віку пацієнтів (табл. 1).
Отримані результати показали, що у дітей, хворих на муковісцидоз, на відміну від дітей контрольної групи спостерігалося зниження показника ФІВ зі збільшенням віку, що свідчило про розвиток доклінічної стадії діастолічної дисфункції ЛШ. Найбільші прояви діастолічної дисфункції були відзначені у дітей, хворих на муковісцидоз, віком 12–16 років. Встановлено, що значення показника ФІВ в означеній групі було зниженим на 20 % щодо показників контрольної групи.
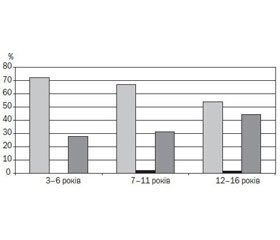
Індивідуальний аналіз показника ФІВ у групі дітей, хворих на муковісцидоз, показав таке: якщо у віці 3–6 років показник ФІВ знаходився в межах 0,8–1,2 ум.од. у 72,2 % хворих, то у віці 7–11 років нормативні значення ФІВ реєструвалися у 66 % дітей, а у віці 12–16 років — лише у половини пацієнтів (53,7 %). Вказані зміни відбувалися через збільшення частки дітей із низькими значеннями ФІВ (рис. 1), що свідчило про погіршення функціонального стану МЛШ у динаміці захворювання та розвиток діастолічної дисфункції ЛШ.
/9-1.jpg )
У подальшому проаналізовано значення показника ФІВ у хворих на муковісцидоз залежно від наявності ознак ремоделювання МЛШ. Встановлено, що за відсутності гіпертрофії МЛШ показник ФІВ у дітей, хворих на муковісцидоз, знаходився в межах контрольної групи (табл. 2), у той час як ремоделювання МЛШ відбувалося на фоні діастолічної дисфункції ЛШ, про що свідчило вірогідне зниження ФІВ у загальній групі хворих на муковісцидоз до 0,75 ± 0,03 ум.од, що на 20 % нижче за показники контрольної групи (р < 0,05).
Проведена оцінка показника ФІВ у дітей, хворих на муковісцидоз, з урахуванням варіанта ремоделювання МЛШ, що виявила деякі відмінності. Як подано в табл. 2, найнижчі значення ФІВ реєструвалися у пацієнтів з концентричною гіпертрофією МЛШ. При даному варіанті ремоделювання МЛШ ознаки діастолічної дисфункції ЛШ мали 81,8 % пацієнтів, у той час як при формуванні ексцентричної гіпертрофії низькі значення ФІВ було виявлено у третини (35,3 %) хворих. При розвитку концентричного ремоделювання зниження показника ФІВ визначалося у 64,4 % дітей, хворих на муковісцидоз. Отримані результати є логічними, беручи до уваги той факт, що концентрична гіпертрофія МЛШ вважається найбільш несприятливим варіантом ремоделювання МЛШ та асоціюється з найбільш високим серцево-судинним ризиком порівняно з іншими типами геометрії МЛШ [15, 16].
Аналіз стану гемодинаміки на рівні загальної сон–ної артерії в групі дітей, хворих на муковісцидоз, показав наявність ознак ремоделювання судин, про що свідчили вірогідно більші значення товщини КІМ (р < 0,05) щодо значень контрольної групи (табл. 3).
/10-1.jpg )
Вважається, що товщина КІМ стінки судин є одним із найважливіших маркерів ендотеліальної дисфункції [17]. Максимальні значення КІМ реєструвалися у хворих з тяжким перебігом захворювання (r = –0,33; p < 0,05) та гіпертрофією МЛШ (r = + 0,54; p < 0,05). Також зміни товщини КІМ у хворих на муковісцидоз визначалися при розвитку діастолічної дисфункції ЛШ. При проведенні кореляційного аналізу була встановлена зворотна залежність товщини КІМ від показника ФІВ (r = –0,59; p < 0,05). Одночасно відзначено зменшення систолодіастолічного співвідношення в групі дітей, хворих на муковісцидоз, що може свідчити про зниження еластичних властивостей судинної стінки загальної сонної артерії. В 1,5 раза нижчою за аналогічний показник контрольної групи у хворих на муковісцидоз виявилася пікова систолічна швидкість кровообігу. Кінцева діастолічна швидкість кровообігу також статистично вірогідно була зниженою стосовно показників здорових дітей. Низькі значення швидкісних показників призвели до зниження на 41 % напруження зміщення ендотелію порівняно зі значеннями контрольної групи (р < 0,05), що поряд з ознаками ремоделювання судин свідчило про порушення регуляції просвіту судин і розвиток вазоконстрикції [18, 19]. Слід відзначити, що на величину напруження зміщення ендотелію не впливала тяжкість перебігу хвороби (r = –0,04; p > 0,05). Встановлено, що низькі значення напруження зміщення ендотелію реєструвалися у хворих на муковісцидоз при розвитку діастолічної дисфункції ЛШ та гіпертрофії МЛШ. На це вказували отримані кореляційні зв’язки показника напруження зміщення ендотелію з ФІВ (r = +0,34; p < 0,05) та ІММЛШ (r = –0,55; p < 0,05).
Таким чином, отримані дані свідчать, що для дітей, хворих на муковисцидоз, характерні структурно-функціональна перебудова ЛШ та патологічні зміни гемодинаміки, раннє виникнення яких диктує необхідність розробки з подальшим застосуванням лікувально-профілактичних заходів, спрямованих на запобігання розвитку кардіоваскулярних розладів ще на доклінічній стадії.
Висновки
1. У дітей, хворих на муковісцидоз, відбувається ремоделювання лівих відділів серця, що супроводжується формуванням діастолічної дисфункції МЛШ, яка прогресує в динаміці захворювання.
2. Як ранній критерій діастолічної дисфункції МЛШ у дітей, хворих на муковісцидоз, можливо використання показника ФІВ, що дає можливість діагностувати ознаки діастолічної дисфункції МЛШ ще на доклінічній стадії.
3. Морфофункціональна перебудова лівих відділів серця у дітей, хворих на муковісцидоз, відбувалася на фоні ремоделювання та гемодинамічних змін на рівні загальних сонних артерій.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Yakovleva O.A., Zhamba A.O., Mazur Yu.V., compilers. Komorbidnost bronhialnoy astmyi, hronicheskoy obstruktivnoy bolezni legkih i serdechno-sosudistoy patologii [Comorbidity of bronchial asthma, chronic obstructive pulmonary disease and cardiovascular disease] // Ratsionalnaya Farmakoterapiya. — 2008. — Vol. 1. — P. 1824.
2. Labombarda F., Saloux E., Brouard J., Bergot E., Milliez P., compilers. Heart involvement in cystic fibrosis: A specific cystic fibrosis-related myocardial changes? // Respiratory Medicine. — 2016. — Vol. 118. — P. 31-38. https://doi.org/10.1016/j.rmed.2016.07.011
3. Hlapov A.P., Vecherskiy Yu.Yu., Ryazantseva N.V., compilers. Rol apoptoza kardiomiotsitov v mehanizmah ishemicheskogo remodelirovaniya miokarda [The role of apoptosis of cardiomyocytes in the mechanisms of ischemic myocardial remodeling] // Byulleten sibirskoy meditsinyi. — 2008. — Vol. 3. — P. 33-38.
4. Sellers Z.M., McGlocklin L., Brasch A., compilers. Strain rate echocardiography uncovers subclinical left ventricular dysfunction in cystic fibrosis // Journal of Cystic Fibrosis. — 2015. — Vol. 14(5). — P. 654-660. https://doi.org/10.1016/j.jcf.2015.03.010
5. Mitkovskaya N.P., Nizhnikova O.G., Statkevich T.V., compilers. Patogeneticheskie aspektyi postinfarktnogo remodelirovaniya [Pathogenetic aspects of postinfarction remodeling] // Meditsinskiy Zhurnal. — 2013. — Vol. 1. — P. 12-18.
6. Polunina V.A., Voronina L.P., Sevostyanova I.V., Polunina O.S., Belyakova I.S., compilers. Strukturno-funktsionalnyie izmeneniya miokarda pri bronhialnoy astme [Structurally functional changes of the myocardium during the bronchial asthma] // Sovremennyie problemyi nauki i obrazovaniya.— 2015. — Vol. 2. — P. 98.
7. Vahidova D.M., Muradov A.M., Vahidov A.V., compilers. Iz–meneniya tsentralnoy gemodinamiki i sokratitelnoy funktsii serdtsa pri tyazhelom techenii bronhialnoy astmyi [Changes in central hemodynamics and contractile function of the heart in severe bronchial asthma] // Voenno-Meditsinskiy Zhurnal. — 2008. — Vol. 9. — P. 71-72.
8. Polunina O.S., Voronina L.P., Grinberg N.B., Sevostyanova I.V., Grinberg B.A., compilers. Chastota vstrechaemosti disfunktsii miokarda pravogo i levogo zheludochkov, legochnoy gipertenzii i hronicheskogo legochnogo serdtsa u bolnyih bronhialnoy astmoy [The incidence of myocardial dysfunction of the right and left ventricles, pulmonary hypertension and chronic pulmonary heart disease in patients with bronchial asthma] // Astrahanskiy Meditsinskiy Zhurnal. — 2011. — Vol. 6(3). — P. 122-125.
9. The Fourth Report on the Diagnosis, Evaluation and Treatment of High Blood Pressure in Children and Adolescents // Pediatrics. — 2004. — Vol. 114 (2). — P. 555-576.
10. Daniels S.R., Kimball T.R., Morrison J.A., compilers. Indexing left ventricular mass to account for differences in body size in children and adolescents without cardiovascular disease // Am. J. Cardiol. — 1995. — Vol. 76. — P. 699-701. https://doi.org/10.1016/S0002-9149(99)80200-8
11. Rozenbaum A.N., Koval V.T., inventors; Rozenbaum A.N., Koval V.T., assignee. Sposob ranney diagnostiki sostoyaniya miokarda [Method for early diagnosis of the state of the myocardium] // Russian Federation patent RU 2425631. 2011 Aug 10 Russian.
12. Pignoli P., Tremoli E., Poli A., compilers. Intima plus media thickness of the arterial wall: a direct measurement with ultrasound imaging // Circulation. — 1986. — Vol. 74. — P. 1399-1406. https://doi.org/10.1161/01.CIR.74.6.1399
13. Ivanova O.V., Rogoza A.N., Balahonova T.V., compilers. Opredelenie chuvstvitelnosti plechevoy arterii k napryazheniyu sdviga na endoteliy kak metod otsenki sostoyaniya endoteliyzavisimoy vazodilatatsii s pomoschyu ultrazvuka vyisokogo razresheniya u bolnyih s arterialnoy gipertenziey [Determination of the sensitivity of the brachial artery to the shear stress on the endothelium as a method of assessing the state of endothelium-dependent vasodilation using ultrasound of high resolution in patients with arterial hypertension] // Kardiologiya. — 1998. — Vol. 3. — P. 37-41.
14. Udelson J.E., Konstam M.A., compilers. Ventricular Remo–deling. Fundamental to the Progression (and Regression) of Heart Failure // J. of the American College of Cardiol. — 2011. — Vol. 57(13). — P. 1477-1479. doi: 10.1016/j.jacc.2011.01.009
15. Levy D., Garrison R.J., Savage D.D., compilers. Prognostic implications of echocardiographically determined left ventricular mass in the Framingham Heart Study // N. Engl. J. Med. — 1990. — Vol. 322. — P. 1561-1566. doi: 10.1056/NEJM199005313222203
16. Krumholz H.M., Larson M., Levy D., compilers. Prognosis of left ventricular geometric patterns in the Framingham Heart Study // J. Am. Coll. Cardiol. — 1995. — Vol. 25(4). — P. 879-884. doi: 10.1016/0735-1097(94)00473-4
17. Jolliffe J., Janssen I., compilers. Development of age-specific adolescent metabolic syndrome criteria that are linked to the adult treatment panel III and international diabetes federation criteria // J. Am. Coll. Cardiol. — 2007. — Vol. 49(8). — P. 891-898. https://doi.org/10.1016/j.jacc.2006.08.065
18. Melkumyants A.M. Regulyatsiya soprotivleniya arteriy pri izmeneniyah napryazheniya sdviga na endotelii: dokazatelstvo suschestvovaniya i funktsionalnoe znachenie [Regulation of the resistance of arteries with changes in shear stress on the endothelium: evidence of existence and functional significance] [abstract dissertation]. — Moskva: MGU im. M. V. Lomonosova, 1996. — 35 р. — Russian.
19. Podolinnyiy G.I., Kiritsa I.L., compilers. Sosudyi myishechnogo i elasticheskogo tipa kak uchastniki patogeneza arterialnoy gipertenzii [Muscular and elastic vessels as members of pathogenesis in arterial hypertension]. Teoreticheskaya i klinicheskaya meditsina // Veterinariya. — 2016. — Vol. 2(53). — P. 47-51.

/8-1.jpg)
/9-2.jpg )
/9-1.jpg )
/10-1.jpg )