Резюме
Мета. Вивчення асоціації експресії мРНК галектину-9 (Gal-9) та мальабсорбції лактози при ожирінні у дітей з поліморфізмами (SNP) гена лактази (LCT) та дослідження ефективності лікування лактазної недостатності з використанням препаратів екзогенної лактази. Матеріали та методи. Обстежено 70 дітей з ожирінням (індекс маси тіла > 95-го перцентиля), а також 16 дітей без ожиріння віком 6–18 років. Визначено SNP LCT (матеріал для дослідження — венозна кров) методом полімеразної ланцюгової реакції (ПЛР) у реальному часі, експресії мРНК Gal-9 (матеріал для дослідження — букальний епітелій) методом ПЛР у реальному часі зі зворотною транскрипцією, дослідження мальабсорбції лактози за допомогою водневого дихального тесту. Серед дітей з ожирінням першу групу спостереження становили 38 дітей з генотипом С/С 13910, другу групу — 32 дитини з фенотипово ідентичними генотипами С/Т 13910 та Т/Т 13910, р > 0,05. У дітей з першої групи спостереження також визначався рівень експресії мРНК Gal-9 та мальабсорбції лактози після використання препаратів екзогенної лактази. Результати. Генотип С/С 13910 реєструвався у 38 (54,3 %), генотип С/Т 13910 — у 22 (31,4 %), генотип Т/Т — у 10 (14,3 %) пацієнтів. Мальабсорбція лактози у дітей з генотипом С/С 13910 становила в середньому 32,7 ± 10,4 рmm, у дітей з генотипами С/Т 13910 — 26,3 ± 4,9 рmm (р > 0,05), при генотипі Т/Т 13910 та у дітей без ожиріння була відсутня (р < 0,05). Середній рівень експресії мРНК Gal-9 у дітей з генотипом С/С 13910 дорівнював 564,3 ± 32,8 УО ∆mRNA Gal-9/mRNA actin, у дітей з генотипами С/Т і Т/Т 13910 — 61,04 ± 15,30 УО ∆mRNA Gal-9/mRNA actin, р < 0,01. Важливим є той факт, що в підгрупі дітей з генотипом С/С 13910 і мальабсорбцією лактози (n = 20) зареєстрований найнижчий середній рівень експресії мРНК Gal-9 (42,47 ± 13,30 УО ∆mRNA Gal-9/mRNA actin), тоді як у підгрупі дітей з генотипом С/С 13910 без мальабсорбції лактози (n = 18) — найвищий (1086,73 ± 52,60 УО ∆mRNA Gal-9/mRNA actin), що перебільшив рівень експресії мРНК Gal-9 у дітей без ожиріння та мальабсорбції лактози (313,34 ± 19,70 УО ∆mRNA Gal-9/mRNA actin), р < 0,01. Після використання препаратів екзогенної лактази у дітей з генотипом С/С 13910 та мальабсорбцією лактози протягом 1 місяця рівень експресії мРНК Gal-9 наблизився до рівня 246,21 ± 15,70 УО ∆mRNA Gal-9/mRNA actin, тоді як при використанні лише низьколактозної дієти збільшився незначно — до 58,72 ± 21,10 УО ∆mRNA Gal-9/mRNA actin, р < 0,01. Цікаво, що у дітей з генотипом С/С 13910 без мальабсорбції лактози на фоні низьколактозної дієти рівень експресії мРНК Gal-9 знизився до рівня 388,38 ± 20,40 УО ∆mRNA Gal-9/mRNA actin, наблизившись до рівня здорових дітей без ожиріння. Висновки. У дітей з генотипом С/С 13910 рівень експресії мРНК Gal-9 залежить від мальабсорбції лактози, яка потребує замісної терапії, що поєднує низьколактозну дієту та використання препаратів екзогенної лактази. За відсутності мальабсорбції лактози використання лише низьколактозної дієти у дітей з генотипом С/С 13910 наближає рівень експресії мРНК Gal-9 до рівня здорових дітей без ожиріння.
Цель. Изучение ассоциации экспрессии мРНК галектина-9 (Gal-9) и мальабсорбции лактозы при ожирении у детей с полиморфизмами (SNP) гена лактазы (LCT) и исследование эффективности лечения лактазной недостаточности с использованием препаратов экзогенной лактазы. Материалы и методы. Обследованы 70 детей с ожирением (индекс массы тела > 95-го перцентиля), а также 16 детей без ожирения в возрасте 6–18 лет. Определен SNP LCT (материал для исследования — венозная кровь) методом полимеразной цепной реакции (ПЦР) в реальном времени, экспрессии мРНК Gal-9 (материал для исследования — буккальный эпителий) методом ПЦР в реальном времени с обратной транскрипцией, исследование мальабсорбции лактозы с помощью водородного дыхательного теста. Среди детей с ожирением первую группу наблюдения составили 38 детей с генотипом С/С 13910, вторую группу — 32 ребенка с фенотипически идентичными генотипами С/Т 13910 и Т/Т 13910, р > 0,05. У детей из первой группы наблюдения также определялся уровень экспрессии мРНК Gal-9 и мальабсорбции лактозы после использования препаратов экзогенной лактазы. Результаты. Генотип С/С 13910 регистрировался у 38 (54,3 %), генотип С/Т 13910 — у 22 (31,4 %) и генотип Т/Т — у 10 (14,3 %) пациентов. Мальабсорбция лактозы у детей с генотипом С/С 13910 составила в среднем 32,7 ± 10,4 рmm, у детей с генотипами С/Т 13910 — 26,3 ± 4,9 рmm (р > 0,05), а при генотипе Т/Т 13910 и у детей без ожирения — отсутствовала (р < 0,05). Средний уровень экспрессии мРНК Gal-9 у детей с генотипом С/С 13910 составил 564,3 ± 32,8 УЕ ΔmRNA Gal-9/mRNA actin, у детей с генотипами С/Т и Т/Т 13910 — 61,04 ± 15,30 УО ΔmRNA Gal-9/mRNA actin, р < 0,01. Важным является тот факт, что в подгруппе детей с генотипом С/С 13910 и мальабсорбцией лактозы (n = 20) зарегистрирован самый низкий средний уровень экспрессии мРНК Gal-9 (42,47 ± 13,30 УЕ ΔmRNA Gal-9/mRNA actin), тогда как в подгруппе детей с генотипом С/С 13910 и без мальабсорбции лактозы (n = 18) — самый высокий (1086,73 ± 52,60 УЕ ΔmRNA Gal-9/mRNA actin), превысивший уровень экспрессии мРНК Gal-9 у детей без ожирения и мальабсорбции лактозы (313,34 ± 19,70 УЕ ΔmRNA Gal-9/mRNA actin), р < 0,01. После использования препаратов экзогенной лактазы у детей с генотипом С/С 13910 и мальабсорбцией лактозы в течение 1 месяца уровень экспрессии мРНК Gal-9 составил 246,21 ± 15,70 УО ΔmRNA Gal-9/mRNA actin, тогда как при использовании только низколактозной диеты незначительно увеличился до 58,72 ± 21,10 УЕ ΔmRNA Gal-9/mRNA actin, р < 0,01. Интересно также, что у детей с генотипом С/С 13910 без мальабсорбции лактозы на фоне низколактозной диеты уровень экспрессии мРНК Gal-9 снизился до уровня 388,38 ± 20,40 УО ΔmRNA Gal-9/mRNA actin, приблизившись к уровню здоровых детей без ожирения. Выводы. У детей с генотипом С/С 13910 уровень экспрессии мРНК Gal-9 зависит от мальабсорбции лактозы, которая требует заместительной терапии, сочетающей низколактозную диету и использование препаратов экзогенной лактазы. При отсутствии мальабсорбции лактозы использование только низколактозной диеты у детей с генотипом С/С 13910 приближает уровень экспрессии мРНК Gal-9 к уровню здоровых детей без ожирения.
Background. The aim of the study is to investigate the association of expression of galectin-9 (Gal-9) mRNA and lactose malabsorption in obese children with polymorphism (SNP) of the lactase gene (LCT) and to study the efficacy of lactase deficiency therapy using exogenous lactase preparations. Materials and methods. Seventy obese children (BMI > 95th percentile) and 16 children without obesity aged 6–18 years were examined. There was studied SNP LCT (material for investigation venous blood) by real-time PCR, expression of Gal-9 mRNA (study material buccal epithelium) by real-time PCR with reverse transcription, malabsorption of lactose by hydrogen breath test (HBT). Among obese children, 38 children with genotype C/C 13910 presented the first observation group, 32 children with phenotype identical genotypes C/T 13910 and T/T 13910, p > 0.05, presented the second group. Children from the first observation group also determined the level of expression of Gal-9 mRNA and lactose malabsorption after using exogenous lactase preparations. Results. The genotype C/C 13910 was determined in 38 (54.3 %), genotype C/T 13910 in 22 (31.4 %) and genotype T/T in 10 (14.3 %) patients. Malabsorption of lactose in children with genotype C/C 13910 averaged 32.7 ± 10.4 pmm, in children with genotypes C/T 13910 — 26.3 ± 4.9 pmm (p > 0.05) and with genotype T/T 13910 and was absent in children without obesity (p < 0.05). The average level of expression of Gal-9 mRNA in children with genotype C/C 13910 was 564.3 ± 32.8 RU ΔmRNA Gal-9/mRNA actin, in children with genotypes C/T and T/T 13910 — 61.04 ± 15.30 RU ΔmRNA Gal-9/mRNA actin, p < 0.01. It is of great importance that the children with genotype C/C 13910 and lactose malabsorption (n = 20) had the lowest average level of expression of Gal-9 mRNA (42.47 ± 13.30 RU ΔmRNA Gal-9/mRNA actin) whereas the children with genotype C/C 13910 and without lactose malabsorption (n =18) had the largest level (1086.73 ± 52.60 RU ΔmRNA Gal-9/mRNA actin), which exceeded the expression level of Gal-9 mRNA in children without obesity and lactose malabsorption (313.34 ± 19.70 RU ΔmRNA Gal-9 / mRNA actin), p < 0.01. After the use of exogenous lactase preparations in children with genotype C/C 13910 and lactose malabsorption for a month, the level of expression of Gal-9 mRNA approximated to the level of 246.21 ± 15.70 RU ΔmRNA Gal-9/mRNA actin, whereas when used only the low-lactose diet the level increased insignificantly to 58.72 ± 21.10 VD ΔmRNA Gal-9/mRNA actin, p < 0.01. It is also interesting that in children with genotype C/C 13910 without lactose malabsorption against the background of a low-lactose diet, the level of expression of Gal-9 mRNA decreased to 388.38 ± 20.40 RU ΔmRNA Gal-9/mRNA actin, approaching the level of healthy children without obesity. Conclusions. In children with genotype C/C 13910 the level of expression of Gal-9 mRNA depends on the lactose malabsorption, which requires replacement therapy that combines a low-lactose diet and the use of exogenous lactase preparations. In the absence of lactose malabsorption, using only the low-lactose diet in children with genotype C/C 13910 approximates the level of expression of Gal-9 mRNA to the level of healthy children without obesity.
Вступ
Пандемічність поширення ожиріння в світі потребує з’ясування молекулярно-генетичних предикторів ризику, що сприяють формуванню ускладненого перебігу захворювання, починаючи з дитячого віку. Ожиріння, формуючись в дитинстві, посідає провідне місце в структурі неінфекційних захворювань серед дорослого населення в Європейському регіоні, що зумовлюють 86 % передчасної летальності від асоційованих серцево-судинних захворювань, раку, цукрового діабету 2-го типу [19, 21].
Ініціатива Всесвітньої організації охорони здоров’я (ВООЗ) з епіднагляду за ожирінням в Європі (COSI) показала, що в середньому кожна третя дитина віком 6–9 років страждає від надмірної ваги чи ожиріння з поширеністю серед хлопчиків — 20,4 % і серед дівчаток — 19,4 % [9, 20].
Первинний дефіцит синтезу ферменту лактази є найбільш поширеним генетичним захворюванням у світі, асоціюється з лактазною недостатністю (ЛН) дорослого типу та зазвичай мальабсорбцією лактози [7]. В європейській популяції ЛН дорослого типу пов’язана з генотипом С/С 13910 та зумовлює певні метаболічні порушення, включаючи високу поширеність надмірної ваги та ожиріння [1–3, 15].
Персистенція лактази, що асоціюється з фенотипово схожими генотипами С/Т та Т/Т-13910, успадковується як домінуюча менделівська риса, що виникла близько 10 000 років тому серед племен Північної Європи, що займалися скотарством, та зумовила 100-відсотковий рівень експресії лактази протягом дорослого життя [12, 16, 17]. У наш час максимальна частота зустрічальності лактазної персистенції понад 90 % виявляється саме серед населення північноєвропейських країн (Скандинавії та Нідерландів), мінімальна зустрічальність алелі Т-13910 менше ніж 50 % представлена серед населення Південної Європи (Італії та Іспанії). Цікавим є факт, що найнижчий рівень поширеності надлишкової ваги та ожиріння в Європейському регіоні реєструється в скандинавській Норвегії і становить серед дітей віком 7–8 років 15 % (у хлопчиків — 13,5 %, у дівчаток — 17,8 %), найвищий рівень виявляється в Італії, що дорівнює 36 % (серед хлопчиків — 37,2 %, серед дівчаток — 34,7 %) [22].
Клінічно підтверджена мальабсорбція лактози викликає специфічну деескалацію експресії мРНК галектину-9 (Gal-9) — регулятора транспорту глюкози й уратів, основного ліганду для фагоцитарного рецептора Т-клітинного апоптозу Tim-3 (Т-клітинний імуноглобулін і домен 3 муцину) [11, 13].
Встановлено, що Gal-9, взаємодіючи з рецептором Tim-3, проявляє плейотропну імунну активність. Рецептор Tim-3 після зв’язування з Gal-9 індукує апоптоз Тh1-клітин [10]. У стані спокою інтрацелюлярний домен рецептора Tim-3 знаходиться у зв’язаному стані з протеїном Bat3. Після взаємодії Tim-3 з Gal-9 протеїн Bat3 дисоціює від інтрадомена рецептора Tim-3, і активація внутрішньоклітинних сигнальних шляхів призводить до модуляції виробництва IFN-γ і проліферації Т-клітин [17].
Внутрішньоклітинний Gal-9 внаслідок цис-взаємодії з Tim-3, при синергічній стимуляції TLR, активно транслокується в клітинне ядро, потім, зв’язуючись з фактором транскрипції NF-IL6, індукує транскрипцію прозапальних цитокінів IL-1α, Il-1β і IFN-γ [15].
Внутрішньоклітинно розташований Gal-9 також інгібує фосфорилювання STAT3, що призводить до збільшення транскрипції гена IL-12 і зниження транскрипції гена IL-23. Крім того, внутрішньоклітинно розташований Gal-9 знижує рівень експресії Tim-3 на клітинній поверхні за допомогою двох механізмів: цис-асоціації/інтерналізації STAT3-незалежного шляху і пригнічення T-bet (T-box expressed in T-cells) — транскрипційного фактора Т-хелперів 1-го типу [13].
Позаклітинний солютабний Gal-9 проявляє цитокіноподібний і проапоптичний ефект, пов’язаний з транс-асоціацією з Tim-3-експресуючими клітинами [5, 11].
При цьому відбувається фосфорилювання тирозинового залишку (Y265) ендодомена Tim3-SH2 інтерлейкін-індукованою Т-клітинною кіназою (ITK-SH2). В подальшому відзначено зниження фосфорилювання транскрипційного фактора STAT1, який забезпечує синтез IL-12 — фактора дозрівання цитотоксичних лімфоцитів. Одночасно активується фактор транскрипції STAT3, який індукує ген IL-23, що призводить до проліферації T-регуляторних клітин (Treg, CD4+CD25+Foxp3+) та індукції апоптозу Th1- і Th17-клітин. Природні регулюючі T-клітини експресують поверхневий маркер CD25 і продукт транскрипції гена — репресора Foxp3 (forkhead бокс P3). CD4+CD25+Foxp3+Treg-клітини мають потужну природну імуносупресуючу дію. Вони in vitro і in vivo можуть пригнічувати активацію, проліферацію й ефекторні функції CD4+ і CD8+ Т-клітин, натуральних кілерів (NK) і натуральних кілерних Т-клітин (NKT), В- і антиген-презентуючих клітин (APC). Апоптоз Th1-клітин призводить до зниження вироблення цитокінів: IFN-γ, IL-2, IL-3, IL-12, TNF-α, TNF-β, лімфотоксину, забезпечуючи протизапальний ефект. Апоптоз Th17-клітин викликає, відповідно, зниження синтезу IL-6, IL-17А, IL-17F, –IL-21, IL-22, IL-23, TNF-β, обумовлюючи гальмування автоімунного процесу [18]. Отже, солютабний Gal-9 забезпечує системну супресивну дію. Зважаючи на те, що при генотипі С/С 13910 не завжди клінічно підтверджується мальабсорбція лактози за допомогою водневого дихального тесту, а можлива і відносна фізіологічна компенсація абсорбції лактози, що певним чином залежить від віку, добової кількості спожитої лактози, стану кишкового мікробіому, ми припускаємо, що в цьому випадку відзначається гіперсекреція Gal-9, що і забезпечує імунологічну толерантність у вигляді відсутності прозапальної імунної відповіді [6, 14].
У свою чергу, наявність мальабсорбції лактози можна розглядати як клінічну маніфестацію ЛН дорослого типу, пов’язану з порушенням відносних компенсаторних механізмів і гальмуванням надлишком лактози проапоптичних сигнальних шляхів, зумовлених специфічною деескалацією експресії мРНК солютабного Gal-9.
Мета: вивчити асоціацію експресії мРНК Gal-9 та мальабсорбції лактози при ожирінні у дітей з поліморфізмами (SNP) гена лактази (LCT) та дослідити ефективність лікування лактазної недостатності з використанням препаратів екзогенної лактази.
Матеріали та методи
На базі ендокринологічного відділення КЗ «Дніпропетровська МДКЛ № 1» ДОР» обстежено 70 дітей з ожирінням (ІМТ > 95-го перцентиля), а також 16 дітей без ожиріння віком 6–18 років.
Молекулярно-генетичні дослідження включали визначення SNP LCT у венозній крові та експресії мРНК Gal-9 у букальному епітелії. Визначення наявності поліморфізмів у гені лактази проводилось у сертифікованій лабораторії «Sinevo» за допомогою полімеразної ланцюгової реакції з детекцією результатів у режимі реального часу (ПЛР-РЧ). Як аналізатор використовувався детектор «ДТ-96», тест-системи «ДНК-Технологія» (РФ).
Дослідження експресії мРНК Gal-9 у букальному епітелії було проведене в сертифікованій лабораторії відділу загальної і молекулярної патофізіології Інституту фізіології ім. О.О. Богомольця НАН України (директор — професор О.О. Кришталь) методом ПЛР-РЧ зі зворотною транскрипцією згідно з протоколом TaqMan Gene Expression Assays і включало такі етапи:
— Виділення мРНК Gal-9 з первинного матеріалу.
Забір букального епітелію проводився з використанням букальних щіток із подальшим заморожуванням зразків та їх зберіганням при температурі 20 °С. Виділення мРНК виконувалось за допомогою реагентів Trizol RNA Prep 100 («Лабораторія Ізоген», РФ), згідно з протоколом виробника, за рахунок використання Trizol реагенту з гуанідинсукцинатом фенолом, який призначався для лізису клітин, солюбілізації клітинного дебрису, денатурації клітинних нуклеаз, а також для видалення білків і ДНК.
— Преампліфікація (підготовка праймерів із мРНК).
Змішували мРНК, 5-кратний гексамерний праймер довільної послідовності SO142 Hexamer Random (Thermo Scientific, США) та деіонізовану воду. Первинна денатурація тривала 5 хвилин (хв) при температурі 70 °С у термоциклері GeneAmp PCR System 2700 (Applied Biosystems, США).
— Зворотна транскрипція.
Зворотну транскрипцію (ЗТ) виконували з використанням гексамерного праймера, застосовуючи виділену мРНК і зворотну транскриптазу RevertAid Reverse transcriptase (Thermo Scientific, США). Повний цикл тривав 80 хв у термоциклері GeneAmp PCR System 2700 (Thermo Scientific, США) в такій послідовності: 10 хв — 25 оС, 60 хв — 42 °С, 10 хв — 70 °С. Отриману внаслідок ЗТ одноланцюгову клоновану ДНК (кДНК) використовували для кількісної оцінки експресії генів з використанням ПЛР-РЧ із застосуванням праймерів для відповідних генів (Набір TagMan Gene Expression Assay FAM (4448892) Assay ID Hs04190742_mH (LGALS9), набір TagMan β-актин Control Reagent). Експресію генів стандартизували відносно експресії гена β-актину як ендогенного контролю (одного з так званих Housekeeping gene або генів домашнього господарства). ПЛР-ампліфікація генів проводилась з використанням TaqMan PCR Master Mix, що містив однакову кількість кожного праймера.
— Ампліфікація.
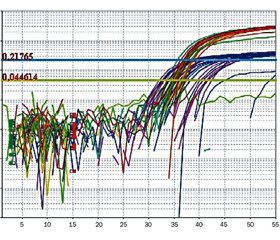
Ампліфікацію здійснювали за допомогою термоциклера «7500 Fast Real-Time PCR System» (Applied Biosystems, США) протягом 42 хв. Програма ампліфікації починалася з попередньої активації AmpliTaq Gold® ДНК-полімерази протягом 10 хв. при 95 °C та включала 45 циклів, кожен з яких складався з денатурації при 95 °C (19 с), приєднанні праймерів та елонгації при 58 °C (1 хв). Для конт–ролю специфічності проводили стадію дисоціації — послідовне підвищення температури від 58 до 95 °С із реєстрацією зниження інтенсивності флуоресценції комплексів дволанцюгових ДНК із SYBR Green. Аналіз даних проводився з 7500 Fast Real-Time PCR Software. Визначали відносний рівень експресії генів із застосуванням загальноприйнятої методики (рівень експресії = 2–ΔСt, де Ct — пороговий цикл ампліфікації) та отримували графічне зображення експресії основного та контрольного гена (рис. 1).
/25-1.jpg)
Інструментальні дослідження включали визначення рівня мальабсорбції лактози за допомогою водневого дихального тесту з навантаженням лактозою (з розрахунку 1 г/кг, але не більше 25 г лактози у вигляді 10% водного розчину) в ДЗ «Інститут гастроентерології» НАМН України (директор Ю.М. Степанов) за допомогою газоаналізатора Gastro + Gastrolyser британської компанії Bedfont Scientific Ltd. Вміст водню визначався в мільйонних частках — parts per million (ppm). Позитивним вважався тест при збільшенні рівня водню в повітрі, що видихається, через 60 хв більше ніж на 20 рmm порівняно з базальним рівнем і появою клінічних симптомів лактазної недостатності протягом трьох подальших годин спостереження.
Діти віком 6–18 років із різними SNP LCT та ожирінням становили основну групу спостереження (n = 70), тоді як діти без ожиріння — контрольну групу (n = 16). Залежно від результатів генотипування спочатку всі діти з ожирінням були розподілені на 3 групи спостереження: з генотипом С/С 13910 (n = 38), генотипом С/Т 13910 (n = 22) та генотипом Т/Т 13910 (n = 10), з подальшим об’єднанням дітей із фенотипово схожими генотипами С/Т та Т/Т 13910 в групу дітей з лактазною персистенцією. В той час як група дітей з генотипом С/С 13910 залежно від рівня мальабсорбції лактози асоціювалась з ЛН дорослого типу.
На подальшому етапі дослідження всіх дітей з генотипом С/С 13910 за результатом водневого дихального тесту з навантаженням лактозою розподілили на 2 підгрупи, репрезентативні за віком (13,7) та статтю (51 % хлопчиків): мальабсорберів (n = 20) та абсорберів лактози (n = 18). Всім пацієнтам з ожирінням була призначена терапія основного захворювання згідно з вітчизняним протоколом зі спеціальності «дитяча ендокринологія» за наказом МОЗ України № 254 від 27.04.2006 р. Додатково дітям з генотипом С/С 13910 з 1-го дня лікування була призначена низьколактозна дієта за допомогою створеної нами комп’ютерної програми «Low-lactose diet» та додатково рандомізовано обраним 10 дітям, мальабсорберам лактози, препарат екзогенної лактази протягом 1 місяця по 3000 МО тричі на добу [4].
Ефективність різних типів лікування оцінювалась за результатами дослідження експресії мРНК Gal-9 у дітей до та після лікування в зазначених групах.
Для статистичної обробки результатів дослідження використовувались методи варіаційної статистики за допомогою пакета комп’ютерних програм Microsoft Office Excel 2009, адаптованого для медико-біологічних досліджень. Параметричні методи статистики з розрахунком середньої арифметичної величини (М) та похибки репрезентативності середньої величини (m) застосовувались за умови нормального розподілу величин. Різниця параметрів при порівнянні кількісних показників із нормальним розподілом вважалася статистично значущою за критерієм Стьюдента при р < 0,05.
Результати та обговорення
Генотип С/С 13910 реєструвався у 38 (54,3 %), генотип С/Т 13910 у 22 (31,4 %) і генотип Т/Т у 10 (14,3 %) пацієнтів.
Мальабсорбція лактози у дітей з генотипом С/С 13910 становила в середньому 32,7 ± 10,4 рmm, у дітей з генотипами С/Т 13910 — 26,3 ± 4,9 рmm (р > 0,05) і при генотипі Т/Т 13910 та у дітей без ожиріння була відсутня (р < 0,05).
Середній рівень експресії мРНК Gal-9 у дітей з генотипом С/С 13910 дорівнював 564,3 ± 32,8 УО ∆mRNA Gal-9/mRNA actin, у дітей з генотипами С/Т і Т/Т 13910 — 61,04 ± 15,3 УО ∆mRNA Gal-9/mRNA actin, р < 0,01 (табл. 1).
/26-1.jpg)
Важливим є той факт, що в підгрупі дітей з генотипом С/С 13910 і мальабсорбцією лактози (n = 20) зареєстровано найнижчий середній рівень експресії мРНК Gal-9 (42,47 ± 13,30 УО ∆mRNA Gal-9/mRNA actin), тоді як у підгрупі дітей з генотипом С/С 13910 без мальабсорбції лактози (n = 18) — найвищий (1086,73 ± 52,60 УО ∆mRNA Gal-9/mRNA actin), що перебільшив рівень експресії мРНК Gal-9 у дітей без ожиріння та мальабсорбції лактози (313,34 ± 19,70 УО ∆mRNA Gal-9/mRNA actin), р < 0,01. Після використання препаратів екзогенної лактази у дітей з генотипом С/С 13910 та мальабсорбцією лактози протягом одного місяця рівень експресії мРНК Gal-9 наблизився до рівня 246,21 ± 15,70 УО ∆mRNA Gal-9/mRNA actin, тоді як при використанні лише низьколактозної дієти збільшився незначно — до 58,72 ± 21,10 УО ∆mRNA Gal-9/mRNA actin, р < 0,01. Цікаво, що у дітей з генотипом С/С 13910 без мальабсорбції лактози на фоні низьколактозної дієти рівень експресії мРНК Gal-9 знизився до рівня 388,38 ± 20,40 УО ∆mRNA Gal-9/mRNA actin, наблизившись до рівня здорових дітей без ожиріння.
Висновки
Надлишок лактози в дієті дитини викликає мальабсорбцію лактози, інгібує сигнальний шлях Gal-9/Tim-3 та сприяє прозапальному типу імунної відповіді на позаклітинному рівні.
У дітей з генотипом С/С 13910 рівень експресії мРНК Gal-9 залежить від мальабсорбції лактози, яка потребує замісної терапії, що поєднує низьколактозну дієту та використання препаратів екзогенної лактази.
За відсутності мальабсорбції лактози, використання лише низьколактозної дієти у дітей з генотипом С/С 13910 наближає рівень гіперекспресії мРНК Gal-9 до рівня здорових дітей без ожиріння.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Абатуров О.Є. Асоціація однонуклеотидного поліморфізму гена лактази з інсулінорезистентністю у дітей / О.Є. Абатуров, А.О. Нікуліна // Сучасні медичні технології. 2016; 4(31): 33-36.
2. Абатуров О.Є. Асоціація однонуклеотидного поліморфізму гена лактази з дисліпопротеїдемією при ожирінні у дітей / О.Є. Абатуров, А.О. Нікуліна // Современная педиатрия. 2017; 2(82): 118-121. doi: 10.15574/SP.2017.82.118.
3. Абатуров О.Є. Молекулярно-генетична концепція формування психотипів особистості у дітей при ожирінні, асоційованому з лактозною інтолерантністю / О.Є. Абатуров, А.О. Нікуліна // Здоровье ребенка. 2017; 4 (12); 17-22. doi: 10.22141/2224-0551.12.4.2017.1076222.
4. Абатуров О.Є. Дієтотерапія при ожирінні у дітей, асоційованому з лактазною недостатністю дорослого типу / O.Є. Абатуров, А.О. Нікуліна, Д.В. Логвінов, П.О. Колбасін // Здоровье ребенка. 2017; 12(6): 657-662; doi: 10.22141/2224-0551.12.6.2017.112833.
5. de Kivit S. Galectin-9 Produced by Intestinal Epithelial Cells Enhances Aldehyde Dehydrogenase Activity in Dendritic Cells in a PI3K- and p38-Dependent Manner / S. Kivit, A.I. Kostadinova et al. // J. Innate Immun. 2017; 9(6): 609-620. doi: 10.1159/000479817. Epub 2017 Sep 9.
6. de Kivit S. Intestinal Epithelium-Derived Galectin-9 Is Involved in the Immunomodulating Effects of Nondigestible Oligosaccharides / de Kivit S., Kraneveld A.D., Knippels L.M.J. et al. // J. Innate Immun. 2013; 5: 625-638. doi. org/10.1159/000350515.
7. Deng Y. Lactose Intolerance in Adults: Biological Mechanism and Dietary Management / Y. Deng, B. Misselwitz, N. Dai, M. Fox // Nutrients. 2015 Sep; 7(9): 8020-8035. Published online 2015 Sep 18. doi: 10.3390/nu7095380.
8. Han G. Tim-3: an activation marker and activation limiter of innate immune cells / G. Han, G. Chen, B. Shen, Y. Li // Front Immunol. 2013 Dec 10; 4: 449. doi: 10.3389/fimmu.2013.00449.
9. International Association for the Study of Obesity. Online database of national prevalence data from published national surveys [Electronic resource] / IASO // London. 2014. Аccess mode: http://www.iaso.org/site_ media/library/resource_images/Global_Childhood_Overweight_October_2013.pdf
10. Jacobs J. Immune Checkpoint Modulation in Colorectal Cancer: What's New and What to Expect / J. Jacobs, E. Smits, F. Lardon et al // J. Immunol. Res. 2015; 2015: 158038. doi: 10.1155/2015/158038.
11. Lhuillier C. Impact of exogenous galectin-9 on human T cells: contribution of the T cell receptor complex to antigen-independent activation but not to apoptosis induction / C. Lhuillier, C. Barjon, T. Niki, A. Gelin et al. // J. Biol. Chem. 2015 May 6; pii: jbc.M115.661272.
12. Liebert A. World-wide distributions of lactase persistence alleles and the complex effects of recombination and selection / A. Liebert, S. Lopez, B.L. Jones et al. // Hum. Genet. 2017 Nov; 136(11-12): 1445-1453. doi: 10.1007/s00439-017-1847-y. Epub 2017 Oct 23.
13. Ma C.J. Cis-Association of Galectin-9 with Tim-3 Differentially Regulates IL-12/IL-23 Expressions in Monocytes via TLR Signaling / C.J. Ma, G.Y. Li, Y.Q. Cheng et al. // PLoS One. 2013 Aug 14; 8(8): e72488. doi: 10.1371/journal.pone.0072488. eCollection 2013.
14. Misselwitz B. What is normal and abnormal in lactose digestion? / Misselwitz B., Fox M. // The Lancet Gastroenterology & Hepatology, Available online 7 July 2017. doi.org/10.1016/S2468-1253(17)30180-2.
15. Paasela M. Lactose inhibits regulatory T-cell-mediated suppression of effector T-cell interferon-γ and IL-17 production / M. Paasela, K.-L. Kolho, O. Vaarala et al. // British Journal of Nutrients. 2014; 112(11): 1819-1825.
16. Prentice A.M. Dairy products in global public health // Am. J. Clin. Nutr. 2014 May; 99(5 Suppl): 1212S-6S. doi: 10.3945/ajcn.113.073437.
17. Ridefelt P. Lactose intolerance: Lactose tolerance test versus genotyping / P. Ridefelt, L.D. Hakansson // Scand. J. Gastroenterol. 2005; 40: 822-826. doi: 10.1080/00365520510015764.
18. Sakuishi K. Emerging Tim-3 functions in antimicrobial and tumor immunity / K. Sakuishi, P. Jayaraman, S.M. Behar, A.C. Anderson et al. // Trends Immunol. 2011 Aug; 32(8): 345-9. doi: 10.1016/j.it.2011.05.003.
19. Styne D.M. Pediatric Obesity-Assessment, Treatment, and Prevention: An Endocrine Society Clinical Practice Guideline. D.M. Styne, S.A. Arslanian, E.L. Connor et al. // J. Clin. Endocrinol. Metab. 2017 Mar 1; 102(3): 709-757. doi: 10.1210/jc.2016-2573.
20. WHO European Childhood Obesity Surveillance Initiative (COSI) [Electronic resource] / WHO // Geneve. 2014. Аccess mode: http://www.euro.who.int/en/health-topics/ disease-prevention/nutrition/activities/monitoring-and-surveillance/who-european-childhood-obesity-surveillance-initiative-cosi.
21. WHO: Global Action Plan for the Prevention and Control of NCDs 2013-2020 [Electronic resource] / WHO // Geneve. 2013. Аccess mode: http://www.who.int/nmh/events/ncd_action_plan/en/.
22. Wijnhoven T.M. WHO European Childhood Obesity Surveillance Initiative 2008: weight, height and body mass index in 6-9-year-old children/ T.M. Wijnhoven, J.M. van Raaij, A. Spinelli et al. // Pediatr. Obes. 2013; 8: 79-97.

/25-1.jpg)
/26-1.jpg)