Резюме
Актуальність. Бронхообструктивний синдром (БОС), зокрема його повторний перебіг у дітей раннього віку, є актуальною проблемою сучасної педіатрії. Обтяжений алергологічний анамнез, прояви атопії традиційно розглядаються як фактори ризику повторних епізодів БОС, які, однак, присутні не в усіх випадках. Останнім часом обговорюється можлива роль вітаміну D (VD) у формуванні схильності до повторних епізодів БОС з огляду на його протиінфекційну дію, що забезпечується шляхом активації імунних механізмів. Мета: вивчення рівня забезпеченості VD і особливостей продукції інтерферону гамма (INF-γ) та інтерлейкіну-4 (IL-4) у сироватці крові в дітей раннього віку з повторними епізодами БОС. Матеріали та методи. Обстежені 120 дітей віком від 6 місяців до 3 років з клінічним діагнозом «гострий обструктивний бронхіт» (J20), які були розподілені на дві групи (I група — 60 дітей з епізодичним БОС, II група — 60 дітей із повторним БОС). Групу контролю становили 30 клінічно здорових дітей віком від 6 місяців до 3 років. Усім хворим проводили оцінку анамнестичних даних, у тому числі рівня інсоляції, ступеня тяжкості БОС за 12-бальною оціночною шкалою, загальне клінічне обстеження, пульсоксиметрію, розраховували прогностичний індекс бронхіальної астми (API). Лабораторні дослідження включали визначення на 2–3-й день захворювання концентрації 25-гідроксивітаміну D (25(OH)D) у сироватці крові електрохемілюмінесцентним методом на аналізаторі Cobas e411 (серійний номер 1041-24, виробник Roche Diagnostics GmbH, Німеччина), сироваткових концентрацій IFN-γ, IL-4 методом імуноферментного аналізу за допомогою наборів «ІФА-Бест» (виробник «Вектор-Бест», Російська Федерація) та загального кальцію (Са) за загальноприйнятою методикою. При аналізі отриманих даних використовували непараметричні статистичні критерії. Різниця між показниками, що порівнювались, вважалась вірогідною при р < 0,05. Результати. Більшість пацієнтів із повторним перебігом захворювання (56,7 %) мали 4 епізоди БОС за останні 12 місяців. Аналіз анамнестичних показників, у тому числі алергологічного анамнезу, не виявив суттєвих відмінностей між групами (p > 0,05). У 78,3 % пацієнтів II групи був негативний API. Тяжкий перебіг БОС удвічі частіше реєструвався серед дітей II групи порівняно з I групою (23,3 і 10,0 % відповідно, χ2 = 4,50, р = 0,034). Середній вміст 25(OH)D у сироватці крові у дітей I групи становив 33,0 (28,19; 41,97) нг/мл; II групи — 13,68 (7,96; 19,51) нг/мл (p < 0,001). Рівень забезпеченості VD у 75 % дітей II групи відповідав критеріям дефіциту, тоді як у I групі даний показник становив 6,6 % (χ2 = 57,98, p < 0,001). Виявлено обернену залежність між рівнем VD і частотою (r = –0,27, р = 0,002), та тяжкістю перебігу БОС (r = — 0,24, р = 0,008). Рівень загального Са в сироватці крові в обох групах був у межах нормальних величин. Середній рівень IFN-γ у дітей І групи становив 22,69 (8,98; 41,44) пг/мл та ІІ групи — 21,08 (8,57; 37,03) пг/мл, обидва показники були вищими, ніж у групі контролю, — 12,18 (5,31; 12,92) пг/мл (p = 0,016 для обох показників). Ми виявили, що досліджувані групи відрізнялись між собою за рівнем саплементації VD, показник якого становив 60 % у I групі та 5 % — у дітей II групи (p < 0,001). Середній вміст IL-4 у сироватці крові в дітей I групи був вірогідно вищим порівняно з відповідними показниками II групи та групи контролю (р = 0,012 за U-критерієм Манна — Уїтні для обох показників). Виявлено обернений кореляційний зв’язок між частотою БОС і вмістом IFN-γ у крові в дітей I групи (r = –0,45, р < 0,001) та між ступенем тяжкості БОС і сироватковою концентрацією IL-4 у дітей II групи (r = –0,28, р = 0,030). У пацієнтів із повторним БОС також був виявлений прямий кореляційний зв’язок між вмістом IL-4 та IFN-γ (r = 0,41, р < 0,001). Ніяких кореляцій між VD та імунологічними показниками ми не виявили. Висновки. БОС у дітей раннього віку переважно має вірусну етіологію. Тяжкий перебіг захворювання частіше зустрічається в дітей із повторними епізодами БОС, для переважної більшості яких характерний негативний прогностичний індекс бронхіальної астми. У 3/4 пацієнтів із повторним БОС рівень забезпеченості VD знаходиться в межах дефіциту. VD обернено корелює з тяжкістю й частотою епізодів БОС. На рівень забезпеченості вітаміном D у дітей раннього віку найбільше впливає рівень його саплементації. Перебіг БОС у дітей раннього віку супроводжується підвищенням рівня IFN-γ у сироватці крові в гострий період захворювання незалежно від частоти епізодів БОС в анамнезі. За вмістом IL-4 у сироватці крові досліджувані групи не відрізняються між собою, при цьому за наявності повторних епізодів даний показник прямо корелює з IFN-γ. Отже, IFN-γ і IL-4 суттєво не впливають на частоту та ступінь тяжкості БОС у дітей раннього віку на відміну від вітаміну D, що може розглядатися як предиктор тяжкого перебігу БОС і розвитку його повторних епізодів.
Актуальность. Бронхообструктивный синдром (БОС), в частности его повторное течение у детей раннего возраста, является актуальной проблемой современной педиатрии. Отягощенный аллергологический анамнез, проявления атопии традиционно рассматриваются как факторы риска повторных эпизодов БОС, которые, однако, присутствуют не во всех случаях. В последнее время обсуждается возможная роль витамина D (VD) в склонности к повторным эпизодам БОС с учетом его противоинфекционного действия, которое обеспечивается путем активации иммунных механизмов. Цель: изучение уровня обеспеченности VD и особенностей продукции интерферона гамма (INF-γ) и интерлейкина-4 (IL-4) в сыворотке крови у детей раннего возраста с повторными эпизодами БОС. Материалы и методы. Обследовано 120 детей в возрасте от 6 месяцев до 3 лет с клиническим диагнозом «острый обструктивный бронхит» (J20), которые были разделены на две группы (I группа — 60 детей с эпизодическим БОС, II группа — 60 детей с повторным БОС). Группу контроля составили 30 клинически здоровых детей от 6 месяцев до 3 лет. Всем больным проводили оценку анамнестических данных, в том числе уровня инсоляции, степени тяжести БОС по 12-балльной оценочной шкале, общее клиническое обследование, пульсоксиметрию, рассчитывали прогностический индекс бронхиальной астмы (API). Лабораторные исследования включали определение на 2–3-й день заболевания концентрации 25-гидроксивитамина D (25(OH)D) в сыворотке крови электрохемилюминесцентным методом на анализаторе Cobas e411 (серийный номер 1041-24, производитель Roche Diagnostics GmbH, Германия), сывороточных концентраций IFN-γ, IL-4 методом иммуноферментного анализа с помощью наборов «ИФА-Бест» (производитель «Вектор-Бест», Россия) и общего кальция (Са) по общепринятой методике. При анализе полученных данных использовали непараметрические статистические критерии. Разница между сравниваемыми показателями считалась достоверной при р < 0,05. Результаты. Большинство пациентов с повторным течением заболевания (56,7 %) имели 4 эпизода БОС за последние 12 месяцев. Анализ анамнестических показателей, в том числе аллергологического анамнеза, не выявил существенных различий между группами (p > 0,05). У 78,3 % пациентов II группы был отрицательный API. Тяжелое течение БОС в два раза чаще регистрируется среди детей II группы по сравнению с I группой (23,3 и 10,0 % соответственно, χ2 = 4,50, р = 0,034). Среднее содержание 25(OH)D в сыворотке крови у детей I группы составило 33,0 (28,19; 41,97) нг/мл; II группы — 13,68 (7,96; 19,51) нг/мл (p < 0,001). Уровень обеспеченности VD у 75 % детей II группы соответствовал критериям дефицита, тогда как в I группе данный показатель составлял 6,6 % (χ2 = 57,98, p < 0,001). Выявлена обратная зависимость между уровнем VD и частотой (r = –0,27, р = 0,002) и тяжестью течения БОС (r = –0,24, р = 0,008). Уровень общего Са в сыворотке крови в обеих группах находился в пределах нормальных величин. Средний уровень IFN-γ у детей I группы составлял 22,69 (8,98; 41,44) пг/мл, II группы — 21,08 (8,57; 37,03) пг/мл, оба показателя были выше, чем в группе контроля — 12,18 (5,31; 12,92) пг/мл (p = 0,016 для обоих показателей). Мы обнаружили, что исследуемые группы отличались между собой по уровню саплементации VD, показатель которого составлял 60 % в I группе и лишь 5 % — у детей II группы (p < 0,001). Среднее содержание IL-4 в сыворотке крови у детей I группы было достоверно выше по сравнению с соответствующими показателями II группы и группы контроля (р = 0,012 по U-критерию Манна — Уитни для обоих показателей). Мы обнаружили обратную корреляционная связь между частотой БОС и содержанием IFN-γ в крови у детей I группы (r = –0,45, р < 0,001); между степенью тяжести БОС и сывороточной концентрацией IL-4 у детей II группы (r = –0,28, р = 0,030). У пациентов с повторным БОС также выявлена прямая корреляционная связь между содержанием IL-4 и IFN-γ (r = 0,41, р < 0,001). Никаких корреляций между VD и иммунологическими показателями мы не обнаружили. Выводы. БОС у детей раннего возраста преимущественно имеет вирусную этиологию. Тяжелое течение заболевания чаще встречается у детей с повторными эпизодами БОС, для подавляющего большинства которых характерен отрицательный прогностический индекс бронхиальной астмы. У 3/4 пациентов с повторным БОС уровень обеспеченности VD находится в пределах дефицита. VD обратно коррелирует с тяжестью и частотой эпизодов БОС. На уровень обеспеченности витамином D у детей раннего возраста в наибольшей степени влияет уровень его саплементации. Течение БОС у детей раннего возраста сопровождается повышением уровня IFN-γ в сыворотке крови в острый период заболевания независимо от частоты эпизодов БОС в анамнезе. По содержанию IL-4 в сыворотке крови исследуемые группы не отличаются между собой, при этом при наличии повторных эпизодов данный показатель прямо коррелирует с IFN-γ. Таким образом, IFN-γ и IL-4 существенно не влияют на частоту и степень тяжести БОС у детей раннего возраста в отличие от витамина D, который может рассматриваться как предиктор тяжелого течения БОС и развития его повторных эпизодов.
Background. Broncho-obstructive syndrome (BOS), particularly, its recurrent course in young children, is an important question of modern pediatrics. The burdened allergic history, manifestations of atopy are traditionally considered as risk factors for recurrent episodes of BOS, which, however, are not present in all cases. Recently, the possible role of vitamin D (VD) in susceptibility to recurrent episodes of BOS is discussed due to its anti-infective effect that is provided by activating immune mechanisms. Thus, purpose of the research was to study VD level and peculiarities of interferon gamma (INF-γ) and interleukin (IL) 4 production in the blood serum of young children with recurrent episodes of BOS. Materials and methods. 120 children aged 6 months to 3 years with a clinical diagnosis of acute obstructive bronchitis (J20) were examined, they were divided into two groups (group I — 60 patients with episodic BOS, group II — 60 children with recurrent BOS). The control group consisted of 30 clinically healthy children from 6 months to 3 years old. All patients were evaluated for anamnestic data, including the level of insolation, the severity of BOS according to a 12-point scoring scale, general clinical examination, pulse oximetry, and the asthma predictive index (API) was calculated. Laboratory studies included determination of 25-hydroxyvitamin-D (25(OH)D) concentration in the blood serum on days 2 and 3 of the disease using an electrochemiluminescence method on the Cobas e411 analyzer (serial number 1041-24, manufactured by Roche Diagnostics GmbH, Germany), serum concentrations of IFN-γ, IL-4 by enzyme-linked immunosorbent assay method using IFA-Best sets (manufactured by Vector-Best, Russian Federation) and total calcium (Ca) according to the generally accepted method. Nonparametric statistical criteria were used in the analysis of the obtained data. The difference between the compared indicators was considered to be significant at a rate of p < 0.05. Results. Most patients with a recurrent course of the disease (56.7 %) had 4 episodes of BOS in the last 12 months. The analysis of anamnestic parameters, including the allergic history, did not reveal any significant differences between groups (p > 0.05). API was negative in 78.3 % of patients of group II. The severe course of BOS was observed among children of group II two times more often than in group I (23.3 and 10.0 %, respectively, χ2 = 4.50, p = 0.034). The mean of 25(OH)D in the blood serum in children of group I was 33.0 (28.19; 41.97) ng/ml and group II — 13.68 (7.96; 19.51) ng/ml (p < 0.001). The level of VD in 75 % of children in group II was considered as deficiency while in group I this indicator was 6.6 % (χ2 = 57.98, p < 0.001). The inverse correlation was found between VD level and the incidence (r = 0.27, p = 0.002) and severity of BOS (r = 0.24, p = 0.008). The level of total Ca in the blood serum in both groups was within the normal range. The mean level of IFN-γ in children of group I was 22.69 (8.98; 41.44) pg/ml and in group II — 21.08 (8.57; 37.03) pg/ml, both of which were higher than in the control group (12.18 (5.31; 12.92) pg/ml (p = 0.016 for both parameters). We revealed that the study groups differed by the level of VD supplementation, which was 60 % in group I and only 5 % in children of group II (p < 0.001). The mean serum level of IL-4 in group I was significantly higher in comparison to the corresponding parameters of group II and control group (p = 0.012 according to the Mann-Whitney U test for both indicators). The inverse correlation between the incidence of BOS and IFN-γ level in the blood was found in children of group I (r = –0.45, p < 0.001), and between severity of BOS and the serum IL-4 concentration — in group II (r = –0.28, р = 0.030). Direct correlation between IL-4 and IFN-γ (r = 0.41, p < 0.001) was revealed in patients with recurrent BOS. No correlation between VD and immunological indicators was found. Conclusions. BOS has predominantly viral etiology in young children. The severe course of the disease is more common in children with recurrent episodes of BOS although most of them have negative asthma predictive index. In 3/4 of patients with recurrent BOS, the level of VD is within the deficiency level. VD inversely correlates with severity and the incidence of BOS episodes. Vitamin D level in young children mostly depends on level of its supplementation. The course of BOS in young children is accompanied by increasing serum level of IFN-γ in the acute period of the disease regardless of the incidence of BOS episodes in the past medical history. Study groups do not differ from each other in the blood serum levels of IL-4 while in the presence of recurrent episodes, this indicator is directly correlated with IFN-γ. Thus, IFN-γ and IL-4 do not significantly affect the incidence and severity of BOS in young children, as opposed to vitamin D, which might be considered as a predictor of the severe course of BOS and development of its recurrent episodes.
Вступ
Бронхообструктивний синдром (БОС) вірусної етіології в дітей раннього віку є досить поширеною проблемою — його поширеність, за різними даними, становить 25–30 % [1], при цьому в 30–50 % випадків захворювання має повторний перебіг [2, 3]. Так, у Європі повторні епізоди БОС реєструються в 15 % дітей раннього віку, у Латинській Америці — у 25 % [4]. У той же час причини розвитку повторних епізодів БОС у дітей перших трьох років життя залишаються не до кінця зрозумілими. З одного боку, відомими факторами повторного перебігу БОС є прояви атопії та обтяжений сімейний алергологічний анамнез, за наявності яких є ризик формування бронхіальної астми в майбутньому. З іншого боку, у дітей, які не мають атопічних захворювань, повторні епізоди БОС можуть бути обумовлені як гіперреактивністю бронхів, так і рівнем забезпеченості вітаміном D (VD), дефіцит якого останнім часом пов’язують зі схильністю до частих респіраторних захворювань [5–7].
Останніми роками встановлено, що VD має протиінфекційну дію, яка забезпечується шляхом активації системи вродженого та адаптивного імунітету [8]. Відомо, що VD є прямим і непрямим регулятором Т-лімфоцитів, зокрема Т-лімфоцитів — хелперів (Тh) 1-го та 2-го типів, функціональний баланс яких зумовлює направленість імунної відповіді [8, 9]. Під впливом активних метаболітів VD відбувається зниження експресії Th1, що продукують прозапальні цитокіни, зокрема інтерферон гамма (IFN-γ), який бере участь у регуляції імунної відповіді й вираженості запальних реакцій, направлених на елімінацію вірусних агентів [10–12]. У свою чергу, недостатність VD може сприяти порушенню балансу між Th1 та Th2 [10], призводячи до підвищеної продукції протизапальних Th2-асоційованих цитокінів, зокрема інтерлейкіну-4 (IL-4), який впливає на секрецію IgE. Незважаючи на це, конкретної моделі, яка б пояснювала роль VD у розвитку повторних епізодів БОС у дітей, досі не існує. Лише в одиничних дослідженнях вивчалось прогностичне значення дефіциту або недостатності VD як предиктора повторного перебігу захворювання в дітей раннього віку, та результати їх неоднозначні, що визначає необхідність проведення подальших наукових досліджень.
Отже, метою нашого дослідження стало вивчення рівня забезпеченості VD та особливостей продукції INF-г і IL-4 у сироватці крові в дітей раннього віку з повторними епізодами БОС.
Матеріали та методи
Дослідження проводили на базі інфекційного відділення дітей раннього віку КЗ «Дніпропетровська дитяча міська клінічна лікарня № 6» ДОР у період із січня 2016 р. до квітня 2017 р. Усі обстежені 120 дітей віком від 6 місяців до 3 років із клінічним діагнозом «гострий обструктивний бронхіт» (J20) були розподілені на дві групи. I групу становили 60 дітей з епізодичним БОС (менше від 3 епізодів протягом попереднього року) та II групу — 60 дітей із повторним БОС (3 і більше епізоди протягом попереднього року).
Критерії включення дітей у дослідження:
— встановлений діагноз «гострий обструктивний бронхіт»;
— вік пацієнтів від 6 місяців до 3 років;
— належність до кавказької етнічної групи;
— інформована письмова згода батьків на участь у дослідженні.
Наявність хронічної респіраторної патології (вроджені аномалії, муковісцидоз, бронхолегенева дисплазія), затримку фізичного розвитку, недоношеність, вроджені та набуті імунодефіцитні захворювання, прояви рахіту, прийом системних глюкокортикостероїдів або антиконвульсантів в анамнезі розглядали як критерії виключення пацієнтів із дослідження.
Середній вік обстежених із БОС становив 20,52 ± 8,00 міс., при цьому в I групі даний показник становив 18,16 ± 7,6 міс., а в II групі — 22,86 ± 7,75 міс. (р > 0,05). Гендерне співвідношення: в обох групах хлопчики становили приблизно по 70 % від загальної кількості обстежених (р > 0,05).
Усім хворим проводили оцінку анамнестичних даних, ступеня тяжкості БОС за 12-бальною оціночною шкалою (Respiratory Score), загальне клінічне обстеження та пульсоксиметрію на другу або третю добу від початку захворювання. Наявність тахіпное оцінювали згідно з рекомендаціями Всесвітньої організації охорони здоров’я (ВООЗ, 2013). Для визначення ступеня тяжкості БОС використовували такі критерії: частота дихання (1–3 бали), наявність ретракції піддатливих місць грудної клітки та роздування крил носа (0–3 бали), диспное (0–3 бали), подовжений свистячий видих (wheezing) при аускультації (0–3 бали). Ступінь тяжкості БОС оцінювався як легкий при сумі в 1–3 балів, середньотяжкий — 4–7 балів, тяжкий — 8–12 балів [13]. У дітей з повторним перебігом захворювання визначали прогностичний індекс бронхіальної астми (Asthma Predictive Index — API), який вважається позитивним за наявності трьох і більше епізодів wheezing протягом року в поєднанні з одним великим (бронхіальна астма хоча б в одного з батьків, атопічний дерматит у дитини) або 2–3 малими критеріями, такими як еозинофілія крові, свистячі хрипи поза епізодом гострої респіраторної вірусної інфекції (ГРВІ), алергічний риніт [14]. Для оцінки рівня інсоляції визначали час перебування на сонці з 10-ї до 15-ї години дня з мінімальною тривалістю 15 хвилин [15]. Рівень інсоляції вважали низьким, якщо цей показник станови менше 15 діб на місяць, помірним — від 15 до 30 діб на місяць, а показник 30 діб і більше оцінювався як високий рівень інсоляції [16].
Лабораторні дослідження проводились у лікувально-діагностичному центрі ТОВ «Аптека медичної академії», вони включали визначення концентрації 25-гідроксивітаміну D (25(OH)D) в сироватці крові електрохемілюмінесцентним методом на аналізаторі Cobas e411 (серійний номер 1041-24, виробник Roche Diagnostics GmbH, Німеччина), сироваткових концентрацій IFN-γ та IL-4 методом імуноферментного аналізу за допомогою наборів «ІФА-Бест» (виробник «Вектор-Бест», Російська Федерація), загального кальцію (Са) в сироватці крові за загальноприйнятими методиками. Рівень забезпеченості VD оцінювали згідно з рекомендаціями Endocrine Practice Guidelines Committee (Holick M.F., 2011). Достатнім рівнем VD вважали показник 25(OH)D у сироватці крові 30 нг/мл і більше, недостатність VD діагностували при рівні 21–29 нг/мл, дефіцит визначали, якщо показник 25(OH)D у сироватці крові був нижчим від 20 нг/мл [17]. Дослідження вітамін-D-статусу більше ніж у 90 % пацієнтів із БОС проводили в зимово-весняний період. Імунологічні показники (IFN-γ і IL-4) та показники загального кальцію порівнювались з референтними значеннями, отриманими при дослідженні групи контролю. Для досліджень використовували венозну кров у кількості 5 мл, забрану вранці натще на другу або третю добу від початку захворювання.
Як групу контролю обстежено 30 клінічно здорових дітей від 6 місяців до 3 років, середній вік яких становив 20,50 ± 11,24 міс. Гендерне співвідношення було таким же, як і в досліджуваній групі: хлопчики становили 70 % від загальної кількості обстежених. Критеріями включення дітей у контрольну групу були відсутність хронічних захворювань, гострої респіраторної патології на момент огляду та епізодів БОС в анамнезі.
Для статистичної обробки отриманих результатів використовували програмне забезпечення Statistica 6.1 (серійний номер AGAR909 E415822FA) та Excel 2010. Для перевірки нормальності розподілу кількісних показників використовували критерій Шапіро — Уїлка з виправленням Ліллієфорса. Якісні показники подані у вигляді абсолютних величин та відсотків. У нашому дослідженні переважна більшість кількісних показників характеризувались типом розподілу, що відрізняється від нормального, для їх обробки використовувались непараметричні показники: медіана (Ме), нижній і верхній квартилі (Q25 та Q75). Вірогідність відмінностей відносних показників оцінювали за допомогою критерію χ2 Пірсона, для кількісних ознак використовували критерій Манна — Уїтні (U). Для визначення зв’язку між якісними показниками розраховували відношення шансів та показники рангової кореляції Спірмена між кількісними параметрами. Різниця між показниками, що порівнювалися, вважалась вірогідною при р < 0,05.
Проведення дослідження дозволено комісією з питань біомедичної етики ДЗ «Дніпропетровська медична академія МОЗ України».
Результати
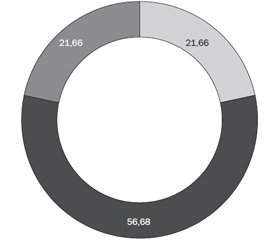
Проведений аналіз частоти виникнення БОС показав, що більшість пацієнтів II групи (56,6 %) мали 4 епізоди за останні 12 місяців (рис. 1). За нашими даними, 78,3 % дітей із повторними епізодами БОС мали негативний API, і лише в 6,7 % випадків даний індекс був позитивний, в інших 15 % випадків — невизначений.
При вивченні анамнестичних даних вірогідної різниці між показниками щодо прийому антибіотиків в анамнезі, перебігу вагітності, патології періоду новонародженості та частоти попередньої госпіталізації в стаціонар або відділення інтенсивної терапії серед пацієнтів I і II груп за критерієм χ2 Пірсона не виявлено (р > 0,05). Суттєвої різниці між групами щодо частоти виявлення атопічних захворювань також не відмічалось (16,6 % пацієнтів I групи та 15,0 % пацієнтів II групи, χ2 = 0,06, p = 0,802).
Аналіз динаміки респіраторної захворюваності хворих з БОС за останні 12 місяців показав, що середній показник кількість епізодів ГРВІ у другій групі був вірогідно вищим, ніж у першій (4,5 (3,0; 5,5) і 3 (2,0; 5,0) відповідно, р < 0,001 за U-критерієм Манна — Уїтні).
Згідно з результатами об’єктивного обстеження, в обох досліджуваних групах переважав середньотяжкий перебіг БОС, який відзначався в 50 % пацієнтів I групи та 65 % пацієнтів II групи (χ2 = 2,76, р = 0,097). У той же час тяжкий перебіг БОС удвічі частіше реєструвався серед дітей II групи порівняно з I групою (23,3 і 10,0 % відповідно, χ2 = 4,50, р = 0,034). Розрахунок показників співвідношення шансів показав, що ймовірність легкого перебігу захворювання в 5 разів вища в дітей з епізодичним БОС, ніж за наявності повторних епізодів БОС в анамнезі (OR = 5,04; 95% СІ 2,0–12,95; р < 0,05).
У структурі клінічної симптоматики захворювання більше ніж 90 % пацієнтів обох груп мали скарги на кашель, у 88,3 % випадків виявлено тахіпное під час фізикального обстеження (табл. 1).
Клінічні прояви дихальної недостатності II ступеня вірогідно частіше реєструвалися в дітей II групи порівняно з I групою (43,3 проти 13,3 % відповідно, χ2 = 13,30, р < 0,001). Рівень сатурації кисню крові (SpO2) у 96,7 % обстежених пацієнтів знаходився в межах нормальних величин (93–100 %), і лише в 3,3 % пацієнтів обох груп виявлено SpO2 ≤ 92 %.
Середній показник 25(OH)D у сироватці крові в дітей I групи становив 33,0 (28,19; 41,97) нг/мл, II групи — 13,68 (7,96; 19,51) нг/мл, тобто різниця між групами була статистично вірогідною (p < 0,001 за U-критерієм Манна — Уїтні). Отримані дані наведені в табл. 2.
Як видно з табл. 2, концентрація 25(OH)D у сироватці крові в дітей з епізодичним БОС не відрізнялась від референтних значень, отриманих від клінічно здорових дітей (р = 0,444 за U-критерієм Манна — Уїтні), тоді як у дітей з повторним БОС даний показник був вірогідно нижчим порівняно з групою конт–ролю (p < 0,001 за U-критерієм Манна — Уїтні).
Достатній рівень забезпеченості VD частіше реєструвався в дітей I групи, тоді як у II групі переважали діти, які мали дефіцит VD. Дані щодо статусу забезпеченості VD наведені в табл. 3.
Як видно з табл. 3, недостатній рівень VD майже з однаковою частотою зустрічався в обох досліджуваних групах (χ2 = 0,18, p = 0,673), проте дефіцит VD частіше мали пацієнти з повторним БОС (75 %) на відміну від дітей з епізодичним БОС, у яких даний показник не перевищував 6,6 % (χ2 = 57,98, p < 0,001). Також слід зазначити, що в 70 % дітей групи контролю відмічався достатній рівень 25(OH)D у сироватці крові, тобто 30 нг/мл і більше.
Вивчення соціально-демографічних показників, що впливають на рівень забезпеченості VD, показало, що за показниками тривалості грудного вигодовування й щоденних прогулянок, рівня інсоляції, куріння матері під час вагітності або після пологів досліджувані групи не відрізнялись між собою (р > 0,05). Єдиним анамнестичним показником, за яким відрізнялись досліджувані групи, був рівень саплементації VD на першому році життя та на момент огляду. Так, вітамін D3 у профілактичній дозі 500 МО на першому році життя отримували 80 % пацієнтів I групи, що практично вдвічі більше порівняно з пацієнтами II групи, у яких даний показник становив 43,3 % (χ2 = 28,48, р < 0,001). На момент дослідження більша частина дітей I групи (60 %) приймала вітамін D3 на відміну від пацієнтів II групи, серед яких цей показник був дуже низьким — 5 % (χ2 = 68,76, р < 0,001).
Отримані дані свідчать, що за наявності недостатнього рівня забезпеченості VD захворювання характеризувалось більш тяжким перебігом (рис. 2), що також підтверджує оберненій кореляційний зв’язок між рівнем 25(OH)D у сироватці крові та тяжкістю перебігу БОС (r = –0,24, р = 0,008).
Під час дослідження ми також виявили, що зниження рівня 25(OH)D у сироватці крові залежить від частоти епізодів БОС, про що свідчить наявність оберненого кореляційного зв’язку між даними показниками (r = –0,27, р = 0,002). Дані відображені на рис. 3.
Дослідження мінерального обміну показало, що за показником вмісту загального Ca в сироватці крові досліджувані групи не відрізнялись між собою й групою контролю (табл. 4).
Вивчення імунологічних показників показало, що середній рівень IFN-γ в сироватці крові в дітей I групи становив 22,69 (8,98; 41,44) пг/мл та II групи — 21,08 (8,57; 37,03) пг/мл, тобто вірогідної різниці між групами ми не виявили (р = 0,381 за U-критерієм Манна — Уїтні), обидва показники були вищими, ніж у групі контролю (p = 0,016 за U-критерієм Манна — Уїтні для обох показників). Отримані результати наведені в табл. 5. Середній показник IL-4 у сироватці крові в дітей I групи був вірогідно вищим порівняно з відповідними показниками II групи та групи контролю (р = 0,012 за U-критерієм Манна — Уїтні для обох показників).
Під час дослідження було виявлено прямий кореляційний зв’язок між вмістом IFN-γ і IL-4 у сироватці крові в дітей II групи (r = 0,41, р < 0,001). Результати наведені в табл. 6.
Кореляційний аналіз також показав, що в дітей I групи рівень IFN-γ обернено корелював із частотою БОС (r = –0,45, р < 0,001), а в дітей II групи подібний зв’язок виявлений між сироватковою концентрацією IL-4 і ступенем тяжкості БОС (r = –0,28, р = 0,030). Ніяких кореляцій між VD та імунологічними показниками ми не виявили.
Обговорення
Згідно з результатами нашого дослідження, у всіх обстежених пацієнтів БОС мав вірусну етіологію, основними симптомами якого були лихоманка, кашель, тахіпное та експіраторна задишка. Переважна більшість пацієнтів з повторним перебігом захворювання мали 4 епізоди бронхообструкції за останні 12 місяців, у яких, однак, прогностичний індекс розвитку бронхіальної астми був негативним. У більшої частини хворих (57,5 %) відмічався середньотяжкий перебіг БОС, що не супроводжувався розвитком вираженої дихальної недостатності. Розрахунок показників співвідношення шансів виявив, що ймовірність легкого перебігу захворювання набагато вища в дітей з одиничними епізодами БОС, ніж за наявності повторних епізодів в анамнезі. Водночас тяжкий перебіг захворювання вдвічі частіше зустрічається в дітей із повторним БОС, що, у свою чергу, може бути пов’язане як з особливостями імунної відповіді на розвиток ГРВІ, так і з рівнем забезпеченості VD. Останніми роками встановлено, що VD корелює з частотою й тяжкістю перебігу інфекційних захворювань вірусної етіології, оскільки бере участь в імунній відповіді на антигенні подразники [17–19].
Згідно з різними даними, дефіцит VD у дітей раннього віку з БОС коливається в межах від 12 до 73 %, при цьому результати щодо статусу VD у пацієнтів з повторним перебігом захворювання залишаються неоднозначними [20, 21]. За даними нашого дослідження, у 3/4 пацієнтів із повторним БОС рівень забезпеченості VD відповідає критеріям дефіциту, тоді як у пацієнтів з одиничними епізодами БОС даний показник не перевищує 6,6 %, для них у більшості випадків характерний достатній рівень забезпеченості VD. Ці дані збігаються з результатами дослідження Santosh Prasad et al. (2016), у якому 73,8 % пацієнтів з повторними епізодами БОС мали дефіцит VD [22]. Отримані дані щодо статусу вітаміну D і особливостей клінічної картини захворювання дозволяють припустити, що недостатність VD сприяє більш тяжкому перебігу БОС у дітей раннього віку. Ми також виявили, що рівень VD корелював не тільки з тяжкістю перебігу БОС, але й із частотою його епізодів. Так, середня концентрація 25(OH)D у сироватці крові має тенденцію до більш низьких показників при зростанні кількості епізодів БОС, при цьому за наявності 4 і більше епізодів за рік рівень забезпеченості VD знаходиться в межах дефіциту. Osama M. El-Asheer et al. (2016) у своєму дослідженні також продемонстрували подібний кореляційний зв’язок між вмістом VD у сироватці крові й частотою БОС [21]. Встановлено, що саме рівень саплементації VD найбільшою мірою впливає на рівень його забезпеченості. Так, у групі з епізодичним БОС частка пацієнтів, які приймали вітамін D3 у профілактичній дозі, на момент огляду була набагато більшою, ніж серед дітей з повторними епізодами БОС. Усі обстежені діти не мали клінічних проявів рахіту та порушень кальцієвого обміну.
Дослідження імунологічних показників не виявило суттєвої різниці між групами за рівнем IFN-γ і IL-4 як основних цитокінів Тh1 та Тh2. Перебіг БОС у дітей раннього віку супроводжується підвищенням у гострому періоді вмісту IFN-γ незалежно від частоти епізодів БОС в анамнезі, що свідчить про активацію Тh1-імунних реакцій, які направлені на елімінацію інфекційних агентів [23, 24]. Сироваткова концентрація IFN-γ у гострому періоді захворювання майже у два рази перевищувала відповідний показник здорових дітей. Рівень продукції IFN-γ у всіх пацієнтів не залежав від тяжкості перебігу, однак у групі з одиничними епізодами захворювання обернено корелював з частотою епізодів БОС в анамнезі, що, однак, не має суттєвого клінічного значення. Так, Ivane Chkhaidze et al. (2016) також продемонстрували, що IFN-γ не впливає на частоту повторних епізодів БОС у дітей раннього віку [25]. З іншого боку, середній рівень IL-4 у дітей з епізодичним БОС виявився вищим, ніж у пацієнтів з повторним БОС, у яких даний показник не відрізнявся від групи контролю. Різниця виявилась невеликою, але статистично значущою. Сироваткова концентрація IL-4 була нижчою при тяжкому перебігу БОС за наявності повторних епізодів в анамнезі, однак при цьому все ж таки знаходилась у межах нормальних показників і не корелювала з частотою епізодів БОС. Ми не виявили ознак переважання Тh2-імунної відповіді в дітей із повторним БОС, а також не виявили підвищеної схильності до розвитку атопічних захворювань у цій групі (за даними індивідуального та сімейного алергологічного анамнезу).
Під час дослідження ми також не виявили суттєвих взаємозв’язків між показниками цитокінового статусу й рівнем забезпеченості VD дітей раннього віку з БОС, що потребує подальших наукових досліджень. Слід зазначити, що в дітей з повторними епізодами БОС підвищення рівня IFN-γ в сироватці крові в гостру фазу захворювання супроводжувалось підвищенням рівня IL-4, що свідчить про нормальну взаємодію між Тh1 і Тh2 типу імунних реакцій у перебігу захворювання.
Отже, низький рівень VD є предиктором частих епізодів БОС, що узгоджується з результатами дослідження Uysalol et al. (2014), у якому було показано, що рівень 25(OH)D у сироватці крові був значно нижчим у дітей віком від 15 до 18 місяців з повторним БОС та позитивним API порівняно з дітьми, які не мали повторних епізодів БОС та мали негативний API [26]. Що стосується досліджуваних імунологічних показників, то жоден з них не може розглядатися як предиктор повторних епізодів БОС у ранньому віці.
Висновки
1. Повторні епізоди БОС у дітей раннього віку переважно пов’язані з ГРВІ. У більшої частини дітей з повторним БОС виявляється негативний прогностичний індекс бронхіальної астми.
2. Тяжкий перебіг захворювання частіше зустрічається в дітей з повторними епізодами БОС в анамнезі.
3. У дітей з повторним БОС вірогідно нижчий рівень забезпеченості вітаміном D, який у 75 % випадків відповідає критеріям дефіциту (нижче від 20 нг/мл у сироватці крові). Встановлено, що рівень вітаміну D обернено корелює як зі ступенем тяжкості БОС, так і з частотою його епізодів.
4. На рівень забезпеченості вітаміном D у дітей раннього віку найбільше впливає рівень його саплементації.
5. Перебіг БОС у дітей раннього віку характеризується підвищенням рівня IFN-γ в сироватці крові на 2-гу — 3-тю добу від початку захворювання незалежно від частоти епізодів БОС в анамнезі. Досліджувані групи не відрізняються між собою за вмістом IL-4 у сироватці крові, однак при тяжкому перебігу БОС за наявності повторних епізодів у анамнезі IL-4 має тенденцію до більш низьких показників і прямо корелює з концентрацією IFN-γ.
6. Взаємозв’язків між показниками цитокінового профілю (IFN-γ і IL-4) і рівнем забезпеченості вітаміном D не виявлено.
7. IFN-γ і IL-4 суттєво не впливають на частоту та ступінь тяжкості БОС у дітей раннього віку на відміну від сироваткового рівня 25(OH)D, який може розглядатися як предиктор тяжкого перебігу БОС і розвитку його повторних епізодів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про внесок кожного автора:
Больбот Ю.К. — концепція дослідження; Годяцька К.К. — збір та обробка матеріалів, написання тексту; Бордій Т.А. — дизайн дослідження, написання тексту.
Список литературы
1. Абатуров О.Є. Молекулярні механізми формування повторних гострих обструктивних бронхітів у дітей раннього віку / О.Є. Абатуров, О.О. Русакова // Медичні перспективи. — 2015. — Т. 20, № 2. — С. 88-94. — Режим доступу: http://nbuv.gov.ua/UJRN/Mp_2015_20_2_16.
2. Юлиш Е.И. О факторах риска развития бронхообструктивного синдрома у детей раннего возраста / Е.И. Юлиш, Ю.А. Сорока, О.Е. Чернышева // Здоровье ребенка. — 2012. — Т. 41, № 6. — С. 85-88.
3. Oо S. The wheezing child: an algorithm / Stephen Oo, Peter Le Souëf // Australian Family Physician. — 2015. — Vol. 44, № 6. — Р. 360-364. — Режим доступу до журн.: http://www.racgp.org.au/afp/2015/june/the-wheezing-child-an-algorithm.
4. Lasso-Pirot A. Early childhood wheezers: identifying asthma in later life / A. Lasso-Pirot, S. Delgado-Villalta, A.J. Spanier // J. Asthma Allergy. — 2015. — Vol. 44, № 8. — Р. 63-73. doi: 10.2147/JAA.S70066.
5. Vitamin D in the Healthy European Paediatric Population / Christian Braegger, Cristina Campoy, Virginie Colomb [et al.] // JPGN. — 2013. — Vol. 56, № 6. — Р. 692-701. doi: 10.1097/MPG.0b013e31828f3c05.
6. The role of vitamin D in chronic obstructive pulmonary di–sease, asthma and other respiratory diseases / J. Garsia de Tena, A. EI Hachem Debek, C. Hernandez Gutierrez [et al.] // J. Arch. Bronconeumol. — 2014. — Vol. 50, № 5. — Р. 179-184. doi: 10.1016/j.arbr.2014.03.015.
7. Дефіцит та недостатність вітаміну D: епідемологія, діагностика, профілактика та лікування / За ред. проф. В.В. Поворознюка, проф. П. Плудовські. — Донецьк: Видавець Заславський О.Ю., 2014. — 262 с.
8. Vitamin D and 1,25(OH)2D Regulation of T cells / Margherita T. Cantorna, Lindsay Snyder, Yang-Ding Lin [et al.] // Nutrients. — 2015. — Vol. 7, № 4. — Р. 3011-3021. doi: 10.3390/nu7043011.
9. Квашнина Л.В. Иммуномодулирующие эффекты витамина D у детей / Л.В. Квашнина // Здоровье ребенка. — 2013. — Т. 50, № 7. — С. 134-138.
10. Miyauchi K. Helper T сell responses to respiratory viruses in the lung: development, virus suppression, and pathogenesis / Kosuke Miyauchi // Viral Immunology. — 2017. — Vol. 30, № 6. — Р. 421-430. doi: 10.1089/vim.2017.0018.
11. Viral infections in allergy and immunology: How allergic inflammation influences viral infections and illness / Michael R. Edwards, Katherine Strong, Aoife Cameron [et al.] // The Journal of Allergy and Clinical Immunology. — 2017. — Vol. 140, № 4. — Р. 909-920. doi: 10.1016/j.jaci.2017.07.025.
12. Vojinovic J. Vitamin D — update for the pediatric rheumatologists / Jelena Vojinovic, Rolando Cimaz // Pediatric Rheumato–logy. — 2015. — № 13. — Р. 2-9. doi: 10.1186/s12969-015-0013-0.
13. Clinical Practice Guideline: The Diagnosis, Management, and Prevention of Bronchiolitis / Shawn L. Ralston, Allan S. Lieberthal, H. Cody Meissner [et al.] // Pediatrics. — 2014. — Vol. 134, № 5. — Р. 1474-1502. doi: 10.1542/peds.2014-2742.
14. International consensus on (ICON) pediatric asthma / N.G. Papadopoulos, H. Arakawa, K.-H. Carlsen [et al.] // The Journal of Allergy and Clinical Immunology. — 2012. — Vol. 67, № 8. — Р. 976-997. doi: 10.1111/j.1398-9995.2012.02865.x.
15. Holick Michael F. Vitamin D: A D-Lightful Vitamin for Health / Michael F. Holick // Endocrinol. Metab. — 2012. — Vol. 27, № 4. — Р. 255-267. doi: 10.1177/0148607111430189.
16. Association of vitamin D with respiratory outcomes in Canadian children / S.J. Niruban, K. Alagiakrishnan, J. Beach [et al.] // European Journal of Clinical Nutrition. — 2014. — Vol. 68, № 12. — Р. 1-7. doi: 10.1038/ejcn.2014.121.
17. Lee J. A review on vitamin D deficiency treatment in pediatric patients / Ji Yeon Lee, Tsz-Yin So, Jennifer Thackray // J. Pediatr. Pharmacol. Ther. — 2013. — Vol. 18, № 4. — Р. 277-291. doi: 10.5863/1551-6776-18.4.277.
18. Починок Т.В. Корекція дефіциту вітаміну D і його вплив на імунологічні та метаболічні порушення у дітей раннього віку, які страждають від частих респіраторних захворювань / Т.В. Починок // Здоров’я дитини. — 2016. — Т. 70, № 2. — С. 41-46.
19. Low serum 25-hydroxyvitamin D level and risk of upper respiratory tract infection in children and adolescents / Michelle Science, Jonathon L. Maguire, Margaret L. Russell [et al.] // Clinical Infectious Diseases. — 2013. — Vol. 57, № 3. — Р. 392–397. doi: 10.1093/cid/cit289.
20. Wranicz J. Нealth outcomes of vitamin D. Part I. Characte–ristics and classic role / Julia Wranicz, Dorota Szostak-Węgierek // Roczniki Państwowego Zakładu Higieny. — 2015. — Vol. 65, № 3. — Р. 179-184.
21. Serum vitamin D and IgE levels in infants and children under 2 years of age with recurrent chest wheeze / Osama M. El-Asheer, M.S.K. Tawfeek, Nafisa H. Abd Aziz et al. [et al.] // Egypt J. Pediatr. Allergy Immunol. — 2016. — Vol. 14, № 1. — Р. 15-21.
22. Prasad S.A Hospital Based Study to Establish the Correlation between Recurrent Wheeze and Vitamin D Deficiency Among Children of Age Group Less than 3 Years in Indian Scenario / S. Prasad, R. Rana, R. Sheth // J. Clin. Diagn. Res. — 2016. — Vol. 10, № 2. — Р. 18-21. doi: 10.7860/JCDR/2016/17318.7287.
23. Evaluation of airway reactivity and immune characteristics as risk factors for wheezing early in life / Weiguo Yao, Florencia M. Barbé-Tuana, Conrado J. Llapur [et al.] // J. Allergy Clin. Immunol. — 2010. — Vol. 126, № 3. — Р. 483-488. doi: 10.1016/j.jaci.2010.06.028.
24. Viral infections in allergy and immunology: How allergic inflammation influences viral infections and illness / Michael R. Edwards, Katherine Strong, Aoife Cameron [et al.] // The Journal of Allergy and Clinical Immunology. — 2017. — Vol. 140, № 4. — Р. 909-920. doi: 10.1016/j.jaci.2017.07.025.
25. Prognostic value of TH1/TH2 cytokines in infants with wheezing in a three year follow-up study / Ivane Chkhaidze, Dali Zirakishvili, Natalia Shavshvishvili [et al.] // Pneumonol. Alergol. Pol. — 2016. — Vol. 84, № 3. — Р. 144-150. doi: 10.5603/PiAP.2016.0016.
26. Uysalol M. Serum level of vitamin D and trace elements in children with recurrent wheezing:a cross-sectional study / Metin Uysalol, Ezgi Pasli Uysalol, Yasin Yilmaz // Pediatrics. — 2014. — № 14. — Р. 270-278. doi: 10.1186/1471-2431-14-270.

/92-1.jpg)
/93-1.jpg)
/94-2.jpg)
/94-1.jpg)
/95-1.jpg)