В усіх країнах світу відбувається неухильне зростання числа захворювань, обумовлених порушенням кальцій-фосфорного обміну. Передусім це стосується патології кістково-м’язової системи. Актуальність проблеми відображає той факт, що ВООЗ оголосила свого часу 2000–2010 рр. «декадою боротьби із захворюваннями кісток та суглобів» [10]. Крім того, інтерес до вивчення питань кальцієвого гомеостазу пояснюється участю кальцію в багатьох фізіологічних та біохімічних процесах, таких як підтримка цілісності й проникності цитоплазматичних мембран, регуляція синаптичної передачі, нервово-м’язової провідності, м’язового збудження та скорочення, підтримка тонусу парасимпатичної, симпатичної й центральної нервової системи, регуляція низки гормональних механізмів, контролю й активації ферментативних процесів, регенерація кісткової тканини, згортання крові, взаємодія типу «клітина — клітина», де кальцій (Са) виступає біологічним сигналізатором, інформаційною молекулою для багатьох процесів [1]. Особливістю гомео–стазу кальцію є те, що на певному рівні (побудова кісткової тканини, деякі регуляторні процеси) він виступає як макроелемент. В інших випадках (регуляція мембранного збудження, зв’язок збудження із секрецією) іон кальцію поводить себе як мікроелемент. Відомо, що рівень кальцію в сироватці крові стабільний в усі фізіологічні періоди життя людини, що робить його однією з найбільш досконалих констант організму. Але цей факт не означає, що потреба в цьому елементі також стабільна. Особливо це помітно в так звані критичні періоди життя, які визначаються в дитячому та похилому віці, коли спостерігається найбільший дисонанс між потребою та вживанням. Кальцієвий гомеостаз регулюється шляхом впливу на процеси всмоктування кальцію в кишечнику, його реабсорбції в нирках та мобілізації з кісткової тканини, а також кальцій-регулюючими гормонами (паратгормон, кальцитонін), рівнем фосфору й інших гормонів через їх вплив на обмін вітаміну D3 [2].
Значне поширення даної патології починається ще в дитячому віці. Низька мінеральна щільність кісткової тканини реєструється у 29–50 %, а уповільнення темпів дозрівання скелета — у 70 % школярів [11]. У структурі захворювань кістково-м’язової системи в дітей і підлітків порушення постави становлять 51,3 %, плоскостопість — 34,2 %, сколіоз — 11,2 %, остеохондроз — 3,4 %. Критичними етапами для формування генетично запрограмованого піку кісткової маси є перші три роки життя дитини та період статевого дозрівання.
Відомо, що становлення кальцієвого обміну в дитини проходить два основних етапи: внутрішньоутробний і постнатальний, кожен з яких має свої особливості.
На першому етапі важливим фактором є стан кальцій-фосфорного обміну в матері. В організмі вагітної жінки відбувається перерозподіл вітамінів з утворенням вітамінних депо в плаценті, а також підвищується потреба в кальції для плода, особливо в ІІІ триместрі вагітності.
Після народження, протягом 2–5 днів, відмічається транзиторна гіпокальціємія, яку можна пояснити функціональним гіпопаратиреоїдизмом. У частки дітей діагностують неонатальну гіпокальціємію, коли рівень Са в сироватці крові нижче від 1,75 ммоль/л. Необхідно відмітити, що на даному етапі основним джерелом наповнення запасів кальцію в організмі новонародженого є грудне молоко. Незважаючи на те, що вміст Са в грудному молоці в 4 рази нижчий, ніж у коров’ячому, грудне молоко має ідеальне співвідношення Са/Р, вміщує лактозу, що сприяє формуванню оптимального рН-середовища кишечника, забезпечує максимальну біодоступність мінеральних солей, при цьому коефіцієнт засвоєння Са із жіночого молока становить 60–70 %, що в 3–3,5 раза більше, ніж із коров’ячого [3, 4]. Але слід пам’ятати, що приблизно 6 % кісткової маси жінка втрачає в поперековому відділі хребта, якщо годує груддю понад 6 місяців. Для її відновлення необхідні високі дози Са — 1770 мг/добу [31, 32]. Матері абсорбують тільки третину Са, що приймають, при цьому кількість втраченого Са в організмі матері внаслідок його переходу в грудне молоко відповідає тій додатковій підтримці Са, яку отримує мати на добу. Матерям, які годують, рекомендується від 400 до 800 мг/добу [33, 34].
У дітей, які отримують штучне вигодовування, як і в дітей старших вікових груп, засвоєння Са з їжі значно нижче, ніж при грудному вигодовуванні. Це пояснюється тим, що в їжі та питній воді Са знаходиться у вигляді практично нерозчинних у водному середовищі сполук. Абсорбція кальцієвих сполук відбувається у верхньому відділі тонкого кишечника, переважно у дванадцятипалій кишці, за участю жовчних кислот [5].
При всмоктуванні в кишечнику Са з їжі включається у фізіологічні процеси, пов’язані як із ростом скелета, так і з підтримкою кальцієвого гомеостазу. У світі існують значні розбіжності у вмісті Са в їжі, у зв’язку з чим, а також зі змінами фізіологічної потреби у ньому впродовж життя (ріст, статеве дозрівання, вагітність, годування та менопауза) дуже важливо, щоб процес абсорбції Са в кишечнику був здатен до адаптації й реагування на зміни як харчових, так і фізіологічних чинників [18].
Абсорбція Са є результатом двох процесів: активного клітинного транспорту, в основному у дванадцятипалій та верхній порожній кишках, та пасивної дифузії в тонкій кишці, але в основному в клубовій кишці та дуже незначною мірою — у тонкій кишці (рис. 1) [19].
Система активного транспорту має властивості насичення й регулюється надходженням кальцію з їжею та потребами організму. Вона включає три етапи: проникнення крізь щіткову облямівку ентероцитів, дифузію в цитоплазмі та секрецію через базолатеральну мембрану до позаклітинної рідини [19]. У роботі системи активного транспорту кальцію беруть участь декілька протеїнів, в основному це епітеліальний кальцієвий канал (TRPV6) та протеїн, що зв’язує кальцій (CaBP-9K), ріст яких регулюється 1,25-дигідроксивітаміном D (1,25(OH)2D), активною формою вітаміну D [20]. Цей механізм відповідальний за більшу частину поглинання Са при прийомі його в низькій і помірній кількості [20].
Пасивна дифузія полягає в русі Са між клітинами слизової оболонки через міжклітинні стики чи простори й залежить від градієнтів концентрації люмінального/серозального Са [20]. Вона не має властивості насичення, і за умови, що Са знаходиться в абсорбованому вигляді, збільшується з ростом його споживання. Вона не залежить від рівня вітаміну D та віку [19].
Споживання є основним фактором, що визначає кількість абсорбованого Са [21]. Із збільшенням споживання росте кількість абсорбованого Са, але це співвідношення має нелінійний характер (рис. 1). Біля відмітки 500 мг/добу нахил кривої зменшується, що віддзеркалює насичення активної транс–портної компоненти поглинання. Подальший ріст абсорбованого кальцію з дозами понад 500 мг/добу відбувається за рахунок пасивної дифузії [21]. З обмеженням Са, що надходить з їжею, зменшується й абсорбована кількість, але росте його частка в загальному обсязі [21]. Наприклад, коли прийом був зменшений з 2000 до 300 мг (з 50 до 7,5 ммоль) на добу, показник абсорбції Са, тобто його частка, що знаходилась в організмі, відносно повної поглиненої кількості в здорових жінок збільшується з 27 до 37 % [22]. Ця адаптація потребувала від 1 до 2 тижнів й супроводжувалась зменшенням концентрації Са та ростом концентрації паратиреоїдного гормону і 1,25(OH)2D у сироватці крові [20].
Частка абсорбованого Са змінюється впродовж життя. Найбільш висока вона в дитинстві (близько 60 %) [23, 24], особливо на ранніх стадіях статевого дозрівання. Abrams і Stuff [25] виявили, що в дівчат білої раси, у яких середня потреба дорівнює близько 925 мг/добу, перед початком статевого дозрівання вона в середньому дорівнює 28 %, на ранніх стадіях дозрівання — 34 % (вік інтенсивного росту) і становить 25 % через 2 роки. У молодих статевозрілих осіб частка абсорбованого Са залишається приблизно на тому ж рівні (25 %), якщо не рахувати ріст впродовж двох останніх триместрів вагітності [26]. З віком ця частка поступово зменшується і в чоловіків, і в жінок [20]. У тому випадку, коли приймались менші кількості Са (тобто близько 500 мг/добу), були зафіксовані більш високі показники абсорбції: 45 % — у підлітків 10–14 років, близько 35–40 % — у дорослих, 55 % — у вагітних жінок, 30 % — у жінок після менопаузи, більше — у людей похилого віку [27]. У деяких етнічних групах спостерігалась більш висока абсорбція порівняно з особами білої раси європейського походження [28, 29].
Отже, на абсорбцію Са впливають ендогенні чинники, такі як вік, фізіологічний та гормональний статус, а також екзогенні, пов’язані з харчуванням. За даними американських дослідників, тільки 25 % хлопчиків і 10 % дівчат щодоби вживають недостатню кількість Са [19]. У будь-якому випадку необхідна присутність достатньої кількості вітаміну D3.
Вітамін D регулює адаптацію абсорбції Са до доз, що приймаються, з урахуванням потреб організму. Невеликі дози Са, необхідні для мінералізації кісток, стимулюють синтез 1,25(OH)2D, що збільшує поглинання Са кишечником. Цей механізм робить свій внесок у забезпечення рівня Са, достатнього для мінералізації кісток, у той же час жорстке регулювання 1,25(OH)2D дозволяє уникнути кальцієвого навантаження, враховуючи, що дози, які приймаються, можуть змінюватися в широкому діапазоні. Порушити роботу даного адаптаційного механізму можуть тільки дуже низькі дози (наприклад, менше ніж 300 мг/добу для дітей). Коли кількість Са стає недостатньою для підтримки його нормального рівня в сироватці крові й мінералізації кісток, розвиваються їх деформації з вторинним гіперпаратиреозом [30]. Оскільки 1,25(OH)2D — це ключовий елемент регуляторного механізму, стає зрозумілим, що основними факторами кишкової адаптації до потреб у Са є запаси його попередника 25(OH)D і ниркова активність 1α-гідроксилази.
Тому для ефективної абсорбції Са і підтримання його нормального рівня в крові необхідним є адекватний статус вітаміну D.
Як уже було відзначено, транспорт кальцію в органах травлення відбувається двома шляхами, що залежить від його кількості в раціоні. Якщо спостерігається надлишок кальцію в порожнині кишечника, то трансепітеліальний механізм забезпечує низьку його абсорбцію, хоча абсолютна кількість абсорбованого елемента може бути великою саме за рахунок його значного надходження парацелюлярним шляхом. За цих умов підвищується рівень внутрішньоклітинного кальцію, що супроводжується інгібуванням активності вітамін-D-гідроксилазних ферментів і, як наслідок, зниженням синтезу кальційзв’язуючого білка, що призводить до інгібування активного транспорту кальцію. При низькому вмісті кальцію в раціоні превалює активний шлях його транспорту, лімітований рівнем кальційзв’язуючого білка, синтез якого регулюється вітаміном D3.
Засвоєння Са залежить також і від віку. Відомо, що в дітей раннього віку в тонкому кишечнику всмоктується до 60 % Са, у підлітків — 34 %, у дорослих — 20–40 %, залишкова кількість проходить транзитом через кишечник.
У фізіологічних умовах потреба організму в кальції задовольняється за рахунок надходження його з їжею. Причому кількість елемента відповідає певному віковому періоду (табл. 1). Найбільшою мірою це стосується дітей у критичні періоди розвитку дитячого організму з активним процесом росту.
Отже, адекватне надходження Са необхідне протягом всього життя, і особливо:
— у період росту, коли в тілі відкладається значна кількість Са [12, 13]: упродовж перших 2 років життя зростання кількості Са в скелеті становить приблизно 100 мг/добу, а у віці 2–9 років — 120 мг/добу. Зростання триває й у період статевого дозрівання й досягає свого пікового значення 300–400 мг/добу [14];
— у період старіння, бо воно викликає втрату кісткової тканини, особливо в період менопаузи: остання супроводжується безперервною обов’язковою втратою Са близько 30 мг/добу [15–17], що призводить до негативного кальцієвого балансу та остаточної втрати кісткової тканини [14].
Порушення кальцієвого балансу може викликати не лише харчовий дефіцит, а й патологічні зміни в будь-якій ланці регуляції. Але завжди результатом буде або абсолютний дефіцит кальцію, або зниження його біологічної доступності. Цей факт пояснює наявність у клінічній педіатричній практиці варіантів безсимптомного перебігу аліментарного дефіциту кальцію з поступовою демінералізацією кісткової тканини, що підкреслює обмеженість компенсаторних можливостей дитини.
Підвищені вимоги до забезпечення дитячого організму кальцієм виникають не лише при патологічних процесах, а й у зв’язку з транзиторними остеопеніями в період пубертатного стрибка росту в критичні періоди розвитку (фізіологічна анемія в дітей першого року життя, остеоїдна гіперплазія в здорових дітей, що швидко ростуть, вегетативна дисфункція в періоди інтенсивного росту тощо). Усі ці випадки потребують корекції, а одним з найбільш ефективних засобів профілактики та лікування демінералізації кісткової тканини залишаються препарати кальцію.
Історично ідеологія корекції кальцієвого балансу спочатку базувалась на пероральному, а пізніше — й на парентеральному введенні його препаратів у дозах, еквівалентних фізіологічній потребі. Відомо [2, 6], що близько 30 % іонізованого кальцію надходить із шлунково-кишкового тракту, а депонується він на 99 % у кістках та зубах. У той же час 50 % загального кальцію сироватки крові становить саме іонізована форма, що є критичним фактором розвитку тетанічних судом. Лише 5 % кальцію входить до складу –аніонних комплексів, а 45 % зв’язано з білками. Отже, іонізований та білковозв’язаний кальцій перебувають в організмі в рівноважному стані.
Саме тому першими препаратами кальцію, що почали застосовуватись як фармакологічні препарати, були розчини простих кальцієвих солей із високим ступенем дисоціації (табл. 2).
Зокрема, це хлорид кальцію (CaCl2 ), який у вигляді 10% та 20% розчину застосовується в клінічній практиці до цього часу. Але виражена некротична (при потраплянні під шкіру або в м’язи) або подразнююча (при застосуванні per os) дія примусили фармакологів та лікарів звернутися до інших сполук кальцію. Це були кальцієві солі глюконової, карбонової, молочної кислоти. Фармакологічні властивості препаратів кальцію подані в табл. 3.
/103-1.jpg)
Лактат, гліцерофосфат та глюконат мали всі властивості донаторів іонів кальцію, але містили його лише від 9 до 19 %. Це забезпечувало протиалергічну, гемостатичну, антисудомну дію, але було не в змозі забезпечити покриття дефіциту елемента, потрібного для осифікації кісткової тканини. Найбільш перспективним щодо цього виявився карбонат кальцію, один грам якого забезпечує надходження в організм 400 мг іонізованого кальцію. Відомо, що саме карбонати добре розчинні в кислому середовищі та погано — в лужному. Тому на швидкість абсорбції кальцію значно впливає pH шлункового та кишкового соку, а всі фактори, що підвищують кислотність, сприяють кращому його всмоктуванню. Якщо в шлунку відбувається перетворення малорозчинних сполук кальцію із слабкими органічними кислотами в добре розчинний CaCl2, то у дванадцятипалій кишці інтенсивність процесів всмоктування зростає, тому що поєднання кальцію з хлором та фосфатами повинно відбутися до нейтралізації шлункового соку. При пасажі їжі по кишечнику на доступність для організму кальцію суттєво впливають іони магнію, алюмінію, заліза, що діють як антагоністи. Утруднюють всмоктування кальцію в кишечнику також фітинова кислота та жирні кислоти їжі, що утворюють нерозчинні солі та мила. Елімінаційними шляхами для підтримки балансу кальцію є кишечник та нирки. 80 % кальцію виводиться з калом, а 20 % — із сечею. Причому з калом виводиться як неабсорбований кальцій, так і його абсорбована частина, що виділяється з жовчю та панкреатичним секретом.
Але головним джерелом кальцію, що використовується організмом для підтримання необхідного його рівня, є кісткова тканина. Тому саме чутливість кісток до багатьох патологічних процесів відображує потребу організму в збереженні нормокальціємії, коли порушення гомеостазу кальцію та фосфору корегуються за рахунок скелета. Отже, стає очевидним, що препарати з різним вмістом кальцію повин–ні використовуватись або із замісною метою, або для корекції осмолярних процесів, алергії тощо. Із цих позицій ідеальними для корекції кальцієвого дефіциту в критичні періоди дитячого віку є комбіновані препарати, що містять карбонат кальцію та холекальциферол. Наявність фізіологічних доз вітаміну D3 дозволила добитися максимальної доступності для організму іонів кальцію як структурного елемента. Прикладом такого препарату може бути препарат Кальцикер виробництва «Індоко Ремедіс Лтд» для «Євро Лайфкер Лтд», Індія/Великобританія (табл. 3).
Отже, досить широкий спектр препаратів кальцію першого та другого покоління дозволяє не лише проводити корекцію низки патологічних процесів, а й використовувати їх для профілактики кальцієвого дефіциту у фізіологічні критичні періоди життя людини. У цьому випадку препаратами вибору є комбінації карбонату кальцію з вітаміном D. До сьогодні дискусійним питанням залишається дозування цих препаратів, точніше — кількість кальцію та вітаміну D3, оптимальна для засвоєння без перевантаження елімінаційних систем дитячого організму.
Відомо, що одним з критичних фізіологічних періодів дитячого віку є шкільний вік, коли адаптаційні процеси до систематичного навчання приводять до напруження всіх систем організму. Також доведено наявність у здорових дітей шкільного віку саме в цей період D-гіповітамінозу, який суттєво впливає на кальцій-фосфорний гомеостаз та молекулярну організацію клітинних мембран, що може сприяти розвитку захворювань і розцінюватись як преморбідний стан [6]. У той же час лікувально-профілактичні дози препаратів кальцію коливаються в широкому діапазоні й потребують наукового обґрунтування та оптимізації.
Саме тому нами було проведене дослідження фосфорно-кальцієвого обміну в динаміці у 125 дітей (7–10 років), під впливом препарату Кальцикер. Усім дітям проводилась калькуляція тижневого раціону з визначенням вмісту кальцію в продуктах харчування. При вираженому зниженні вітаміну D додатково призначались препарати вітаміну D3 (залежно від його рівня). Повторне обстеження дітей проводили через 6 тижнів.
Як показали проведені дослідження, 95 % здорових дітей мають недостатньо збалансоване харчування в якому має місце дефіцит кальцію (70 % дітей споживають Са у своєму раціоні в середньому від 90 до 420 мг на добу).
Рівень загального кальцію у сироватці крові визначали за допомогою біо-тест-набору виробництва фірми «Лахема». Рівень ультрафільтруючого кальцію розраховували за різницею між вмістом загального та зв’язаного з білками кальцію. Активність загальної лужної фосфатази визначали за допомогою біо-тест-набору виробництва «Лахема», у якому як субстрат використовується 4-нітрофенілфосфат. Уміст неорганічного фосфору в сироватці крові визначали за методом Dyce [8, 9].
Ступінь порушення D-вітамінного обміну в організмі оцінювали шляхом безпосереднього визначення рівня метаболіту вітаміну D3 25(ОН)D3, який, згідно з даними літератури, є показником ступеня забезпеченості організму вітаміном D, біохімічним методом за допомогою набору DIA Source Immuno Assays S.A., Бельгія.
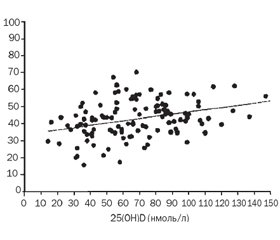
Як видно з наведених у табл. 4 даних, в обстежених дітей спостерігається гіпокальціємія, а рівень неорганічного фосфору в сироватці крові знаходиться в межах нормальних величин. Знаючи про роль кальцію в підтриманні багатьох фізіологічних процесів в організмі, можна твердити, що навіть такі зміни можуть призвести до порушень фізіологічного стану дитини. Враховуючи що активність лужної фосфатази в цих дітей була підвищеною (табл. 4), проведено визначення 25(ОН)D3, рівень якого нижче від 30 нг/мл спостерігався в 79 % дітей, а нижче від 20 нг/мл — у 47 % дітей.
/104-1.jpg)
Додатково дітям була проведена двохенергетична рентгенівська остеоденситометрія (іDXА, фірми Lunar) з визначенням Z-критерію, вираженого в одиницях стандартного відхилення від нормативу (SD). Відповідно до критеріїв ВООЗ, нормальну мінеральну щільність діагностують при Z-score > –1 SD, зниження (остеопенія) — при Z-score < –1 SD, але > –2,5 SD, остеопороз — при Z-score < –2,5 SD. Остеопенія визначена в 30 % обстежених дітей, остеопорозу не було встановлено.
Як видно з наведених даних (табл. 4), після проведеного курсу корекції комплексним препаратом кальцію й вітаміном D у дітей підвищився рівень загального кальцію в сироватці крові. Те, що діти отримували лише 500 мг кальцію в препараті при дефіцитному харчуванні, свідчить про високу ефективність препарату Кальцикер. Крім того, невеликі дози кальцію, які отримували діти, значно менше навантажують системи його елімінації, а також зменшують провокуючий момент розвитку гіперкальціємічних станів. У всіх обстежених дітей близько 80 % від загального кальцію припадає на частку ультрафільтруючої форми, тобто кальцію, що вільно проходить крізь мембрани. Можливо, це пов’язано з активізацією транспорту кальцію в кишечнику вітаміном D3 і/або підвищеною потребою в іонізованому кальції для фізіологічних процесів під час інтенсивного росту дітей. Зміна співвідношення різних форм кальцію типова для різних фізіологічних та патологічних станів організму, причому в період фізіологічно напруженого стану спостерігається зрушення вмісту кальцію в бік його біологічно активної форми. Рівень неорганічного фосфору в сироватці крові дітей після проведеного курсу практично не змінився. Але важливим показником мінерального обміну в організмі є визначення відношення кальцію до фосфору (після проведеного курсу це відношення зросло на 10 %).
На фоні корекції ми відмітили вірогідне зниження активності загальної лужної фосфатази. Причому на частку кишкового ізоферменту лужної фосфатази припадає близько 40 % від загальної, що вище за його рівень у дорослих людей [7]. Оскільки цей ізофермент лужної фосфатази забезпечує гідроліз різних моноефірів фосфорної кислоти, фосфор якої в ефірній формі не всмоктується, це може призвести до підвищення транспорту фосфору в кишечнику. Зниження активності кишкової лужної фосфатази, згідно з даним літератури, є маркером D-дефіцитних станів [6, 7], що підтверджує позитивну динаміку рівня 25(ОН)D3 у нашому дослідженні (табл. 4).
Отже, проведені дослідження свідчать, що в здорових дітей шкільного віку на фоні харчового дефіциту кальцію в критичні періоди розвитку існує латентна гіпокальціємія та D-гіповітаміноз, які суттєво впливають на кальцієвий гомеостаз, що може сприяти розвитку захворювань, насамперед кістково-м’язової системи.
Враховуючи, що останніми роками виявлені порушення спостерігаються в значної кількості дітей та підлітків, доводиться констатувати, що практична медицина не в змозі протистояти швидкому поширенню даної патології серед дітей. Крім того, втрачені можливості своєчасної профілактики виявлених порушень збільшують ризики патології в подальшому. Тому доцільним і необхідним є збільшення зацікавленості лікарів цією темою, виявлення груп ризику, упровадження сучасних методів діагностики й лікування, що своєчасно дозволить якісно вирішити дану проблему.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Справочник Харрисона по внутренним болезням / Под ред. К. Иссельбахера [и др.]. — СПб.: Питер Пресс, 1999. — 976 с.
2. Бауман В.К. Биохимия и физиология витамина D. — Рига: Зинатне, 1989. — С. 89-123.
3. Зоткин Е.Г., Мазуров В.И. Роль кальция и витамина Д в глобальной профилактике остеопороза и остеопоротических переломов // Реферативный мед. журн. — 2004. — Т. 12, № 7. — С. 1-8.
4. Кон Р.М., Рот К.С. Ранняя диагностика болезней обмена веществ. — М.: Медицина, 1986. — 637 с.
5. Маршалл В.Дж. Клиническая биохимия: Пер. с англ. — М.: Бином; СПб.: Невский диалект, 1999. — 368 с.
6. Апуховская Л.И., Омельченко Л.И., Стефанов М.В., Антипкин Ю.Г. Механизм биологического действия витамина D3: современные представления // Журн. АМН України. — 1996. — 2, № 1. — С. 15-33.
7. Вагнер В.К., Путилин М.В., Харабуга Г.Г. Методы и результаты исследования изоферментов (кишечной и печеночной фракций) сывороточной щелочной фосфатазы при острых хирургических заболеваниях органов брюшной полости // Вопр. мед. биохимии. — 1981. — 27, вып. 6. — С. 752-754.
8. Dyce B.S., Bessman S.P. A rapid nonenzymatic assay for 2,3-DPG in multiple speciment of blood // Environmental Health. — 1973. — 27, № 2. — P. 205-207.
9. Шилин Д.Е. Витамин-гормон D в клинике XXI века: плейотропные эффекты и лабораторная оценка / Д.Е. Шилин // Клин. лаб. диагностика. — 2010. — № 12. — С. 17-23.
10. Риггз Б.Л., Мелтон Л.Дж. Остеопороз: этиология, диагностика, лечение: Пер. с англ. — СПб.: БИНОМ: Невский диалект, 2000. — 560 с.
11. Щеплягина Л.А., Моисеева Т.Ю. Проблемы остеопороза в педиатрии: возможности профилактики // Рус. мед. журн. — 2003. — Т. 11, № 27. — С. 1554-1556.
12. Heaney R.P., Abrams S., Dawson-Hughes B., Looker A., Marcus R., Matkovic V. et al. Peak hone mass // Osteoporos. Int. — 2000. — 11(12). — 985-1009.
13. Bonjour J.P., Chevalley T., Ammann P., Slosman D., Rizzoli R. Gain in bone mineral mass in prepubertal girls 3.5 years after discontinuation of calcium supplementation: a follow-up study // Lancet. — 2001. — 358(9289). — 1208-1212.
14. FAO-WHO. Human vitamin and mineral requirements. Report of a joint FAO/WHO expert consultatoin. Food and Agricultural Organization of the United Nations/World Health Organization. — Bangkok, Thailand, 2001.
15. Devine A., Wilson S.G., Dick I.M., Prince R.L. Effect of vitamin D metabolites on intestinal calcium absorption and bone turnover in elderly women // Am. J. Clin. Nutr. — 2002. — 75(2). — 283-288.
16. Fomon S.J., Nelson S.E. Calcium, phosphorus, magnesium, and sulfur // Fomon S.J., editor. Nutrition of Normal Infants. — St. Louis: Mosby-Year Book, Ins., 1993. — 192-216.
17. Fox A.T., Du Toit G., Lang A., Lack G. Food allergy as a risk factor for nutritional rickets // Pediatr. Allergy Immunоl. — 2004. — 15(6). — 566-569.
18. Norman A.W. Intestinal calcium absorption: a vitamin D-hormone-mediated adaptive response // Am. J. Clin. Nutr. — 1990. — 51(2). — 290-300.
19. Gueguen L., Pointillart A. The Bioavailability of Dietary Calcium // J. Am. Coll. Nutr. — 2000. — 19(90002). — 119S-136.
20. FNB IOM. Dietary reference intakes for calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride.Standing Committee on the Scientific Evaluation of Dietary Reference Intakes, Food and Nutrition Board, Institute of Medicine. — Washington, D.C., National Academy Fress, 1997.
21. Weaver C.M., Heaney R.P. Calcium in human health. — Totowa, NJ: Humana Press, 2006.
22. Dawson-Hughes B., Harris S., Kramich C., Dallal G., Rasmussen H.M. Calcium retention and hormone levels in black and white women on high- and low-calcium diets // J. Bone Miner. Res. — 1993. — 8(7). — 779-787.
23. Fomon S.J., Nelson S.E. Calcium, phosphorus, magnesium, and sulfur // Fomon S.J., editor. Nutrition of Normal Infants. — St. Louis: Mosby-Year Book, Inc., 1993. — 192-216.
24. Adrams S.A., Wen J., Stuff J.E. Absorption of calcium, zinc, and iron from breast milk by five- to seven-month-old infants // Pediatr. Res. — 1997. — 41(3). — 384-390.
25. Adams S.A., Stuff J.E. Calcium metabolism in girls: current dietary intakes lead to low rates of calcium absorption and retention during puberty // Am. J. Clin. Nutr. — 1994. — 60(5). — 739-743.
26. Heaney R.P., Recker R.R., Stegman M.R., Moy A.J. Calcium absorption in women: relationships to calcium intake, estrogen status and age // J. Bone Miner. Res. — 1989. — 4(4). — 469-475.
27. Martin A. Apports Nutritionnels Conseillés pour la population française. — 3rd ed. — Tec & Doc, 2001.
28. Abrams S.A., O’Brien K.O., Liang L.K., Stuff J.E. Diffe–rences in calcium absorption and kinetics between black and white girls aged 5–16 years // J. Bone Miner. Res. — 1995. — 10(5). — 829-833.
29. Bryant R.J., Wastney M.E., Martin B.R., Wood O., –McCabe G.P., Morshidi M. et al. Racial Differences in Bone Turnover and Calcium Metabolism in Adolescent Females // J. Clin. Endocrinol. Metab. — 2003. — 88(3). — 1043-1047.
30. Pettifor J.M., Ross F.P., Travers R., Glorieux F.H., DeLuca H.F. Dietary calcium deficiency: a syndrome associated with bone deformities and elevated serum 1,25-dihydroxyvitamin D concentration // Metab. Bone Relat. Res. — 1981. — 2. — 301-305.
31. Affinito P., Tommaselli G.A., di Cario C. et al. Changes in bone mineral density and calcium metabolism in breastfeeding women: a one year follow-up study // J. Clin. Endocrinol. Metab. — 1996. — № 81. — 2314-2318.
32. Hayslip C.C., Klein T.A., Wray H.I. et al. The effects of lactation on bone mineral content in health postpartum women // Obstet. Gynecol. — 1989. — № 73. — 588-592.
33. Prentice A. Maternal calcium requirements during pregnancy and lactation // Am. J. Clin. Nutr. — 1994. — № 59. — 477-482.
34. Prentice A. Maternal calcium metabolism and bone mineral status // Am. J. Clin. Nutr. — 2000. — № 71. — 1312-1316.

/101-1.jpg)
/102-1.jpg)
/103-1.jpg)
/104-1.jpg)