Вступ
Незважаючи на успіхи, досягнуті в розумінні патофізіології атопічних реакцій, мультифакторність атопічного дерматиту вимагає подальшого дослідження його патогенетичних основ.
Теорії генетичного детермінування, клітинного і гуморального імунного реагування, мікробіомного дисбалансу, психовегетативних реакцій у даний час не повною мірою пояснюють особливості клінічних проявів атопії, що було підставою до вивчення впливу метаболічних процесів у розвитку захворювання.
Поряд з бар’єрною, рецепторною, терморегулюючою, імунною, дихальною, резорбтивною і видільною функцією шкіра бере важливу участь у різних метаболічних процесах, обміні вуглеводів, білків, ліпідів, води, вітамінів і мінеральних речовин, за інтенсивністю незначно поступається печінці й м’язовій системі [6]. Певною мірою така багатофункціональність може визначати й широту патологічних процесів, що виникають у шкірі та інших органах виведення [4, 7].
Найчастіше алергічна патологія розвивається у контексті атопічного маршу, де початковим етапом є шкірні прояви атопії, що поступово трансформуються або доповнюються респіраторними симптомами [5]. Очевидно, в основі різних алергічних реакцій лежать спільні патофізіологічні механізми [2, 4], а наявність супутніх метаболічних зрушень впливає на клінічні ознаки та спричинює додаткове навантаження на системи виведення.
Існує думка, що імунологічні зсуви, що притаманні процесам атопії, відбуваються під впливом гомеостатичних порушень, пов’язаних саме із надмірним накопиченням і виділенням акумульованих продуктів обміну речовин [8, 12]. Так, у роботах Г.Б. Федосєєва, Л.О. Шайлієвой (2013) показано вплив порушеного метаболізму щавлевої кислоти на формування і перебіг бронхіальної астми. Авторами зроблено висновок щодо участі органів дихання в процесах виділення оксалатів і показано вплив порушеного оксалатного обміну на клінічний перебіг алергічного захворювання [12].
Аналіз коморбідності при атопічних станах [9–11] демонструє високу частоту поєднання атопічного дерматиту із дисметаболічною оксалатно-кальцієвою нефропатією у дитячому віці [1–3].
З огляду на це цікавим є визначення особливостей обміну щавлевої кислоти та впливу його порушень на перебіг атопічного синдрому.
Мета роботи: вивчення особливостей клінічного перебігу та морфофункціонального стану шкіри у дітей з атопічним дерматитом, асоційованим із оксалатно-кальцієвою кристалурією (ОКК).
Матеріали та методи
У результаті скринінгу було відібрано та обстежено 45 дітей віком від 3 до 12 років з атопічним дерматитом та супутньою оксалатно-кальцієвою кристалурією. В процесі обстеження з’ясовували клініко-анамнестичні дані, аналізували вираженість специфічних ознак (за шкалами SCORAD, BRS) і поряд із загальноклінічними методами дослідження проводили визначення рівня IgE (за допомогою методу імуноферментного аналізу), виявляли причинно-значущі алергени (методиками in vitro), визначали концентрації оксалату у сечі (за методикою Сіворіновського А.Г.) і конденсаті повітря, що видихається (КВП). Морфофункціональний стан шкіри дітей і ступінь її гідратації досліджували неінвазивно методом корнеометрії з послідовною оцінкою показників, виміряних на 5 симетричних ділянках (відповідно до характеристик прибору рівень вологості розцінювали як високий при значенні більше 45,0, нормальний — від 30,0 до 44,9 та низький — менше 30,0).
Дослідження були проведені відповідно до прийнятих етичних принципів щодо медичного обстеження дитини. Від батьків усіх пацієнтів, які брали участь в дослідженні, було отримано письмову інформовану згоду на проведення досліджень. Статистична обробка отриманих результатів проводилася за допомогою методів варіаційної статистики з використанням пакета прикладних програм Microsoft Excel, Statistica.
Результати та обговорення
Проведений для відбору пацієнтів попередній скринінг показав, що дисметаболічні ознаки у вигляді оксалатно-кальцієвої кристалурії зустрічаються майже у 2/3 дітей з атопічним дерматитом. Визначення впливу порушень щавлевокислого метаболізму на перебіг атопічного дерматиту проводили порівнянням клініко-лабораторних характеристик у 45 дітей із супутньою оксалатно-кальцієвою кристалурією — основна група та 28 пацієнтів без дисметаболічної нефропатії — контрольна група.
Вірогідних вікових відмінностей в групах порівняння не виявлено, але середній вік пацієнтів в основній групі виявився дещо більшим, ніж у групі контролю, — відповідно 8,2 ± 1,2 та 7,8 ± 2,5 року. У той же час строки маніфестації атопічного дерматиту, поєднаного з ОКК, припадали на більш ранній час. Так, за анамнестичними даними малюкова форма атопічного дерматиту в основній групі була документована у 21 дитини (46,6 %; 95% довірчий інтервал (ДІ) 44,4–48,7) та лише у 6 випадках (21,4 %; 95% ДІ 19,1–23,6) — у групі контрою (χ2 = 3,7; p = 0,05).
Отримані дані підтверджують, що вікові особливості клінічного перебігу атопічного дерматиту асоціюються з певними метаболічними процесами, характерними для конкретного віку, що показано у деяких дослідженнях [3]. Наприклад, прояви малюкової форми більшою мірою пов’язані з особливостями функціонування лімфоїдної системи, анатомо-функціональними характеристиками шкіри і незрілістю ферментів травної системи, натомість на розвиток підліткової форми атопічного дерматиту істотно впливають ендокринні зміни, що відбуваються в організмі у даний період, зокрема секреторна активність кортизолу, інсуліну, трийодтироніну, тироксин-глобуліну та ін.
Отже, ранній початок клінічних проявів у групі обстежених дітей можна пояснити підвищеною чутливістю імунних факторів до метаболічних зсувів, що проходять в умовах функціональної незрілості систем виведення.
Згодом значущість анатомо-функціональної незрілості зменшується, і фактори імунної реактивності, що визначають активацію синтезу IgE антитіл, T-хелперну орієнтованість алергічного запалення, секрецію прозапальних цитокінів, створюють основу для розвитку дитячої форми атопічного дерматиту. Однак і в цьому періоді вплив обмінних розладів триває, а сукупна дія імунних і метаболічних факторів позначається на особливостях перебігу захворювання.
За гендерними ознаками групи вірогідно не відрізнялися: в обох випадках кількісно переважали дівчаток, співвідношення хлопчиків і дівчаток становило 1 : 1,8 — в основній групі та 1 : 2,5 — у контрольній. В основній групі дітей перебіг атопічного дерматиту легкого ступеня встановлено у 4 (8,8 ± 4,2 %) дітей, середнього ступеня тяжкості — у 33 (73,3 ± 6,5 %), тяжкий перебіг — у 8 (17,7 ± 5,7 %) обстежених. Аналогічні результати виявлялась й у контрольній групі (14,3 ± 6,6 %, 67,8 ± 8,8 %, 17,8 ± 7,2 % відповідно) з тенденцією до збільшення хворих із легким ступенем тяжкості і одночасним зниженням чисельності пацієнтів із перебігом середньої тяжкості.
Клінічні особливості атопічного дерматиту в усіх випадках характеризувалися наявністю полівалентної сенсибілізації. Здебільшого визначався зв’язок маніфестації захворювання із впливом харчових алергенів. За даними алерготестування, частота позитивних результатів за панеллю харчових алергенів становила: овочі та фрукти — 76,9 % (найбільш часто — картопля), крупи — 67,7 % (переважно пшеничне борошно), яйця (курячі) — 61,5 %, м’ясо (курка, яловичина, свинина, кролик) — 44,6 %, морепродукти (частіше креветки) — 32,3 %, молоко — 24,6 %, шоколад — 21,5 %, горіхи — 15,4 %, цитрусові — 12,3 %. У групі пацієнтів з ОКК серед харчових алергенів найбільш значущими виявилися м’ясо курки, кролика, креветки. Позитивні проби з нехарчовими алергенами в основній групі зареєстровані в 57,7 % випадків, при цьому реакцію на епідермальні алергени виявлено у 65,4 % дітей, на домашній пил — у 30,7 %, на пилок рослин — у 26,9 % обстежених. Серед причин поточного загострення найбільш часто вказувалося на порушення елімінаційної дієти (71,2 %), недотримання правил догляду за шкірою (19,2 %).
Вивчення спадкового анамнезу в основній групі обстеження дозволило виявити обтяженість з алергопатології у 91,1 ± 4,2 % пацієнтів. Атопічний дерматит у родичів першої лінії діагностований у 46,6 % випадків, алергічний риніт — у 36,5 %, бронхіальна астма — у 24,4 %. У 8 дітей (19,5 %) обидва батьки страждали від алергії.
Індекс спадкової обтяженості з алергопатології у сім’ях дітей обох груп майже не відрізнявся і становив 0,39 в основній групі та 0,45 — у групі контролю. У той же час метаболічні захворювання у сімейному анамнезі зустрічалися вірогідно частіше в основній групі (χ2 = 5,07; p = 0,02), а індекс обтяженості з обмінних хвороб (сечокам’яна хвороба, дисметаболічна нефропатія, жовчнокам’яна хвороба, ожиріння) був суттєво вищим у дітей з ОКК і становив 0,5 проти 0,2 у групі контролю.
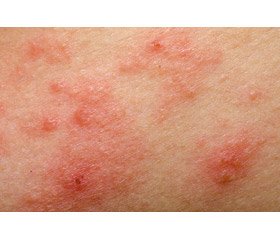
При об’єктивному обстеженні було встановлено, що у більшості випадків спостерігалась еритематозно-сквамозна форма (62,2 ± 7,2 %). Величина індексу SCORAD у пацієнтів основної групи перевищувала аналогічний показник у дітей без супутніх порушень обміну щавлевої кислоти, не досягаючи порога вірогідності.
Оцінка тяжкості захворювання з урахуванням індексу SCORAD виявила, що середня кількість балів дорівнювала 41,8 ± 8,3, а рівень даного показника у більшості хворих відповідав середньому ступеню тяжкості атопічного дерматиту, але центральна тенденція за медіаною була дещо вищою (Me = 47). Складові SCORAD за середніми показниками становили: площа ураження шкіри — 23,1 ± 8,7 %, загальна оцінка об’єктивних даних — 9,0 ± 2,1 бала, інтенсивність свербіння — 4,3 ± 1,0 бала, якість сну — 1,5 ± 1,0 бала. Порівняння із контролем майже не виявило суттєвих розбіжностей за групами (табл. 1), лише інтенсивність свербіння була більш вираженою у дітей основної групи (4,3 проти 1,8; р < 0,05) і спостерігалась у більшої кількості хворих (χ2 = 3,84; р = 0,004).
/65-1.jpg)
Детальний аналіз вираженості свербіння та пов’язаних із ним порушень повсякденного життя за індексом BRS показав, що у пацієнтів основної групи загальна сума балів BRS майже вдвічі перевищувала аналогічний показник групи контролю — 6,4 та 3,2 відповідно.
Оцінка функціонального стану шкіри при визначенні діелектричної постійної рогового шару показала, що рівень загальної зволоженості у пацієнтів основної групи був знижений на 35,5 % порівняно із нормативними показниками, а сумарний бал корнеометрії становив 25,8 ± 0,8 та виявився нижчим, ніж у контрольній групі (30,1 ± 0,4).
Аналіз лабораторних маркерів алергічних реакцій демонстрував наявність у 75,5 ± 6,4 % дітей основної групи підвищеного рівня IgE, середній вміст якого становив 266,5 U/ml, що було у 1,8 раза нижче, ніж в групі контролю, де аналогічний показник досягав 475,6 U/ml. Незважаючи на те, що загальні показники IgE були не надто високими при ОКК, його гіперпродукція асоціювалась із більш тяжким перебігом атопічного дерматиту, це свідчило про потенціюючий вплив атопічних реакцій та метаболічного дисбалансу на клінічні прояви захворювання (χ2 = 5,63; p = 0,018).
Для оцінки значущості дисметаболізму щавлевої кислоти у розвитку алергічних процесів аналізували рівень добової екскреції оксалатів із сечею. Згідно з отриманими результатами, підвищений рівень екскреції оксалатів виявлено у 13 (33,3 ± 7,0 %) обстежених. При цьому анамнестичні дані 77,7 % дітей містили інформацію щодо персистуючого сечового синдрому з оксалатно-кальцієвою кристалурією.
Вивчення перебігу алергічного захворювання у контексті атопічного маршу показало, що 7 (15,5 %) дітей основної групи мали алергічний риніт, 17 (37,7 %) — бронхіальну астму, 4 (8,8 %) — поєднані прояви респіраторного алергозу. Очевидно виявлена у обстежених дітей з ОКК сенсибілізація до інгаляційних алергенів зумовлює ймовірність прогресування атопічного маршу з розвитком респіраторних алергічних реакцій. Маючи в основі схожі патогенетичні механізми у вигляді локальної гіперпродукції інтерлейкінів 4, 5 із пошкодженням як респіраторного епітелію, так і кераноцитів шкіри, поєднані шкірно-респіраторні прояви алергії свідчать про більш тяжкий перебіг атопічного синдрому, а також вплив на його розвиток не тільки імунних, але й метаболічних факторів.
Враховуючи єдність патофізіологічних механізмів та морфофункціональну схожість систем виведення, проводили дослідження екскреції похідних щавлевої кислоти за вмістом оксалатів в сечі і конденсаті повітря, що видихається. Отримані дані порівнювали з результатами пацієнтів з еволюцією атопічного маршу, в яких поряд з атопічним дерматитом було діагностовано бронхіальну астму (БА) (табл. 2).
Підвищення рівня оксалатів у досліджуваних зразках вказувало на внесок іритативного впливу кристалів оксалату у механізми бронхообструкції у дітей з атопією, а також підтверджувало залучення експіраторних систем у транспорт метаболітів щавлевої кислоти. Отримані дані збігаються з результатами інших робот, в яких доведено вплив порушень обміну щавлевої кислоти на розвиток алергічної патології, зокрема респіраторного оксалозу [12].
З огляду на виявлені системні прояви у вигляді дисметаболічної оксалатно-кальцієвої кристал–урії і підвищення екскреції оксалатів з сечею та експіратом конденсату повітря, при обстеженні дітей звертали увагу на присутність симптомів гіпероксалурічного фенотипу: молочно-білий колір шкіри, пігментація на шкірі верхньої третини спини, нападоподібний виснажливий кашель під час гострої респіраторної патології, функціональні розлади біліарного тракту в анамнезі, певні ознаки яких були виявлені у 20 % пацієнтів (χ2 = 4,67; p = 0,031).
Очевидно, отримані дані підтверджують системність дисметаболічних проявів та наявну скомпрометованість шкіри, як одного з органів виведення, що потребує проведення подальших досліджень для з’ясування патофізіологічних механізмів та визначення оптимальних заходів патогенетичної корекції.
Висновки
1. При атопічному дерматиті у 61,6 % дітей спостерігається дисметаболізм щавлевої кислоти з надлишковим утворенням її похідних, що призводить до залучення систем виведення для екскреції продуктів обміну і супроводжується підвищенням рівня оксалатів у сечі та конденсаті повітря, що видихується.
2. Обмінні порушення впливають на перебіг атопічного дерматиту, обтяжуючи клінічні прояви захворювання, та асоціюються із спадковим характером метаболічних розладів (χ2 = 5,07; p = 0,02), більш ранньою маніфестацією ознак (χ2 = 3,7; p = 0,05), серед яких найбільш відмінною є інтенсивність свербіння (χ2 = 8,3; p = 0,004), помірним підвищенням рівня IgE (χ2 = 5,63; p = 0,018) та наявністю гіпероксалуричного фенотипу (χ2 = 4,67; p = 0,031).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/65-1.jpg)
/66-1.jpg)