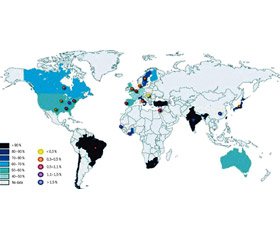
Введением скрининга беременных и вакцинации против краснухи женщин детородного возраста было предупреждено значительное количество мальформаций. В отличие от врожденной краснухи, врожденная цитомегаловирусная (ЦМВ) инфекция остается редко диагностируемой как в развитых, так и в развивающихся странах мира, несмотря на то, что цитомегаловирус становится основной инфекционной причиной сенсоневральной потери слуха и аномалий развития нервной системы. На сегодняшний день цитомегаловирусная инфекция диагностируется у 0,2–2,0 % (в среднем около 0,64 %) беременных [1, 2]. В 2011 году закончено эпидемиологическое исследование частоты сероконверсии у женщин детородного возраста (от 12 до 42 лет) из Австралии, Бельгии, Бразилии, Канады, Чили, Англии, Финляндии, Франции, Германии, Ганы, Индии, Израиля, Италии, Японии, Шотландии, Южной Африки, Испании, Швеции, Тайваня, Турции и Соединенных Штатов (результаты представлены на рис. 1 прямоугольниками разного цвета с обозначением частоты встречаемости). Кроме того, в этих же странах проведено исследование методом полимеразной цепной реакции (ПЦР) слюны и мочи у новорожденных (выборка не менее 1000 новорожденных). Процентное соотношение было получено путем деления числа врожденно инфицированных новорожденных на общее число тестируемых новорожденных (результаты представлены на рис. 1 окружностями разного цвета с обозначением частоты встречаемости) [35].
/69-1.jpg)
Остановимся на основных клинических характеристиках цитомегаловирусной инфекции. Цитомегаловирус человека — β-герпесвирус, который может вызывать первичную инфекцию с половым, плацентарным путем передачи. Трансмиссия ЦМВ может проходить с грудным молоком, через слюну и переливание крови, во время трансплантации внутренних органов и гемопоэтических стволовых клеток. После перенесенной инфекции часто трансформируется в латентную форму с периодической реактивацией в организме хозяина [3]. У иммунокомпетентных людей цитомегаловирусная инфекция протекает бессимптомно, у части пациентов имеет клинические проявления инфекционного мононуклеоза и спленомегалии.
Эксперты по менеждменту врожденной цитомегаловирусной инфекции (Informal International Congenital Cytomegalovirus Recommendations Group, ICCRG) еще в 2015 году определили основные факторы риска заболеваемости, которые включают:
— отсутствие скрининговых программ у беременных и новорожденных;
— низкий уровень информативности рутинных тестов среди новорожденных группы риска;
— ограниченность знаний родителей, а иногда клиницистов о клинике инфицирования на протяжении беременности;
— недостаточная эффективность и токсичность настоящего лечения;
— отсутствие лицензированных вакцин.
Профилактические меры в течение беременности, раннее этиотропное лечение детей с сенсоневральными нарушениями слуха, эффективное использование иммуноглобулинов у беременных и новорожденных диктует необходимость более внимательного отношения к врожденной цитомегаловирусной инфекции среди клиницистов и общества.
Мониторинг беременных женщин. Анализ пренатального наблюдения беременных женщин показал, что ни в одной стране мира рутинное тестирование беременных женщин на цитомегаловирусную инфекцию не является обязательным. Однако некоторыми врачами в странах Европы, Израиля, Австралии, США независимо от официальных программ проводится выборочное тестирование беременных женщин [4].
Одним из предложенных подходов к сокращению числа случаев врожденной цитомегаловирусной инфекции является рутинное тестирование беременных женщин на цитомегаловирусную инфекцию для диагностики первичной инфекции, так как первичная цитомегаловирусная инфекция у матери связана с высоким индивидуальным риском внутриутробной передачи инфекции [4]. Несколько исследований, целью которых было выявление серонегативных женщин с высоким риском сероконверсии, показали эффективность тестирования специфических IgG антител к ЦМВ у беременных женщин. Предоставленные этим женщинам рекомендации относительно профилактики ЦМВ-инфекции снижали риск заражения плода [5]. Однако имеются и неутешительные данные о высокой заболеваемости плода у серопозитивных матерей (непервичная цитомегаловирусная инфекция). Более 2/3 (около 75 %) всех случаев врожденной ЦМВ инфекции в США встречается у беременных из-за реактивации латентного вируса, повторного инфицирования новым штаммом ЦМВ или вследствие обоих факторов [6].
Так, ICCRG не рекомендует проведение рутинного скрининга беременных женщин, направленного на выявление первичной цитомегаловирусной инфекции (уровень доказательности В).
Диагностика цитомегаловирусной инфекции у беременных. При подозрении на первичную цитомегаловирусную инфекцию у беременных лабораторная диагностика может способствовать определению риска передачи ее плоду. Наряду с этим клинические симптомы неспецифичны (лихорадка, усталость, головная боль); у 25–50 % беременных цитомегаловирусная инфекция протекает бессимптомно. Поэтому наиболее рациональным считается определение специфических антител класса IgG к впервые обнаруженной цитомегаловирусной инфекции в сыворотке ранее серонегативных беременных женщин (сероконверсия) [7]. На практике диагностика с помощью лишь сероконверсии используется редко из-за частого отсутствия, соответствующего базового отрицательного образца специфических антител класса IgG к цитомегаловирусной инфекции. Однако сравнение с сывороткой, если таковая имеется, взятой до беременности или на ранних сроках беременности, является наиболее предпочтительным. Когда иммунный статус на цитомегаловирус до беременности неизвестен, отдельное обнаружение низкой авидности антител IgG к цитомегаловирусу или выявление специфических антител IgM — единственные возможности диагностики материнской первичной инфекции. Обнаружение антител IgM к цитомегаловирусу или низкая авидность IgG к цитомегаловирусу является признаком недавнего инфицирования [8, 9].
Таким образом, рационально проводить тесты на сероконверсию, а при отсутствии базового образца исследовать антитела класса IgM и индекс авидности IgG к цитомегаловирусу у беременных женщин при появлении гриппоподобных симптомов (лихорадка, усталость и головная боль), не относящихся к другой специфической инфекции, или при подозрении на инфицирование плода цитомегаловирусной инфекцией во время ультразвуковой визуализации или магнитно-резонансной томографии (уровень доказательности С). При подозрении на ЦМВ-инфекцию у беременной рекомендовано обратиться в специализированные центры дородового патронажа женщин с патологией беременности и экстрагенитальной патологии (уровень доказательности С) [10]. Достоверный диагноз цитомегаловирусной инфекции у плода устанавливается после 20–21 недели беременности и через 6 недель с момента материнского инфицирования путем ПЦР-диагностики амниотической жидкости на цитомегаловирус в реальном времени (уровень доказательности В).
Профилактика ЦМВ-инфекции у матери и вертикальной трансмиссии ЦМВ-инфекции. С 1999 года наивысшим приоритетом Американского института медицины было создание вакцины для профилактики врожденного ЦМВ [11]. В 2009 году успешно завершила клинические испытания II фазы субъ–единичная вакцина на основе ЦМВ гликопротеина B (gB), приготовленная с адъювантом MF59. Вакцина gB/MF59 показала 50% эффективность [12]. Двойное слепое плацебо-контролируемое исследование серонегативных девочек-подростков, завершенное в 2016 году, дало аналогичные результаты — 45% эффективность для сероконверсии после двух доз вакцинопрофилактики [12]. До 2019 года разрабатывается несколько цитомегаловирусных вакцин и ожидается завершение нескольких клинических испытаний (клинические регистрационные номера NCT02594566, NCT02396134, NCT02506933 и NCT01877655 на сайте ClinicalTrials.gov).
Особым фактором риска инфицирования материнским цитомегаловирусом является тесный контакт беременных с детьми в возрасте до 2 лет, поскольку выделение цитомегаловируса из слюны и мочи у детей раннего возраста может продолжаться в течение нескольких месяцев или лет [14, 15]. Примерно у 30 % матерей, имеющих детей до 2 лет, происходит видоизменение серологической специфичности в течение 1 года с момента начала посещения ребенком детского коллектива. Поэтому для предотвращения цитомегаловирусной инфекции у беременных женщин были рассмотрены влияние правил гигиены и норм поведения (уровень доказательности С). Результаты двух кластерных рандомизированных исследований и одного одногруппового исследования показали, что предоставление беременным женщинам информации по профилактике инфицирования ЦМВ в 6 раз снизило частоту сероконверсии (абсолютное снижение риска = 6,4 %; 95% доверительный интервал 3,2–9,6) [16]. Гигиенические мероприятия по профилактике ЦМВ-инфекции у беременной с риском заражения в семье представлены в табл. 1.
/70-1.jpg)
Пассивная иммунизация внутривенным иммуноглобулином, содержащим специфические антитела (прежде всего IgG) против возбудителя цитомегалии (цитотект), была исследована как потенциальное средство для предотвращения передачи цитомегаловируса плоду у беременных женщин с первичной цитомегаловирусной инфекцией. В четырех исследованиях оценивалась эффективность лечения специ–фическим иммуноглобулином. Результаты исследований сообщают о некоторой эффективности специфического иммуноглобулина для предотвращения вертикальной трансмиссии ЦМВ-инфекции [18]. У небольшой когорты исследуемых (30–60 беременных женщин с первичной цитомегаловирусной инфекцией) внутривенное введение специфического иммуноглобулина в дозе 200 Ед/кг в 12 раз снизило частоту симптомов врожденной ЦМВ-инфекции у новорожденных и в 4 раза уменьшило число случаев сенсоневральной глухоты, диагностируемой к 1-му году жизни [19, 20]. Однако в одном исследовании получены неутешительные результаты: преэклампсия и ограничение роста плода выявлены у 7 (13 %) из 53 женщин в группе пациентов, получавших иммуноглобулин, по сравнению с 1 (2 %) из 51 женщины в группе плацебо (p = 0,06) [21]. В настоящее время проводится еще одно рандомизированное клиническое исследование (клинический регистрационный номер NCT01376778 на сайте ClinicalTrials.gov), что может прояснить роль профилактического лечения специфическим иммуноглобулином. Результаты этого испытания могут предоставить столь необходимые доказательства для противовирусной безопасности и эффективности лечения иммуноглобулином, содержащим специфические антитела (прежде всего IgG) против возбудителя цитомегалии в профилактике врожденной цитомегаловирусной инфекции.
Противовирусные препараты, такие как внутривенный ганцикловир (ганцикловир-Фармекс, цимевен), внутривенный фоскарнет (фоскавир), цидофовир (цидофовир), пероральный валганцикловир (вальцит) не рекомендованы для лечения во время беременности из-за нефротоксичности, негативного влияния на онтогенез и потенциальной канцерогенности, а также минимальных данных о безопасности препаратов. Ганцикловир, валганцикловир, фоскарнет и цидофовир в настоящее время относят к категории C по классификации The Food and Drug Administration (FDA).
Напротив, ацикловир и пероральный валацикловир используются в качестве профилактики цитомегаловирусной инфекции у пациентов с ВИЧ/СПИДом или после трансплантации органов [22]. Предпосылкой для использования ацикловира и валацикловира во время беременности является низкая частота неблагоприятных эффектов, хотя они имеют слабую активность против цитомегаловируса. На сегодняшний день оценка исследований эффективности и безопасности ацикловира и валацикловира противоречива, что, вероятно, обусловлено небольшими размерами выборки [23]. Опубликованные в 2016 году результаты II фазы нерандомизированного исследования подтвердили эффективность валацикловира у 43 беременных с подтвержденной фетальной цитомегаловирусной инфекцией. Первично инфицированные беременные получали валацикловир в дозе 8 г/сутки, из них у 79 % были рождены дети без клинических симптомов, что указывает на эффективность валацикловира, хотя эти выводы не являются окончательными [24]. Во II фазе находится рандомизированное исследование по изучению эффективности и безопасности валацикловира в предотвращении вертикальной передачи цитомегаловирусной инфекции при первичном заражении матери (клинический регистрационный номер NCT02351102 на сайте ClinicalTrials.gov). Результаты этого исследования могут предоставить столь необходимые доказательства по противовирусной эффективности и безопасности препарата в профилактике врожденной ЦМВ-инфекции.
Так, ICCRG предлагает рутинное проведение образовательных курсов по профилактике цитомегаловирусной инфекции для педиатров, семейных врачей, акушеров-гинекологов с использованием локальных и интернет-ресурсов (уровень доказательности В). Учитывая потенциальный риск ЦМВ у всех беременных, женщины должны быть осведомлены о клинических проявлениях заболевания и превентивных мерах (табл. 1) (уровень доказательности В). Вакцинопрофилактика врожденной цитомегаловирусной инфекции, по предварительным данным, эффективна, однако находится на стадии клинических испытаний. ICCRG рекомендует, однако, с осторожностью основываясь на недостаточной доказательной базе, использование иммуноглобулина, содержащего специфические антитела против возбудителя цитомегалии у беременных (уровень доказательности С). Рутинная противовирусная терапия для предупреждения врожденной цитомегаловирусной инфекции во время беременности в настоящее время не рекомендуется в связи с недостаточностью доказательной базы (уровень доказательности С).
Скрининг врожденной цитомегаловирусной инфекции в неонатальном периоде. Врожденная цитомегаловирусная инфекция может проявляться клинически и иметь бессимптомное течение (табл. 2). Прогноз неблагоприятных исходов различен: от минимального неврологического дефицита с односторонней сенсоневральной глухотой до мальформаций нервной системы и смерти пациентов. Скрининг слуха, который выполняется во многих развитых странах, успешно диагностирует врожденное нарушение слуха у новорожденных и рекомендован при подозрении на врожденную ЦМВ-инфекцию, причем экономическая выгода получена как от рутинной ПЦР-диагностики всех новорожденных, так и от обследования на ЦМВ у детей, имеющих симптоматику заболевания [25–28]. Однако 10 % случаев асимптоматической врожденной цитомегаловирусной инфекции развивают потерю слуха после неонатального периода, что снижает возможность выявления заболевания, так как скрининг слуха у детей раннего возраста рутинно не проводится [29].
Анализ данных показал необходимость скринирования всех новорожденных с сенсоневральной потерей слуха и задержкой внутриутробного развития с целью раннего выявления врожденной цитомегаловирусной инфекции (уровень доказательности В). В лабораторной диагностике врожденной цитомегаловирусной инфекции у новорожденных обязательным является проведение ПЦР слюны и мочи или исследование обоих образцов в реальном времени не позднее первых 3 недель жизни, причем слюна является более предпочтительным образцом (уровень доказательности В).
/72-1.jpg)
Лечение врожденной цитомегаловирусной инфекции у новорожденных. Высокий риск нейтропении, гонадального дисгенеза, канцерогенность диктует необходимость балансировать потенциальное преимущество и возможные риски перед применением противовирусных препаратов у новорожденных. –Изучена эффективность внутривенного ганцикловира и перорального валганцикловира. В 1997 г. опубликованы первые результаты II фазы исследования по изучению эффективности ганцикловира в дозе 8 и 12 мг/кг, применяемого в течение 6 недель. У 16 % детей с врожденной цитомегаловирусной инфекцией спустя 6 недель лечения ганцикловиром в дозе 12 мг/кг произошло улучшение показателей слуха [31]. Последующие исследования показали способность ганцикловира предотвращать прогрессирование глухоты через 6 месяцев — 1 год после начала лечения [32]. Дополнительный анализ показал, что ганцикловир может также улучшать когнитивное развитие, однако наблюдалась ассоциация лечения ганцикловиром нейтропении [33]. В последнее время результаты рандомизированных плацебо-контролируемых исследований показали статистически значительную пользу от лечения валганцикловиром [34]. Все инфицированные цитомегаловирусом новорожденные получали валганцикловир в течение 6 недель и затем были рандомизированы в группу плацебо или продолжали лечение валганцикловиром до 6 месяцев. Те новорожденные, которые получали валганцикловир в течение 6 месяцев, в 6 раз чаще улучшали показатели слуха и когнитивную функцию на протяжении первых 24 месяцев жизни. Валганцикловир вызывал нейтропению, хотя выраженность ее была значительно ниже в сравнении с лечением ганцикловиром. Продолжено исследование эффективности валганцикловира с курсом терапии в течение 12 недель (клинический регистрационный номер NCT02005822 на сайте ClinicalTrials.gov). В начальной стадии находится II фаза рандомизированного контролируемого исследования эффективности и безопасности лечения валганцикловиром детей с врожденной цитомегаловирусной инфекцией с оценкой неврологической и сенсорной функции у детей 4 и 12 лет (клинические регистрационные номера NCT01649869, NCT02606266 на сайте ClinicalTrials.gov).
Так, новорожденным с врожденной цитомегаловирусной инфекцией рекомендовано начать лечение в течение первого месяца жизни. Новорожденным с бессимптомной врожденной цитомегаловирусной инфекцией с нарушениями слуха и без них, а также ЦМВ-инфекцией легкой степени тяжести необходим тщательный подход к противовирусной терапии с определением потенциального преимущества и возможных рисков (уровень доказательности А). Препаратом выбора лечения врожденной цитомегаловирусной инфекции является пероральный валганцикловир 16 мг/кг/разово, который назначается два раза в день до исчезновения клинических симптомов. Лечение проводится на протяжении не более 6 месяцев (уровень доказательности А). Наряду с тем терапия цитомегаловирусной инфекции у недоношенных детей, новорожденных может предусматривать пассивную иммунизацию внутривенным иммуноглобулином, содержащим специфические антитела против возбудителя цитомегалии, разовая доза иммуноглобулина составляет 2 мл (100 Ед) на 1 кг массы тела. Препарат вводят каждые 48 часов до исчезновения клинических симптомов.
В постнеонатальный мониторинг детей с врожденной цитомегаловирусной инфекцией важно включать наблюдение педиатра, невролога, офтальмолога, сурдолога. Еженедельно до 6 недель лечения, на 8-й неделе и затем ежемесячно рекомендовано проводить мониторинг абсолютного количества нейтрофилов крови и уровней трансаминаз. На офтальмологическое обследование обязательно направлять в начале терапии новорожденного, затем — по показаниям. С интервалом в 6 месяцев в течение первых трех лет жизни ребенка и ежегодно до подросткового возраста оценивается нейропсихическое, физическое развитие и выполняется аудитологическое тестирование.
Выводы
1. Врожденная цитомегаловирусная инфекция остается редко диагностируемой инфекционной причиной сенсоневральной потери слуха и аномалий развития нервной системы. Поэтому важными аспектами являются профилактика развития цитомегалии у беременных, предупреждение ее вертикальной трансмиссии к плоду, раннее выявление и лечение заболевания у новорожденного.
2. Результаты анализа клинических испытаний дали возможность разработать рекомендации (ICCRG), которые включают показания к углубленной диагностике ЦМВ-инфекции у беременной, ИФА-диагностику и ПЦР амниотической жидкости, что полезно в дородовом патронаже.
3. Практическую значимость имеют профилактические меры по предупреждению ЦМВ-инфекции у беременных, имеющих детей раннего возраста, профилактика вертикальной трансмиссии путем введения беременной внутривенного иммуноглобулина, содержащего специфические антитела против возбудителя цитомегалии.
4. Особое внимание уделяется врожденной ЦМВ-инфекции у новорожденных, которая может клинически манифестировать или иметь бессимптомное течение. В связи с этим всем детям с сенсоневральной потерей слуха и задержкой внутриутробного развития рекомендовано проводить скринирование на ЦМВ-инфекцию (ПЦР-диагностика слюны и мочи).
5. Возможности лечения врожденной ЦМВ-инфекции ограниченны и включают пероральный валганцикловир и пассивную иммунизацию специфическим внутривенным иммуноглобулином. Клинические испытания продолжаются, нарабатывается практический опыт лечения цитомегалии, что со временем повлияет на изменение настоящих рекомендаций.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Manicklal S. The “silent” global burden of congenital cytome–galovirus / S. Manicklal, V.C. Emery, T. Lazzarotto, S.B. Boppana, R.K.Gupta // Clin. Microbiol. Rev. — 2013. — № 26. — P. 86-102.
2. Hamilton S.T. Prevention of congenital cytomegalovirus complications by maternal and neonatal treatments: a systematic review / S.T. Hamilton, W. van Zuylen, A. Shand et al. // Rev. Med. Virol. — 2014. — № 24. — P. 420-433.
3. Tey S.K. CD8+ T-cell recognition of human cytomegalovirus latency-associated determinant pUL138 / S.K. Tey, F. Goodrum, R. Khanna // J. Gen. Virol. — 2010. — № 91. — P. 2040-2048.
4. Doutre S. Reducing congenital cytomegalovirus infection through policy and legislation in the United States / S. Doutre // Microbiology Australia. — 2015. — № 11. — P. 162-164.
5. Walker S.P. Cytomegalovirus in pregnancy: to screen or not to screen / S.P. Walker, R. Palma-Dias, E.M. Wood, P. Shekleton, M.L. Giles // BMC Pregnancy Childbirth. — 2013. — № 13. — P. 96.
6. Revello M.G. Prevention of primary cytomegalovirus infection in pregnancy / M.G. Revello, C. Tibaldi, G. Masuelli et al. // Biomedicine. — 2015. — № 2. — P. 10.
7. Wang C. Attribution of congenital cytomegalovirus infection to primary versus non-primary maternal infection / C. Wang, X. Zhang, S. Bialek, M. Cannon // J. Clin. Infect. Dis. — 2011. — № 52. — P. 11-13.
8. Munro S.C. Diagnosis of and screening for cytomegalovirus infection in pregnant women / S.C. Munro, B. Hall, L.R. Whybin et al. // J. Clin. Microbiol. — 2005. — № 43. — P. 4713-4718.
9. Prince H.E. Role of cytomegalovirus (CMV) IgG avidity testing in diagnosing primary CMV infection during pregnancy / H.E. Prince, M. Lape-Nixon // Clin Vaccine Immunol. — 2014. — № 21. — P. 1377-1384.
10. Leruez-Ville M. Feasibility of predicting the outcome of fetal infection with cytomegalovirus at the time of prenatal diagnosis / M. Leruez-Ville, J. Stirnemann, Y. Sellier et al. // Am. J. Obstet. Gynecol. — 2016. — № 215. — P. 1-9.
11. Arvin A.M. Vaccine development to prevent cytomegalovirus di–sease: report from the National Vaccine Advisory Committee / A.M. Arvin, P. Fast, М. Myers, S. Plotkin // Clin. Infect. Dis. — 2004. — № 39. — P. 233-239.
12. Pass R.F. Vaccine prevention of maternal cytomegalovirus infection / R.F. Pass, C. Zhang, A. Evans, T. Simpson et al. // N. Engl. J. Med. — 2009. — № 360. — P. 1191-1199.
13. Bernstein D.I. Safety and efficacy of a cytomegalovirus glycoprotein B (gB) vaccine in adolescent girls: a randomized clinical trial / D.I. Bernstein, F.M. Munoz, S.T. Callahan et al. // Vaccine. — 2016. — № 34. — P. 313-319.
14. Adler S.P. Cytomegalovirus and child day care: risk factors for maternal infection / S.P. Adler // Pediatr. Infect. Dis. J. — 1991. — № 10. — P. 590-594.
15. Grosjean J. Human cytomegalovirus quantification in toddler’s saliva from day care centers and emergency unit: a feasibility study / J. Grosjean, L. Trapes, S. Hantz et al. // J. Clin. Virol. — 2014. — № 61. — P. 371-377.
16. Boppana S.B. Saliva polymerase-chain-reaction assay for cytomegalovirus screening in newborns / S.B. Boppana, S.A. Ross, M. Shimamura et al. // N. Engl. J. Med. — 2011. — № 364. — P. 2111-2118.
17. Revello M.G. Prevention of primary cytomegalovirus infection in pregnancy / M.G. Revello, C. Tibaldi, G. Masuelli et al. // EBioMedicine. — 2015. — № 2. — P. 1205-1210.
18. Buxmann H. Use of cytomegalovirus hyperimmunoglobulin for prevention of congenital cytomegalovirus disease: a retrospective analysis / H. Buxmann, O.M. Stackelberg, R.L. Schlosser et al. // J. Perinat. Med. — 2011. — № 40. — P. 439-446.
19. Nigro G. Passive immunization during pregnancy for congenital cytomegalovirus infection / G. Nigro, S.P. Adler, R. La Torre, A.M. Best // N. Engl. J. Med. — 2005. — № 353. — P. 1350-1362.
20. Visentin S. Early primary cytomegalovirus infection in pregnancy: maternal hyperimmunoglobulin therapy improves outcomes among infants at 1 year of age / S. Visentin, R. Manara, L. Milanese et al. // Clin. Infect. Dis. — 2012. — № 55. — P. 497-503.
21. Nigro G. Primary maternal cytomegalovirus infections during pregnancy: association of CMV hyperimmune globulin with gestational age at birth and birth weight / G. Nigro, I. Capretti, A.M. Manganello, A.M. Best // J. Matern. Fetal. Neonatal. Med. — 2015. — № 28. — P. 1-4.
22. Lowance D. Valacyclovir for the prevention of cytomegalovirus disease after renal transplantation. International Valacyclovir Cytomegalovirus Prophylaxis Transplantation Study Group / D. Lowance, H.H. Neumayer, C.M. Legendre et al. // N. Engl. J. Med. — 1999. — № 340. — P. 1462-1470.
23. Pasternak B. Use of acyclovir, valacyclovir, and famciclovir in the first trimester of pregnancy and the risk of birth defects / B. Pasternak, A. Hviid // JAMA. — 2010. — № 304. — P. 859-866.
24. Leruez-Ville M. In utero treatment of congenital cytomegalovirus infection with valacyclovir in a multicenter, open-label, phase II study / M. Leruez-Ville, I. Ghout, L. Bussieres et al. // Am. J. Obstet. Gynecol. — 2016. — № 215. — P. 461-462.
25. Williams E.J. First estimates of the potential cost and cost saving of protecting childhood hearing from damage caused by congenital CMV infection / E.J. Williams, J. Gray, S. Luck et al. // Arch. Dis. Child. Fetal. Neonatal. Ed. — 2015. — № 100. — P. 501-506.
26. Nishida K. Neurological outcomes in symptomatic congenital cytomegalovirus-infected infants after introduction of newborn urine screening and antiviral treatment / K. Nishida, I. Morioka, Y. Nakamachi et al. // Brain Dev. — 2016. — № 38. — P. 209-216.
27. Bergevin A. Cost-benefit analysis of targeted hearing directed early testing for congenital cytomegalovirus infection / A. Bergevin, C.D. Zick, S.B. McVicar, A.H. Park // Int. J. Pediatr. Otorhinolaryngol. — 2015. — № 79. — P. 2090-2093.
28. Gantt S. Cost-effectiveness of universal and targeted newborn screening for congenital cytomegalovirus infection / S. Gantt, F. Dionne, F.K. Kozak et al. // JAMA Pediatr. — 2016. — № 170. — P. 1173-1180.
29. Goderis J. Hearing loss and congenital CMV infection: a systema–tic review / J. Goderis, E. De Leenheer, K. Smets, H. Van Hoecke // Pediatrics. — 2014. — № 134. — P. 972-982.
30. Rawlinson W.D. Congenital cytomegalovirus infection in pregnancy and the neonate: consensus recommendations for prevention, diagnosis, and therapy / W.D. Rawlinson, S.B. Boppana, K.B. Fowler et al. // Lancet Infect. Dis. — 2017. — № 17(6). — P. 177-188.
31. Whitley R.J. Ganciclovir treatment of symptomatic congenital cytomegalovirus infection: results of a phase II study. National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group / R.J. Whitley, G. Cloud, W. Gruber et al. // J. Infect. Dis. — 1997. — № 175. — P. 1080-1086.
32. Kimberlin D.W. Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system: a randomized, controlled trial / D.W. Kimberlin, C.Y. Lin, P.J. Sanchez et al. // J. Pediatr. — 2003. — № 143. — P. 16-25.
33. Oliver S.E. Neurodevelopmental outcomes following ganciclovir therapy in symptomatic congenital cytomegalovirus infections invol–ving the central nervous system / S.E. Oliver, G.A. Cloud, P.J. Sanchez et al. // J. Clin. Virol. — 2009. — № 46. — P. 22-26.
34. Kimberlin D.W. Valganciclovir for symptomatic congenital cytomegalovirus disease / D.W. Kimberlin, P.M. Jester, P.J. Sanchez et al. // N. Engl. J. Med. — 2015. — № 372. — P. 933-943.
35. Cannon M.J. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection / M.J. Cannon, D.S. Schmid, T.B. Hyde // Rev. Med. Virol. — 2010. — № 20. — P. 202-213.

/69-1.jpg)
/70-1.jpg)
/72-1.jpg)