Передчасне народження для дитини є надзвичайним фактором ризику розвитку несприятливих порушень функцій органів і систем, а внутрішньошлуночкові крововиливи (ВШК) та перивентрикулярну лейкомаляцію (ПВЛ) серед передчасно народжених (до 32 тижнів гестаційного віку (ГВ)) вважають основною причиною розвитку стійких небажаних наслідків.
Зважаючи на величезне соціальне та фінансове навантаження уражень мозку у передчасно народжених дітей, клініцисти та науковці спрямували свої зусилля на впровадження інформативних і неінвазивних діагностичних методів у галузі нейробіології та заснованих на них профілактично-лікувальних стратегій. Проте на сучасному етапі розвитку інтенсивної неонатології можна відмітити значний розрив між нашими фундаментальними знаннями нейрофізіології та клінічними завданнями, спрямованими на раціональну, орієнтовану на уражений мозок, терапію.
Метою поданого огляду наукових джерел є висвітлення особливостей авторегуляції церебральної перфузії у передчасно народжених дітей, встановлення значення сучасних методів її моніторингу та визначення загальних підходів до профілактики цереброваскулярних порушень.
Цереброваскулярні порушення у передчасно народжених дітей найчастіше мають наслідок у вигляді розвитку ВШК, періінтравентрикулярного крововиливу (ПІВК), що обумовлено незрілістю мікросудин гермінального матриксу [1]. Найчастіше ВШК прогресують саме у перші 24–48 годин, сягаючи 90 % свого можливого об’єму. Поява або значне прогресування ВШК після десятої доби життя свідчить про недостатню адекватність інтенсивного виходжування або появу критичних ускладнень, включаючи ятрогенні ушкодження.
Підвищенню ризику ураження мозку у передчасно народжених дітей можуть сприяти численні фактори через декілька різних патогенетичних шляхів: патологія ангіогенезу, порушений конт–роль церебрального кровообігу у незрілому мозку, запалення, оксидативне ураження, порушення коагуляції та стану тромбоцитарної ланки [2].
Поява поняття авторегуляції мозкового кровообігу у передчасно народжених дітей, розкриття механізмів її потенційної уразливості з відповідними змінами в інтенсивних підходах виходжування, сприяли зменшенню частоти ВШК і ПВЛ наприкінці ХХ сторіччя [3].
Церебральна авторегуляція — це внутрішній нейропротективний фізіологічний феномен, здатність мозку підтримувати відносно постійний церебральний кровообіг, незважаючи на коливання церебрального перфузійного тиску [2]. Основною функцією системи церебральної авторегуляції є забезпечення мозку киснем і субстратами для метаболізму навіть під час коливань артеріального тиску як у самому мозку, так і в організмі в цілому.
Концепція церебральної судинної реактивності на фізіологічні стимули була створена у 1890 р. професором патології Кембриджського університету Чарльзом Роєм і нейробіологом, лауреатом Нобелівської премії (1932) з фізіології та медицини за відкриття «функції нейронів» Чарльзом Шерингтоном, які виявили зв’язок між нейрональною активністю та церебральним кровообігом [4]. Пізніше, у ХІХ сторіччі, Зігмунд Мейєр доповнив дані про регуляцію кровообігу при обстеженні спонтанних ритмічних осциляцій діаметра судин з періодичністю 0,1 Нz. Сучасні комп’ютерні технології довели, що авторегуляційні системи послаблюють ефекти низькохвильових коливань кров’яного тиску, ефективно працюючи як фільтри високих частот. Такі коливання діаметра судин, що виникають внаслідок змін вазомоторного тонусу артеріальних судин у всьому тілі та контролюються автономною нервовою системою, мають назву мейєрівських хвиль [2].
У нормі церебральна авторегуляція здійснюється комплексом інтегрованих систем через міогенні, нейрогенні та метаболічні механізми [5]. У регуляції церебрального кровообігу беруть участь як паракринні сигнали до гладеньких м’язів опірних судин від однієї чи більше точок нейроваскулярної системи (нейронів, астроцитів, серицитів, ендотелію), так і автокринні сигнали, які можуть бути тригерами від самих гладеньких м’язів [6]. Вазоактивні паракринні субстанції включають вазодилататори (окис азоту, простаноїди, аденозини, моноксид вуглецю) та вазоконстриктори (ендотелін, тромбоксан та ін.). Вазодилататори продукуються у відповідь на гіпотензію, гіпоксемію, гіпербарію [5, 6]. Паракринні субстанції стимулюють формування циклічних нуклеотидів (цГМФ і цАМФ) у гладеньких м’язових клітинах із зворотними змінами проникності кальцієвих каналів [6].
Фінальний загальний механізм для всіх форм цереброваскулярної реактивності складається зі змін у тонусі гладеньких м’язів та калібрі церебральних опірних судин при змінах трансмурального тиску. Базальний тонус опірних судин підтримується шляхом тонічної регуляції швидкості реполяризації-деполяризації мембран через зміни проникності іонних (переважно кальцієвих) каналів. Ці канали є центральним компонентом патогенетичних шляхів, які регулюються вазоактивними субстанціями, зокрема аденозином. Нейрогенні механізми в основному полягають в авторегуляційному ефекті на церебральні артеріоли [7].
Розвиток системи авторегуляції та здатності церебральних судин реагувати на зовнішні та внутрішні стимули починається з кінця 20-го тижня вагітності, тому порушення авторегуляції мозкового кровообігу у глибоко та екстремально недоношених дітей є проблемою, яку практично дуже важко корегувати медикаментозними засобами [8]. Саме нездатність системи цереброваскулярної регуляції підтримати стабільний церебральний кровообіг обумовлює чергування циклів ішемії-реперфузії, що є патогенетичними механізмами ураження мозку у вигляді внутрішньочерепних крововиливів та ураження білої речовини [2]. Незрілість механізмів авторегуляції у передчасно народжених дітей лишає їх майже беззахисними у перехідний період від внутрішньоутробного існування з різкими змінами у кисневому та субстратному забезпеченні функціональних систем організму, особливо з огляду на таку саму незрілу кардіореспіраторну систему [1, 8].
Класичне описання системи авторегуляції церебрального кровообігу як фізіологічного механізму представлено сигмоїдальною кривою зі стабільним церебральним кровообігом (cerebral blood flow — CBF) у межах нормального кров’яного тиску та нестабільним — при коливаннях артеріального тиску поза межі норми [2]. Плато церебрального кровообігу підтримується внутрішніми цереброваскулярними механізмами у певному діапазоні церебрального перфузійного тиску (градієнту між значенням артеріального тиску та венозного церебрального тиску). Як тільки зовнішній тиск виходить за межі авторегуляційного плато, церебральна циркуляція стає інертною до тиску [2, 3].
У дорослої людини процеси авторегуляції стабільно працюють у великому діапазоні значень системного тиску від 60 до 160 мм рт.ст., однак також можуть дезорганізуватися при дуже низьких або дуже великих значеннях. Остаточний консенсус відповідно до ступеня надійності системи авторегуляції у недоношених дітей практично відсутній [9]. Якщо судини не здатні до авторегуляції (вазопараліч), церебральний кровообіг стає залежним від системного кров’яного тиску, який визначається середнім артеріальним тиском (mean arterial pressure — МАР).
При зниженні МАР менше 30 мм рт.ст. здатність до авторегуляції у новонародженої дитини знижується, що підвищує ймовірність ураження мозку [10]. У зрілому мозку крива дисоціації оксигемоглобіну підтримує вміст артеріального кисню на постійному рівні до досягнення артеріального тиску 50 мм рт.ст., нижче якого екстракція кисню прогресивно збільшується [2, 3, 10].
Межі авторегуляційного плато не є фіксованими та можуть бути змінені будь-якими факторами, що впливають на анатомію, реактивність і калібр опірних судин [11]. Існує велика кількість фізіологічних і патологічних стимулів, здатних викликати судинну відповідь мозку, однак для новонароджених дітей головними є п’ять специфічних стимулів: зміни церебрального перфузійного тиску, зміни концентрації циркулюючих кисню, вуглецю та глюкози, нейрональна активація. Клінічними факторами, що призводять до дисфункції системи церебральної авторегуляції у постнатальному періоді, є гіпотензія, гіпоксія-ішемія, судоми, інотропні препарати та пренатальні ВШК [12–15].
Найбільш вагомий вплив на церебральний кровообіг мають концентрація вуглецю та вміст кисню у крові новонароджених. Відповідь церебральних судин на концентрацію вуглецю є найбільш вираженою та становить +31 % на кожний кПа змін його парціального тиску і виражається у дилатації артеріол зі збільшенням парціального тиску вуглецю та у прогресуванні вазоконстрикції при його зменшенні [16]. Вплив концентрації кисню є менш вираженим: надзвичайно низький парціальний тиск кисню може збільшити CBF до 500 %, але коливання його у діапазоні 6–13 кПа не призводить до значних змін центрального кровообігу. Водночас вазодилатація на гіпоксемію є більш сильною та нівелює гіпокапнічну вазоконстрикцію [17, 18].
Значними модуляторами коливань церебрального кровообігу є система циклогеназ і простагландинів. Експресія циклогеназ стимулюється гіпоксією, гіпотензією, епідермальним фактором росту та трансформуючим фактором росту b, медіаторами запалення, включаючи інтерлейкіни — IL-6, IL-1b, фактор некрозу пухлини альфа (TNF-α) та нуклеарний фактор kB [19].
У результаті дослідження дилеційного поліморфізму генів був встановлений ряд мутацій, які призводять до цереброваскулярних уражень, незважаючи на стан системи авторегуляції та оксигенацію мозкових структур. Так, дані щодо тромбофілічних проявів, асоційованих з V фактором Лейдена та мутаціями генів G20210A, підтримують теорію про наявність генів — кандидатів для ініціації крововиливів у мозок. Також із ВШК і розвитком поренцефалії у немовлят пов’язують зміни колагену IVA1. А при обстеженні дорослих, які мають внутрішньомозкові крововиливи, виявлена висока частота носійства алелей аліпопротеїну Е4 та Е2 [20].
Поліморфізм прозапальних цитокінів IL-6 також вважають можливим генетичним модифікатором церебрального кровообігу та чинником крововиливів у мозок. Доведено, що продукція IL-6 є вищою у новонароджених із СС-генотипом у позиції 174 геному, що обумовлює статистично вірогідне значне збільшення частоти ВШК, ураження білої мозкової речовини та подальшої інвалідності через розвиток дитячого паралічу порівняно з немовлятами з GG- або GС-генотипом [21].
Через незрілість системи церебральної авторегуляції, інших функціональних систем, особливо серцево-судинної системи, у передчасно народжених дітей у провідних міжнародних рекомендаціях наголошено на необхідності визначення меж нормального артеріального тиску, який забезпечує адекватний перфузійний тиск мозку, та чіткому визначенні гіпотензії, що потребує своєчасної корекції [22]. На жаль, чинні рекомендації стратегії ведення гіпотензії у недоношених дітей у перші дні життя не поєднуються з кількісною інформацією щодо органної перфузії кожної з функціональних систем, включаючи центральну нервову систему [23, 24]. Зазвичай визначення гіпотензії у новонародженої дитини базується на значенні середнього артеріального тиску (МАР), який становить менше 30 мм рт.ст. або менше, ніж гестаційний вік у дитини в тижнях [24, 25]. Якщо використовувати ці критерії, то понад 50 % недоношених дітей у перехідну фазу перебувають у стані гіпотензії, тому активне виявлення цього стану та лікування дійсно призводить до покращення перфузії органів і оптимізації наслідків [25].
Останніми роками з’явилися дослідження щодо необхідності моніторингу органного кровообігу, зокрема церебрального, для підтримки адекватного системного артеріального тиску [26]. Одностайною думкою дослідників є те, що критичним у забезпеченні оптимального церебрального кровообігу є не окремий моніторинг і штучне підтримання МАР, а пряме визначення CBF, оцінка здатності дитини підтримувати авторегуляцію церебрального кровообігу та коригування терапії для адекватної церебральної перфузії [26, 27]. Більше того, за даними R.S. Garner та співавт. [27], не виявлено підвищення церебрального кровообігу при лікуванні гіпотензії у немовлят із ГВ менше 30 тижнів та масою тіла менше 1500 г, яке базувалося винятково на вимірюванні артеріального тиску (≤ 30 мм рт.ст.), що автори пояснюють знаходженням більшості дітей у зоні авторегуляції навіть при низькому МАР.
Використання інотропних препаратів для підтримання артеріального тиску у вікових межах для недоношеної дитини є неоднозначним. З одного боку, призначення інотропів для підтримки МАР є ефективним, але водночас і небезпечним саме для CBF через можливу периферійну вазоконстрикцію [27, 28]. Дослідженнями [28] встановлено, що допамін для лікування ранньої системної гіпотензії підвищує церебральну перфузію й оксигенацію. Однак автори попереджають про можливе підвищення постнавантаження, яке може порушувати скоротливість незрілого міокарда, а в подальшому погіршувати церебральну перфузію.
Клініко-інструментальні дослідження є базою для розвитку напрямку математичного моделювання церебральної авторегуляції в різних умовах, що у майбутньому може допомогти прогнозувати точні порушення тиску у васкулярній мережі мозку. Інформація про довжину, радіус, товщину стінки судини допоможе виявити судини, які максимально піддаються стресу [29]. Але широке впровадження цих технологій у реальну клінічну практику на сьогодні є неможливим.
Розуміння основ функціонування церебральної авторегуляції стало можливим завдяки розвитку інноваційних технологій оцінки церебральної перфузії. Такі інструментальні дослідження, як допплерівське визначення швидкості кровообігу (TCD) та параінфрачервона спектроскопія (NIRS), вже широко використовуються в клінічній практиці для дослідження церебральної авторегуляції кровообігу у пацієнтів різних вікових груп, включаючи новонароджених дітей. У наш час обидва методи є технологіями, що здатні реєструвати негайні зміни церебрального кровообігу та використовуються для детальної оцінки авторегуляції.
TCD впроваджується у практику з 1982 р. і надає дані щодо якісних змін мозкового кровообігу, його швидкості, значення цереброваскулярної резистентності та нижчого порога авторегуляції церебрального кровообігу.
Параінфрачервона спектроскопія може використовуватися біля ліжка дитини для проведення тривалого моніторингу як церебрального кровообігу, так і для оцінки авторегуляції [30, 31]. Вперше можливість проникнення світла у спектрі, близького до інфрачервоного, у тканини та абсорбції його певними хроматофорами у 1985 р. продемонстрували М. Ferrari та співавт. [32], коли було доведено, що випромінювання світла з довжиною хвилі, специфічного для піків абсорбції оксигемоглобіном (920 нм) та загальним гемоглобіном (760 нм), може бути використано для вимірювання оксигенації тканин.
У даний час існує ціла низка систем моніторингу на підставі технології параінфрачервоної спектроскопії, що готові для клінічного використання без спеціальної підготовки медичного персоналу та є доступними методами визначення стану системи церебральної авторегуляції та сатурації (оксигенації) тканин мозку [33, 34]. На міжнародному ринку представлено декілька приладів, які використовують різні джерела світла у потрібному сегменті спектра, який проходить через шкіру та череп у церебральні тканини на глибину до 8 см, а також різні відстані між датчиками та алгоритми розрахунку церебральної оксигенації: FORESIGHT, INVOS, NIRO, InSpectra, O2C, OM-220, OxiplexTS, TOx та TRS-20 [35, 36]. Найбільш цінним при клінічному використанні параінфрачервоної спектроскопії з моніторингом церебральної оксигенації є проведення надійного неінвазивного та тривалого моніторингу у найбільш незрілих і нестабільних новонароджених без необхідності часто турбувати дитину [38]. Доведено, що використання NIRS сприяє покращенню клінічних наслідків, проведенню цільової медикаментозної корекції [37, 38].
Способи оцінки церебральної оксигенації за допомогою NIRS можуть бути розподілені на дві категорії: вимірювання мозкової активності через оцінку динаміки відносних змін у регіональному кровообігу та відображення мозкової активності як функції часу [11, 39, 40]. Цільові та порогові значення регіональної церебральної оксигенації (сrSO2) можуть надаватися числовими значеннями або відносним показником змін від базової лінії. Церебральна регіональна оксигенація коливається у типовому діапазоні 60–80 од. Нормальні значення церебральної сатурації у здорових доношених новонароджених визнані в межах 76–78 % у ранньому неонатальному періоді. При цьому зниження сrSO2 до ≤ 50 од. або 20 % від базової лінії є тригером для проведення загальних втручань; ≤ 45 од. або 25 % нижче базової лінії є критичним значенням [40].
У нормальному мозку дорослого церебральний кровообіг (CBF), об’єм церебральної крові (СBV) та церебральна екстракція кисню значно вищі у сірій речовині, ніж у білій, в той час як співвідношення екстракції кисню (співвідношення споживання та надходження кисню) становить приблизно 0,37 та 0,41 для сірої та білої речовини відповідно [18, 41, 42].
Підтримка регіональної церебральної оксигенації при зниженому мозковому кровообігу на початкових етапах компенсується через збільшення екстракції кисню. Соматична оксигенація (вісцеральна, абдомінальна сатурація) визначається значеннями на 5–15 пунктів вище за церебральну сrSO2 та може значно змінюватися залежно від патології [33, 43].
До недавнього часу широке практичне застосування NIRS для оцінки церебральної оксигенації у дітей різного гестаційного віку обмежувалося недостатністю даних щодо референтних меж або високими розбіжностями в окремих дослідженнях.
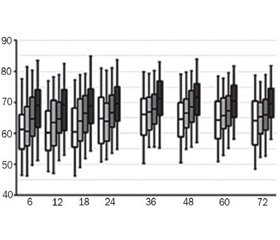
Фундаментальними дослідженнями надійного дизайну великої групи авторів [44] було встановлено референтні межі сrSO2 та фракційної тканинної екстракції кисню (cFTOE; (SaO2 − сrSO2)/SaO2) при проведенні NIRS у передчасно народжених дітей протягом перших 72 годин життя. Авторами дослідження були використані апарати INVOS 4100 та 5100c з неонатальними датчиками (рис. 1).
Відповідно до результатів дослідження середнє значення сrSO2 становило 65 % при надходженні у відділення інтенсивної терапії новонароджених, збільшуючись із ГВ у межах 1 % на тиждень. Фракційна тканинна екстракція кисню має подібні, але протилежні тенденції. Отже, щодо практичного застосування запропоновані криві референтних значень відносно сrSO2 та cFTOE для передчасно народжених дітей різного гестаційного віку [44].
Для використання у практиці інтенсивної неонатології за результатами вищенаведеного дослідження також запропоновано референтні криві для регіональної церебральної сатурації та фракційної екстракції кисню тканинами у передчасно народжених дітей із гемодинамічно значущою відкритою артеріальною протокою (гзВАП) і синдромом затримки внутрішньоутробного росту (ЗВУР), тому що такі стани є найбільш поширеними серед цієї когорти немовлят (рис. 2) [44].
Діти, які мали гзВАП до 84 годин життя, відрізнялися нижчими значеннями сrSO2 з гострим зниженням після 24 години. При народженні дітей із ЗВУР спостерігалося більш високе значення сrSO2 з помірним зниженням показника на 72 години, в той час як діти з адекватною на ГВ масою тіла мали вищі показники на 72 години порівняно з 1 годиною після народження. Така різниця між новонародженими з адекватною та малою масою тіла зменшувалася протягом часу, але зберігалася на кінець 3-ї доби життя [44].
Також у практиці можна використовувати перцентильні графіки зміни церебральної оксигенації впродовж перших трьох діб життя для 4 груп передчасно народжених дітей залежно від гестаційного віку (рис. 3) [44].
Авторами рандомізованого клінічного дослідження, що певним чином перекликається з попереднім, оцінка регіональної оксигенації проводиться залежно від того, як близько до межі двох стандартних відхилень (2 SD) вона знаходиться. Автори вважають, що зміни у межах 33–44 % асоціюються з функціональними ураженнями мозку [38].
У 2013 р. були оприлюднені результати ще одного рандомізованого клінічного дослідження, метою якого було встановлення референтних показників для передчасно народжених дітей (Safeguarding the Brains of our smallest Children — SafeBoosC) [45]. Автори відзначили, що раптові зміни crSO2 ≥ 7 % (1 SD) повинні спонукати до оцінки та перевірки клінічних параметрів (параметри вентиляції, рівень гемоглобіну, наявність гемодинамічно значущої ВАП, лікарські засоби, використання нейросонографії, турбування дитини). Коливання crSO2 у межах ±2 SD є тригером оцінки стану серцево-судинної системи відповідно до запропонованого алгоритму (табл. 1).
/91-1.jpg)
Існування тісних зв’язків між судинами та клітинами мозку сприяє зростанню регіонального мозкового метаболізму при зростанні регіонального кровообігу. Судомні зміни мозкових клітин супроводжують уривчасті епізоди інтенсивної синаптичної активації, що призводять до виражених відхилень церебрального кровообігу. Швидко осцилюючі тренди церебральної регіональної сатурації можуть успішно використовуватися для визначення судомної активності у вентильованих, седованих пацієнтів і для моніторингу відповіді на протисудомну терапію.
Наявність внутрішньочерепного крововиливу призводить до розвитку артеріального вазоспазму, що викликає локальну гіпоперфузію зі зниженням кровообігу у ділянці ураження. Як і при судомній активності, дестабілізована гемодинамічна відповідь може призводити до швидких осциляцій у трендах сrSO2.
При гідроцефалії церебральна регіональна оксигенація універсально пов’язана з внутрішньочерепним тиском. При цьому внутрішньочерепна гіпертензія асоціюється зі значною редукцією кисневого забезпечення клітин мозку. Але слід пам’ятати, що одночасна наявність внутрішньочерепного крововиливу, який може бути чинником розвитку гідроцефалії, може змінювати результати вимірювань через секвестрацію фотонів інфрачервоного випромінювання. Також слід усвідомлювати, що дані регіонарної оксиметрії, отримані від помираючого або мертвого мозку, є дуже високими. Це явище допомагає пояснити відсутність лінійного співвідношення між церебральним кровообігом та сrSO2 (рис. 4).
/92-1.jpg)
Великий інтерес до впровадження у клінічну практику технології параінфрачервоної спектроскопії сприяє подальшим дослідженням її можливостей у діагностиці уражень мозку та удосконаленню самої методики. Більше того, у новітніх дослідженнях A. Caicedo та співавт. [46] зауважено, що система авторегуляції церебрального кровообігу є лише одним із багатьох тісно пов’язаних механізмів, які також впливають на гемодинаміку мозку. Подальша розробка систем моніторингу церебральної авторегуляції у режимі реального часу може бути вагомою частиною успішної стратегії ней–ропротекції [46]. Ефективною також вважається інтеграція вторинних джерел інформації, таких як амплітуд-інтегрована ЕЕГ, що допоможе диференційовано підходити до корекції коливань артеріального тиску, уникнути надлишкового лікування гіпотензії та збільшити ефективність розпізнавання цереброваскулярних порушень у немовлят з «нормальним» артеріальним тиском [2].
Неадекватне забезпечення мозку киснем і субстратами (глюкозою) є кінцевим наслідком всіх типів цереброваскулярних уражень при прямому ушкодженні мозку або внаслідок кардіореспіраторних розладів. Недостатня оксигенація клітин і дефіцит глюкози для метаболізму клітин є тригерами патофізіологічних каскадів, які призводять до загибелі нейронів [47]. Методи нейропротекції спрямовані на переривання цих каскадів: нейропротекція, анестезія, пастки вільних радикалів, антагоністи ексайтотоксичних амінокислот, блокатори кальцієвих каналів, стероїди, продукти генної інженерії. Однак немає фармакологічних підходів, для яких доведена доцільність застосування у людини, причиною цього є наявність численних механізмів цереброваскулярних уражень людського мозку.
Фармакологічні стратегії щодо профілактики ВШК, ПІВК розвиваються досить давно та включали призначення таких препаратів, як фенобарбітал, панкуронію бромід, вітамін Е, етамзилат, індометацин, ібупрофен та рекомбінований активуючий фактор VІІа.
Клінічні дослідження з урахуванням принципів доказової медицини проведені багато років тому щодо призначення панкуронію броміду, вітаміну Е та етамзилату, не дали впевнених позитивних результатів, тому вищенаведені препарати широко не використовуються у неонатальній практиці.
Фенобарбітал має здатність до стабілізації кров’яного тиску та потенційні властивості щодо захисту від вільних радикалів. Через зміни кров’яного тиску, подальші зміни церебрального кровообігу та небезпечність накопичення вільних форм кисню у періоді реперфузії, які роблять вагомий внесок у розвиток ВШК і ПІВЛ, фенобарбітал був запропонований як можлива превентивна стратегія, що відображено у Кохранівському огляді 2013 року [48].
Останнім часом індометацин пропонується для запобіганню ВШК внаслідок неспецифічного пригнічення основних та індукованих лізоформ циклооксигенази з подальшим зниженням синтезу простагландинів, сприяння дозріванню базальної мембрани судин. Призначення індометацину зменшує гіперемію у відповідь на подразнюючі фактори та покращує церебральну авторегуляцію [49].
На сьогодні доведено безпечність та ефективність використання рекомбінантного активуючого фактора VІІа (rFVIIa, ептаког альфа, октоког альфа), який здатний активувати систему гемостазу через стимуляцію каскаду згортання, сприяти формуванню згортка, запобігати його фібринолізу і поновленню кровотечі [50].
Стандартні рекомендації з профілактики церебральних уражень у передчасно народжених немовлят в основному базуються на перевірці, корекції стану серцево-судинної системи, враховуючи клінічні дані, наявні у рутинній клінічній практиці (артеріальний тиск, концентрація лактату, час наповнення капілярів, кількість сечі й ін.), та результати інструментальних обстежень. Основним профілактичним напрямком є впровадження алгоритмів дій персоналу при реєстрації певних змін церебральної оксигенації, зразком якого може бути підхід, який початково був запропонований для використання під час кардіохірургічних втручань [51] (алгоритм 1).
Відкрита артеріальна протока є визначальним фактором редистрибуції крові, що викликає зниження артеріального тиску та церебральної оксигенації, підвищує фракційну кисневу екстракцію. Проте на сьогодні відсутні доказові дані щодо кореляції між розміром протоки та церебральною оксигенацією, а хірургічне закриття ВАП, про ефективність якого поширюється думка у неонатальній спільноті, не здійснює стійкого впливу на церебральну циркуляцію та оксигенацію [38].
Висновки та рекомендації
Стан системи церебральної авторегуляції та встановлення факторів впливу на церебральну регіо–нальну оксигенацію є предметом підвищеної уваги з боку фахівців, які задіяні у сфері виходжування передчасно народжених дітей.
Незрілість авторегуляційних механізмів, анатомічні особливості мозкової тканини, численність факторів, які впливають на цереброваскулярні структури, обумовлюють високий ризик уражень центральної нервової системи у передчасно народжених дітей. Зусилля дослідників спрямовані на розвиток неінвазивних діагностичних технологій, які можуть допомогти тривалий час проводити моніторинг церебральної оксигенації та сприяти своє–часній корекції терапевтичних підходів.
Параінфрачервона спектроскопія є відносно новим в інтенсивній неонатології методом, який вже довів свою безпечність та ефективність при прийнятті тактичних рішень під час виходжування передчасно народжених дітей. Отримані референтні значення для передчасно народжених дітей різного гестаційного віку можна використовувати у практиці інтенсивної неонатології для оптимізації інфузійної терапії та респіраторної підтримки немовлят на доклінічному етапі розвитку цереброваскулярних уражень.
Метод параінфрачервоної спектроскопії має переваги як технологія для постійного тривалого неінвазивного моніторингу церебральної регіональної оксигенації, починаючи з перших хвилин життя, та є потенційним методом для обґрунтування тактики лікування, визначення ступеня тяжкості цереброваскулярних порушень і ефективності застосованих інтенсивних втручань.
Подальшим напрямком для клінічного впровадження параінфрачервоної спектроскопії при виходжуванні передчасно народжених дітей є проведення великих рандомізованих контрольованих досліджень для встановлення впливу на показники церебральної регіональної оксигенації широкого кола втручань у відділеннях інтенсивної терапії новонароджених і розробки алгоритмів корекції лікування залежно від результатів моніторингу.
Конфлікт. Автори заявляють про відсутність конфлікту інтересів.
Список литературы
1. The ontogeny of cerebrovascular pressure autoregulation in premature infants / C.J. Rhee, C.D. Fraser, K. Kibler et al.// J Perinatol. — 2014. — Vol. 34. — P. 926-931. doi: 10.1038/jp.2014.122.
2. Vesoulis Z.A. Cerebral Autoregulation, Brain Injury, and the Transitioning Premature Infant / Z.A. Vesoulis, A.M. Mathur // Pediatr. — 2017. — Vol. 5. — P. 64. doi: 10.3389/fped.2017.00064.
3. Donnelly J. Further understanding of cerebral autoregulation at the bedside: possible implications for future therapy / J. Donnelly, M.J. Aries, M. Czosnyka // Expert. Rev. Neurother. — 2015. — Vol. 15(2). — P. 169-185. doi: 10.1586/14737175.2015.996552.
4. Roy C. On the regulation of the blood supply of the brain / C. Roy, C. Sherrington // J. Physiol. — 1890. — Vol. 11. — P. 85-158.
5. Cerebral blood flow and autoregulation: current measurement techniques and prospects for noninvasive optical methods / S. Fantini, A. Sassaroli, K.T. Tgavalekos, J. Kornbluth // Neurophoton. — 2016. — Vol. 3, Iss. 3. — P. 031411. doi: 10.1117/1.NPh.3.3.031411.
6. Dammann O. Cytokines and Perinatal Brain Damage / O. Dammann, T.M. O’Shea // Clin. Perinatol. — 2008. — Vol. 35(4). — P. 643-663. doi: 10.1016/j.clp.2008.07.011.
7. Tan C.O. Integrative physiological and computational approaches to understand autonomic control of cerebral autoregulation / C.O. Tan, J.A. Taylor // Exp. Physiol. — 2014. — Vol. 99(1). — P. 3-15. doi: 10.1113/expphysiol.2013.072355.
8. Brain Injury and Altered Brain Growth in Preterm Infants: Predictors and Prognosis / H. Kidokoro, P.J. Anderson, L.W. Doyle et al. // Pediatrics. — 2014. — Vol. 134. — P. 444-453. doi: 10.1542/peds.2013-23361.
9. Goadsby P.J. Autonomic nervous system control of the cerebral circulation / P.J.Goadsby // Handb. Clin. Neurol. — 2013. — Vol. 117. — P. 193-201. doi: 10.1016/B978-0-444-53491-0.00016-X.
10. Brew N. Cerebral vascular regulation and brain injury in preterm infants / N. Brew, D. Walker, F.Y. Wong // Am. J. Physiol. Regul. Integr. Comp. Physiol. — 2014. — Vol. 306. — P. 773-786. doi: 10.1152/ajpregu.00487.2013/
11. Cerebral Autoregulation Real-Time Monitoring / A. Tsalach, E. Ratner, S. Lokshin, et al. // PLoS ONE. — 2016. — Vol. 11, Iss. 8. — e0161907. doi: 10.1371/journal.pone.0161907.
12. Impaired cerebral autoregulation and brain injury in newborns with hypoxic-ischemic encephalopathy treated with hypothermia / A.N. Massaro, R.B. Govindan, G. Vezina et al. // J. Neurophysiol. — 2015. — Vol. 114. — P. 818-824. doi: 10.1152/jn.00353.2015.
13. Wavelet coherence analysis of dynamic cerebral autoregulation in neonatal hypoxic-ischemic encephalopathy / F. Tian, T. Tarumi, H. Liu et al. // Neuroimage Clin. — 2016. — Vol. 11. — P. 124-132. doi: 10.1016/j.nicl.2016.01.020.
14. Cerebral effects of commonly used vasopressor-inotropes: a study in newborn piglets / G.H. Hahn, S. Hyttel-Sorensen, S.M. Petersen et al. // PLoS One. — 2013. — Vol. 8. — P. e63069. doi: 10.1371/journal.pone.0063069.
15. A novel method for assessing cerebral autoregulation in preterm infants using transfer function analysis / Z.A. Vesoulis, S.M. Liao, S.B. Trivedi et al. // Pediatr. Res. — 2016. — Vol. 79(3). — P. 453-459. doi: 10.1038/pr.2015.238.
16. Yoon S.H. pCO2 and pH regulation of cerebral blood flow / S.H. Yoon, M. Zuccarello, M. Rapoport // Front. Physiol. — 2012. — Vol. 3. — P. 365-372. doi: 10.3389/fphys.2012.00365.
17. The effect of oxygen on dynamic cerebral autoregulation: critical role of hypocapnia / S. Ogoh, H. Nakahara, P.N. Ainslie, T. Miyamoto // J. Appl. Physiol. — 2010. — Vol. 108. — P. 538-543. doi: 10.1152/japplphysiol.01235.2009.
18. Back SA. Cerebral white and gray matter injury in newborns: New insights into pathophysiology and management / S.A. Back // Clin. Perinatol. — 2014. — Vol. 41(1). — P. 1-24. doi: 10.1016/j.clp.2013.11.001.
19. Systems approach to the study of brain damage in the very preterm newborn / A. Leviton, P. Gressens, O. Wolkenhauer, O. Dammann // Front. Syst. Neurosci. — 2015. — Vol. 9. — P. 58. doi: 10.3389/fnsys.2015.00058 .
20. Mutations in Col4a1 cause perinatal cerebral hemorrhage and porencephaly / D.B. Gould, F.C. Phalan, G.J. Breedveld et al. // Science. — 2005. — Vol. 308. — P. 1167-1171. doi: 10.1126/science.1109418.
21. Interleukin-6-174-genotype, sepsis and cerebral injury in very low birth weight infants / W. Gopel, C. Hartel, P. Ahrens et al. // Genes. Immun. — 2006. — Vol. 7. — P. 65-68. doi: 10.1038/sj.gene.6364264.
22. Batton B. Etiology, clinical manifestations, evaluation, and management of low blood pressure in extremely preterm infants / B. Batton [Internet]. UpToDate. 2017. Available from: https://www.uptodate.com/contents/etiology-clinical-manifestations-evaluation-and-management-of-low-blood-pressure-in-extremely-preterm-infants
23. Hypotension in preterm neonates: low blood pressure alone does not affect neurodevelopmental outcome / T. Alderliesten, P.M. Lemmers, I.C. van Haastert et al. // J. Pediatr. — 2014. — Vol. 164. — P. 986-991. doi: 10.1016/j.jpeds.
24. Dempsey E.M. Challenges in Treating Low Blood Pressure in Preterm Infants / E.M. Dempsey // Children. — 2015. — Vol. 2. — P. 272-288. doi: 10.3390/children2020272.
25. Evolving blood pressure dynamics for extremely preterm infants / B. Batton, L. Li, N.S. Newman, A. Das, K.L. Watterberg, B.A. Yoder et al. // J. Perinatol. — 2014. — Vol. 34(4). — P. 301-305. doi: 10.1038/jp.2014.6.
26. Monitoring of Cerebrovascular Reactivity for Determination of Optimal Blood Pressure in Preterm Infants / C.S. Costa, M. Czosnyka, P. Smielewski et al. // J. Pediatr. — 2015. — Vol. 167(1). — P. 86-91. doi: 10.1016/j.jpeds.2015.03.041.
27. Garner R.S. Treatment of presumed hypotension in very low birthweight neonates: effects on regional cerebral oxygenation / R.S. Garner, D.J. Burchfield // Arch. Dis. Child. Fetal. Neonatal. Ed. — 2013. — Vol. 98, Iss. 2. — P. 117-121. doi: 10.1136/archdischild-2011-301488.
28. Barrington K.J. Treating hypotension in extremely preterm infants: The pressure is mounting // K.J. Barrington, M. Janaillac // Arch. Dis. Child. Fetal. Neonatal. Ed. — 2016. — Vol. 101, Iss. 3. — P. 188-189. doi: 10.1136/archdischild-2015-309814.
29. Mathematical Modeling of Cerebral Blood Circulation and Cerebral Autoregulation: Towards Preventing Intracranial Hemorrhages in Preterm Newborns / R. Lampe, N. Botkin, V. Turova et al. // Comput. Math. Methods Med. — 2014. — Vol. 2014. — P. 965275. doi: 10.1155/2014/965275.
30. Naulaers G. Use of Near Infrared Spectroscopy in the Neonatal Intensive Care Unit / G. Naulaers, A. Caicedo, S. van Huffel // Neonatal Monitoring Technologies: Design for Integrated Solutions. IGI Global. — 2012. — P. 56-83. doi: 10.4018/978-1-4666-0975-4.ch004.
31. Yu Y. Monitoring cerebral ischemia using cerebral oximetry: pros and cons / Y. Yu, Y. Lu, L. Meng, R. Han // J. Biomed. Res. — 2016. — Vol. 30(1). — P. 1-4. doi: 10.7555/JBR.30.20150096.
32. Continuous non-invasive monitoring of human brain by near infrared spectroscopy / M. Ferrari, I. Giannini, G. Sideri, E. Zanette // Adv. Exp. Med. Biol. — 1985. — Vol. 191. — P. 873-882. doi: 10.1007/978-1-4684-3291-688.
33. Steppan J. Cerebral and Tissue Oximetry / J. Steppan, C.W. Hogue // Best Pract. Res. Clin. Anaesthesiol. — 2014. — Vol. 28(4). — P. 429-439. doi: 10.1016/j.bpa.2014.09.002.
34. Ferrari M. Review: Near infrared brain muscle oximetry: from the discovery to current applications / M. Ferrari // J. Near. Infrared. Spectrosc. — 2012. — Vol. 20. — P. 1-14. doi: 10.1255/jnirs.973.
35. Near infrared spectroscopy in neonatal intensive care unit — a literature review / N. Ioniță, M. Dima, C. Ilie et al. // J. Pediatrului. — 2013. — Vol. 16(64). — P. 70-73.
36. Current research suggests that the future looks brighter for cerebral oxygenation monitoring in preterm infants / M. Kenosi, G. Naulaers, C. Ryan, E. Dempsey // Acta Paediatr. — 2015. — Vol. 104(3). — P. 225-231. doi: 10.1111/apa.12906.
37. da Costa C.S. Is near-infrared spectroscopy clinically useful in the preterm infant? / da C.S. Costa, G. Greisen, T. Austin // Archives of Disease in Childhood — Fetal and Neonatal Edition. — 2015. — Vol. 100. — P. 558-561. doi: 10.1136/archdischild-2014-30791.
38. Hyttel-Sorensen S., Pellicer A., Alderliesten T., Austin T., van Bel F., Benders M. Cerebral near infrared spectroscopy oximetry in extremely preterm infants: phase II randomised clinical trial. — BMJ. — 2015. — 350. — g7635. doi: 10.1136/bmj.g7635.
39. Scheeren T.W. Journal of clinical monitoring and computing 2014 end of year summary: near infrared spectroscopy (NIRS) / T.W. Scheeren, K. Bendjelid // J. Clin. Monit. Comput. — 2015. — Vol. 29(2). — P. 217-220. doi: 10.1007/s10877-015-9689-4.
40. New time-frequency method for cerebral autoregulation in newborns: predictive capacity for clinical outcomes / J. Riera, F. Cabanas, J.J. Serrano et al. // J. Pediatr. — 2014. — Vol. 165. — P. 897-902. doi: 10.1016/j.jpeds.2014.06.008.
41. Vutskits L. Cerebral blood flow in the neonate / L. Vutskits // Paediatr. Anaesth. — 2014. — Vol. 24(1). — P. 22-29. doi: 10.1111/pan.12307.
42. Evaluation of cerebral circulation and oxygen metabolism in infants using near-infrared light / T. Kusaka, K. Isobe, S. Yasuda et al. // Brain Dev. — 2014. — 36(4). — 277-83. doi: 10.1016/j.braindev.2013.05.011.
43. Cerebral and somatic rSO2 in sick preterm infants / R.M. Cerbo, R. Cabano, A. Di Comite et al. // J. Matern. Fetal. Neonatal. Med. — 2012. — Vol. 25(4). — P. 97-100. doi: 10.3109/14767058.2012.715030.
44. Reference values of regional cerebral oxygen saturation during the first 3 days of life in preterm / T. Alderliesten, L. Dix, W. Baerts et al. // Pediatr. Res. — 2016. — Vol. 79(1–1). — P. 55-64. doi: 10.1038/pr.2015.186.
45. The Safe Boos C II randomized trial: treatment guided by near-infrared spectroscopy reduces cerebral hypoxia without changing early biomarkers of brain injury / A.M. Plomgaard, W. van Oeveren, T.H. Petersen et al. // Pediatr. Res. — 2016. — Vol. 79(4). — P. 528-535. doi: 10.1038/pr.2015.266.
46. A new framework for the assessment of cerebral hemodynamics regulation in neonates using NIRS / A. Caicedo, T. Alderliesten, G. Naulaers et al. // Adv. Exp. Med. Biol. — 2016. — Vol. 876. — P. 501-509. doi: 10.1007/978-1-4939-3023-4_63.
47. Klein K.U. Perioperative neuroprotection / K.U. Klein, K. Engelhard // Best Pract. Res. Clin. Anaest. — 2010. — Vol. 24, Iss. 4. — P. 535-549. doi: 10.1016/j.bpa.2010.10.008.
48. Smit E. Postnatal phenobarbital for the prevention of intraventricular haemorrhage in preterm infants / E. Smit, D. Odd, A. Whitelaw // Cochrane Database of Systematic Reviews. — 2013. — Iss. 8: CD001691. doi: 10.1002/14651858.CD001691.pub3.
49. Indomethacin Prophylaxis to Prevent Intraventricular Hemorrhage: Association between Incidence and Timing of Drug Administration / H. Mirza, W. Oh, A. Laptook et al. // J. Pediatr. — 2013. — Vol. 163(3). — P. 706-710. doi: 10.1016/j.jpeds.2013.02.030.
50. Recombinant Activated Factor VIIa Treatment for Refractory Hemorrhage in Infants C.N. Dang, L.I. Katakam, P.B. Smith et al. // J. Perinatol. — 2011. — Vol. 31(3). — P. 188-192. doi: 10.1038/jp.2010.85.
51. Denault A. A proposed algorithm for the intraoperative use of cerebral near-infrared spectroscopy / A. Denault, A. Deschamps, J.M. Murkin // J. Semin. Cardiothorac. Vasc. Anesth. — 2007. — Vol. 11(4). — P. 274-281. doi: 10.1053/j.jvca.2011.06.008.

/89-1.jpg)
/90-1.jpg)
/91-1.jpg)
/92-1.jpg)