Харчова алергія вражає багато мільйонів людей, призводить до зниження якості життя людини та суспільства загалом, а в деяких випадках може призвести до фатальних наслідків [1]. Харчова алергія — це побічна реакція на їжу, зумовлена імунологічними механізмами, тому цей термін охоплює IgE-опосередковані, не-IgE-опосередковані та змішані (разом і IgE-опосередковані та не-IgE-опосередковані) реакції [2]. Алергічні реакції можуть виникати на будь-які харчові продукти, але найчастіше на коров’яче молоко, куряче яйце, пшеницю, сою, арахіс, лісові горіхи, рибу, продукти моря [3].
Рекомендації щодо первинної профілактики харчової алергії
На сьогодні багато уваги приділяється дослідженням, що спрямовані на вивчення факторів ризику виникнення харчової алергії для розробки оптимальних профілактичних заходів щодо зменшення її поширеності. До недавнього часу вважалося, що для профілактики харчової алергії доцільне уникнення найпоширеніших харчових алергенів під час вагітності і грудного вигодовування [4]. Однак є дані, що ранній вплив потенційних харчових алергенів може зменшити ризик розвитку відповідної алергії. Наприклад, споживання матерями головних харчових алергенів, таких як арахіс, горіхи, молоко і пшениця, під час вагітності може зменшити ризик харчової алергії в новонароджених [5].
Згідно з положеннями Керівництва з харчової алергії й анафілаксії Європейської академії алергології та клінічної імунології (European Academy of Allergy and Clinical Immunology (EAACI), 2014) на сьогодні відсутні рекомендації щодо обмежень у дієті під час вагітності та грудного вигодовування жінок для запобігання виникненню в їх дитини харчової алергії [6]:
— виключно грудне вигодовування для всіх немовлят у перші 4–6 місяців;
— дієтичні обмеження не рекомендуються для всіх вагітних жінок і матерів-годувальниць;
— якщо грудне вигодовування є недостатнім або неможливим:
а) діти з високим ступенем ризику повинні отримувати гіпоалергенну суміш протягом перших 4 місяців;
б) інші новонароджені можуть отримувати стандартну суміш;
— введення додаткових харчових продуктів після 4-місячного віку відповідно до стандартної практики вигодовування та рекомендацій щодо харчування для всіх дітей незалежно від атопічної спадковості [6].
Існують дослідження, які показують, що раннє введення алергенних продуктів може бути перспективною стратегією профілактики харчової алергії [7]. Рекомендовано уникати дієтичних обмежень, зокрема введення твердих продуктів, після 4–6 місяців життя навіть для дітей із високим ризиком розвитку алергічних захворювань [8].
До загальних напрямів управління харчовою алергією відносять заходи, що спрямовані на лікування гострих реакцій, та заходи, що спрямовані на мінімізацію ризику появи таких реакцій у майбутньому, так звані довгострокові стратегії [6].
Ведення пацієнтів із гострими реакціями
Більшість харчових продуктів містять білки, що можуть бути алергенними та викликати харчову алергію, а в деяких випадках — і анафілаксію. Оцінка ризику серйозних реакцій має вирішальне значення для успішного лікування пацієнтів із харчовою алергією. Ризики розрізняються в пацієнтів різних підгруп:
— наприклад, діти з попередньою анафілаксією або тяжкою формою астми мають більш високий ризик розвитку серйозних реакцій, ніж інші пацієнти;
— обтяжують стан також вживання нестероїдних протизапальних засобів, інфекції та мастоцитоз.
За даними оцінки EAACI, виявлено слабкі докази, що підтверджують переваги застосування H1-антигістамінних препаратів для дітей і дорослих із гострими небезпечними симптомами, спричиненими харчовою алергією [6, 9]. Важливо, що немає доказів ефективності H1-антигістамінних препаратів при лікуванні більш тяжких проявів харчової алергії. Профілактичне введення H1-антигістамінних препаратів може приховати ранні симптоми анафілаксії та призвести до затримки вчасного введення адреналіну для лікування небезпечних реакцій.
Довгострокові стратегії управління включають зміни раціону харчування, освітні заходи, що запобігають прийому алергенних харчових продуктів, фармакологічні та нефармакологічні заходи. Останнім часом зростає зацікавленість щодо ефективності сублінгвальної та пероральної імунотерапії для індукції харчової толерантності.
Елімінаційна дієта вважається основним засобом управління харчовою алергією, що призводить до повної або майже повної ліквідації симптомів. Вона полягає в усуненні причинних продуктів й обов’язково має бути адаптованою до харчових потреб пацієнта. Цей варіант дієтотерапії охоплює широкий спектр питань, таких як потреба в поживних речовинах у новонароджених із харчовою алергією під час введення прикорму, що відрізняється від потреб у поживних речовинах у дітей старшого віку та підлітків із харчовою алергією, яка виникла не з народження. Необхідно ретельно контролювати термін та обсяг елімінації, оскільки це може призвести до погіршення харчування та якості життя хворих дітей. А це особливо важливо для новонароджених та дітей, у яких індивідуальні рівні толерантності до алергенних продуктів можуть бути різні та змінюватися з часом, і від цього буде залежати обсяг елімінаційних заходів [6].
Ключовим елементом ефективності тривалої елімінаційної дієти є освітні заходи. Пацієнти, батьки, близькі родичі й опікуни мають бути належно поінформовані щодо обсягу елімінації причинних продуктів, пов’язаних із ризиком виникнення реакцій, та бути навчені униканню алергенних продуктів, звертати увагу на маркування і склад продуктів.
Необхідно регулярно проводити повторну оцінку, щоб визначити наявність толерантності для уникнення необгрунтованої елімінації того чи іншого продукту.
Для дітей з алергією на білок коров’ячого молока суміші на основі високогідролізованих білків є продуктами першого вибору з дієтичного харчування як альтернатива коров’ячому молоку. Замінники коров’ячого молока повинні відповідати критеріям гіпоалергенності й адекватного нутритивного вмісту, особливо в дітей віком до 6 місяців. Суміші на основі амінокислот рекомендуються дітям, у яких введення сумішей на основі високогідролізованих білків не дало позитивного результату (діти із сильним погіршенням росту, тяжкими симптомами і синдромами, що викликані не-IgE-залежними механізмами, такими як білокіндукований ентероколіт та ентеропатія, еозинофільні гастроентеропатії). Соєві суміші не слід рекомендувати дітям до 6 місяців і в іншому віці за наявності гастроінтестинальної симптоматики. Рекомендується ретельно оцінити вибір відповідного замінника коров’ячого молока, враховуючи такі фактори: вік, тип харчової алергії (IgE-/не-IgE-опосередкована), сукупність гастроінтестинальних симптомів, випадки загрозливих життєвих реакцій в анамнезі та нутритивні потреби, а також економічну рентабельність [6, 9].
Для застосування пробіотичних препаратів у лікуванні харчової алергії існує потреба в подальших дослідженнях для остаточного висновку щодо її ефективності. У більшості вже проведених досліджень відзначено позитивний ефект їх застосування як у лікуванні, так і в запобіганні розвитку харчової алергії в дітей.
Недостатньо також доказів щодо рекомендацій із використання нестероїдних протизапальних засобів — стабілізаторів мастоцитів (стабілізаторів мембран тучних клітин, базофілів) для лікування реакцій, викликаних харчовими алергенами [6]. Їх дія на відміну від Н1-антигістамінних препаратів, ефект яких спрямований на конкурентне зв’язування з гістаміновими рецепторами, полягає не у зв’язуванні гістаміну й інгібуванні його вивільнення. При цьому нароблений гістамін продовжує свою дію доти, доки не інактивується ферментом діаміноксидазою. Отже, ефект стабілізаторів мастоцитів можна очікувати після проявлення їх інгібуючої дії на функціональну активність цих та інших клітин запалення.
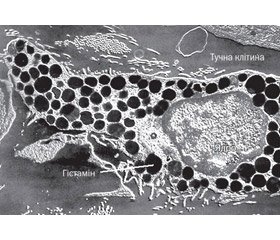
Відомо, що вивільнення гістаміну у великій кількості та інших медіаторів запалення може бути спровоковане як імунними, так і неімунними (хибно-алергічними) механізмами. Процес секреції гістаміну наведений на рис. 1.
До стабілізаторів мембран мастоцитів належать препарати кромогліцієвої кислоти (кромонів, що включають кром-алерг, хромоген, інтал, кромолін; алергокомод, ломузол, кромосол, кромолін-натрій, хай-кром, а також недокроміл натрію) і кетотифен (задитен), механізм дії яких наведений на рис. 2.
З іншого боку, кромоглікат і недокроміл натрію — препарати безпечні і практично повністю позбавлені побічних ефектів. Кромони не всмоктуються (біодоступність — не більше 1 %) з поверхні слизових оболонок і повністю виводяться через травний канал, отже, справляють виключно місцевий ефект. Серед небажаних побічних ефектів препаратів кромоглікату натрію описані подразнення слизових оболонок порожнини рота і верхніх дихальних шляхів, кашель, рефлекторний бронхоспазм внаслідок механічного впливу лікарського засобу, кропив’янки та еозинофільної пневмонії (обидві — зрідка). Кромоглікат натрію не сумісний із бромгексином та інгаляціями амброксолу. При застосуванні недокромілу натрію можуть спостерігатися кашель і рефлекторний бронхоспазм, у рідкісних випадках — головний біль, нудота, блювання, болі в животі. Відзначено посилення ефекту недокромілу натрію при сумісному використанні з пероральними або інгаляційними препаратами (β2-агоністи, глюкокортикостероїди, препарати теофіліну, а також іпратропіум бромід). До стабілізаторів мастоцитів належить також і кетотифен, під час лікування яким у дітей старшого віку і дорослих необхідно уникати занять, що потребують підвищеної концентрації уваги і швидкості психомоторних реакцій. При призначенні сиропа кетотифену хворим на цукровий діабет слід ураховувати, що 5 мл сиропу містять 3 мг вуглеводів. До складу сиропу входять також 2,35 об’ємних відсотка етанолу. Необхідно контролювати кількість тромбоцитів, особливо при одночасному прийомі з пероральними антидіабетичними засобами. До побічних дій кетотифену відносять слабкість, сонливість, легке головокружіння, сухість у роті, збільшення маси тіла, тромбоцитопенію, зрідка — алергічні реакції. Слід пам’ятати, що кетотифен може посилювати ефекти седативних, снодійних, антигістамінних препаратів та етанолу. При комбінації кетотифену з протидіабетичними засобами підвищується ризик розвитку тромбоцитопенії. Слід зазначити, що при лікуванні еозинофільного езофагіту кромоглікат натрію і кетотифен недостатньо ефективні.
У даний час активно вивчається можливість застосування антицитокінових й антилейкотрієнових препаратів при деяких формах еозинофільного ураження органів травлення, зокрема при еозинофільному езофагіті. Так, проводяться дослідження з визначення ефективності інгібітору експресії цистеїнілового рецептора лейкотрієну (cys-LT1) — препарату монтелукаст [10]. Він блокує дію лейкотрієну D4, що є специфічним еозинофільним хемоатрактантом. Відзначено позитивний ефект терапії монтелукастом як при еозинофільному езофагіті [11], так і при еозинофільному ентероколіті [12]. Іншим засобом, на який покладають певні надії в лікуванні гастроінтестинальних алергічних розладів, є препарат моноклональних антитіл проти інтерлейкіну-5 — меполізумаб [11]. При проведенні відкритого клінічного випробування меполізумабу у хворих на еозинофільний езофагіт отримана істотна позитивна динаміка. На тлі його застосування відзначалося зменшення периферичної і тканинної еозинофілії, ліквідовано клінічну симптоматику, відбулася нормалізація морфологічних змін у стравоході. Подібні дослідження проводяться і при еозинофільному гастроентериті [13].
У лікуванні гастроінтестинальної форми харчової алергії застосовують і топічні глюкокортикостероїди. Так, відзначено позитивну динаміку проявів еозинофільного езофагіту на фоні прийому флутиказону пропіонату, який зазвичай використовується в терапії бронхіальної астми. Цей інгаляційний препарат застосовується у віковій дозі курсом 8 тижнів, у результаті чого відзначається досягнення клінічної (до кінця першого тижня прийому) і морфологічної ремісії (істотно зменшується ступінь еозинофільної інфільтрації) [14]. Єдиним описаним ускладненням такої терапії був кандидоз стравоходу, що спостерігався при застосуванні флyтиказону в дозі 220 мг 2 рази на день [15]. Топічні глюкокортикостероїди з успіхом застосовуються і при інших еозинофільних ураженнях травного каналу в дітей із перших місяців життя. Зокрема, відзначено ефективність суспензії будесоніду при деяких формах алергічного ентероколіту й проктоколіту [16].
Тяжкі і стійкі до лікування форми гастроінтестинальної харчової алергії часто вимагають призначення системних глюкокортикостероїдів і навіть імуносупресантів за життєвими показаннями. Так, Liacouras застосовував метилпреднізолон у дозі 1,5 мг/кг у 2 прийоми протягом 4 тижнів. Після лікування в 19 з 20 пацієнтів відзначено значне клінічне й гістологічне поліпшення. Проте в 9 хворих симптоматика повернулася при терміні спостереження до 1 року [15].
Пацієнти та опікуни повинні бути поінформовані про харчові продукти, яких слід уникати, навчені загальному плану належних заходів щодо запобігання контакту з причинним алергеном і надання вчасних належних заходів невідкладної допомоги в разі виникнення алергічної реакції. Діагноз харчової алергії в дитини з дозволу батьків або опікунів повинен бути повідомлений усім, хто має відношення до дитини, включаючи співробітників дитячих садків та школи.
У разі розвитку тяжких гострих алергічних реакцій, включаючи різні варіанти анафілаксії (анафілактичний шок, швидко зростаючий набряк гортані чи бронхоспазм, генералізована кропив’янка тощо), виникає потреба визначитися з питанням призначення препаратів адреналіну.
Абсолютні показання до використання автоінжектора з адреналіном:
— наявність в анамнезі випадку анафілаксії на будь-який харчовий продукт;
— харчова алергія, пов’язана з персистуючою або тяжкою астмою;
— анафілаксія, індукована фізичними навантаженнями [6].
Відносні показання до застосування автоінжектора з адреналіном при харчовій алергії включають:
— персистуючу харчову алергію; легку або помірну алергічну реакцію на арахіс та/або горіхи;
— легку та/або помірну реакцію на дуже малу кількість їжі;
— специфічні групи високого ризику, наприклад поганий доступ до медичної допомоги.
Адреналін слід негайно ввести в разі виникнення симптомів із боку серцево-судинної системи та/або клінічних проявів із боку системи дихання, таких як зміна голосу, стридор або бронхоспазм, які викликані харчовою алергією.
Для усіх пацієнтів із супутньою астмою до плану лікування повинні бути включені β2-агоністи короткої дії і призначатися при бронхоспазмі після введення адреналіну.
Для запобігання виникненню пізньої фази алергічної реакції у вигляді респіраторної симптоматики можливий прийом глюкокортикостероїдів (якщо необхідно багато часу, щоб добратися до медичного закладу). Усі пацієнти, які отримали адреналін, мають бути оглянуті лікарем.
Алергенспецифічна імунотерапія при первинній харчовій алергії є багатообіцяючим імуномодулюючим лікувальним заходом, але, на жаль, пов’язаним із ризиком виникнення побічних реакцій, включаючи анафілаксію. Тому для звичайного клінічного застосування вона не рекомендована, а повинна проводитися тільки в спеціалізованих центрах, які укомплектовані фахівцями і відповідним обладнанням, і при суворому дотриманні клінічних протоколів, затверджених місцевими комітетами з питань етики [9, 17, 18].
Для пацієнтів із респіраторними або іншими алергічними симптомами на інгаляційні алергени, що можуть також бути причиною перехресних реакцій на харчові продукти, алергенспецифічна імунотерапія рекомендована тільки для лікування респіраторних симптомів, а не для терапії перехресної харчової алергії.
Для успішного лікування харчової алергії необхідно також враховувати чинники, так звані кофактори, що підвищують ступінь тяжкості деяких харчових алергічних реакцій. Серед них найчастішими кофакторами є фізичне зусилля і застосування нестероїдних протизапальних засобів, інші включають алкоголь, лихоманку та гостру інфекцію [19, 20].
Разом із тим слід регулярно проводити повторну оцінку з метою запобігання необґрунтованій тривалій елімінаційній дієті, що може погіршити якість життя, впливати на метаболічні процеси і нормальний ріст дитини. Повторне тестування IgE може бути корисним для вирішення питання щодо зменшення сенсибілізації (часто зустрічається при алергії на яйця і молоко). Повторне визначення IgE також допомагає виявити перехресну алергію [21].
На сьогодні пероральна провокаційна проба є єдиним тестом, що може з достатньою впевненістю передбачати досягнення толерантності. Тому рекомендується проводити провокаційну пробу через регулярні інтервали, щоб уникнути непотрібних дієтичних обмежень. Наприклад, при алергії на коров’яче молоко та куряче яйце більшість дітей стають толерантними протягом декількох років, тоді як реакція на арахіс або горіхи в більшості пацієнтів з алергією на вказані продукти залишається на все життя. При алергії на коров’яче молоко або куряче яйце інтервали для повторної оцінки повинні бути кожні 6–12 місяців, тоді як при алергії на арахіс та горіхи інтервали мають бути кожні два роки за відсутності випадкової реакції [6].
Вважаємо за доцільне розглянути конкретні підходи до ведення дітей, хворих на гастроінтестинальну харчову алергію.
Оральний алергічний синдром. Головним підходом у первинному лікуванні даного варіанта харчової алергії вважається уникнення вживання відомих харчових тригерів. Обмеження вживання в їжу дітьми усіх свіжих фруктів й овочів з одного сімейства рослин або тих, що перехресно реагують із деяким пилком, може бути надмірним і здебільшого вважається непотрібним із позицій запобігання розвитку орального алергічного синдрому. Проте хворі на цю патологію мають знати перелік потенційних перехресних харчових алергенів і вміти аналізувати клінічні прояви, що свідчать про прогресію системної реакції [22].
Незважаючи на успішність застосування елімінаційної дієти в лікуванні звичайних алергічних реакцій на харчові продукти, було відзначено, що все ж в остаточній ліквідації проявів орального алергічного синдрому уникнення вживання причинних продуктів протягом 2 років не відіграє істотної ролі, оскільки його розвиток обумовлений перехресною реакцією на пилок, а не на харчовий білок. Синдром оральної алергії є багаторічним через постійний вплив відповідних та перехресно-реагуючих аероалергенів [23]. Алергени, що викликають цей синдром, як правило, термолабільні. Тому вважається, що термічна обробка продукту попередить виникнення алергічної реакції. Однак слід зазначити те, що є деякі особливості властивостей алергенів у тому чи іншому продукті залежно від часу термічної обробки. Зокрема, було відзначено, що для усунення реакції на прийом ківі значну роль відіграє чотириступінчаста промислова гомогенізація, а саме обробка протягом 5 хвилин при температурі 90 °С, далі впродовж 15 секунд при температурі 115 °С, стабілізація протягом 15 секунд при температурі 110 °С, пастеризація протягом 21 хвилини при температурі 65 °С. В інших дослідженнях було визначено, що термічна стабільність алергенних білків ківі залежить від певного рН середовища. Антигенність соєвих продуктів підвищується після 5 хвилин кипіння і поступово зменшується через 60 хвилин кипіння. Термічна обробка фруктів не була рівномірно ефективною щодо зниження їх алергенності. Окрім того, багато продуктів мають у своєму складі як термолабільні, так і термостабільні білки. Тому чи допоможе термообробка для запобігання виникненню алергічної реакції, а саме орального алергічного синдрому, залежатиме від того, який саме білок викликає алергію [24].
У деяких пацієнтів відзначено ефективність алергенспецифічної імунотерапії. Необхідно проведення досліджень щодо характеристики IgE-епітопів алергенів фруктів та значного аналізу IgE- та Т-клітинної перехресної реактивності задля досягнення успіху алергенспецифічної імунотерапії в майбутньому [25].
Еозинофільний езофагіт. Перш ніж розпочинати лікування, важливо остаточно підтвердити або виключити діагноз еозинофільного езофагіту. На сьогодні до основних заходів його лікування відносять дієту, фармакотерапію та дилатацію стравоходу [26].
Топічні глюкокортикостероїди є препаратами першої лінії в лікуванні еозинофільного езофагіту [6, 27]. Установлено їх ефективність у зменшенні симптомів й еозинофілії слизової оболонки стравоходу при застосуванні інгаляційного флутиказону у формі дозованого спрею 880 мкг перорально без вдихання двічі на день упродовж 6 тижнів [28]. Пацієнтам не рекомендується приймати будь-яку їжу, пити або полоскати ротову порожнину протягом 30 хвилин, щоб запобігти змиванню препарату зі слизової оболонки стравоходу. Максимальний ефект протизапальної дії флутиказону досягається в проксимальному відділі стравоходу. Прийом будесоніду 1 мг 2 рази на день зменшує дисфагію і стравохідну еозинофілію. Обидва глюкокортикостероїди є ефективними в поліпшенні гістологічної картини і симптомів захворювання [29]. При такому застосуванні інгаляційного глюкокортикостероїду всмоктується лише 1 % препарату, тому системні побічні ефекти вкрай рідкісні, хоча можливе виникнення кандидозу слизової оболонки ротової порожнини і стравоходу. Тривалість вживання глюкокортико–стероїдних засобів становить 8 тижнів. При недосягненні ефективності від тривалих або більш високих доз стероїдів показана дилатація стравоходу (бужування або балонна дилатація) для симптоматичного поліпшення, однак це не впливає на основне запалення [29].
Слід зазначити, що нестероїдні протизапальні засоби, а саме стабілізатори мембран мастоцитів (кромоглікат натрію і кетотифен) недостатньо ефективні при еозинофільному езофагіті.
Еозинофільний гастроентерит. Є багато повідомлень про успішне лікування еозинофільного гастроентериту в дітей у разі застосування різних терапевтичних схем, включаючи елімінаційну дієту. Глюкокортикостероїди залишаються найефективнішими засобами для контролю симптомів, але, на жаль, рецидивна природа захворювання диктує необхідність тривалого їх застосування. Це спонукає вчених до нових досліджень щодо вивчення патофізіологічного підґрунтя еозинофільного гастроентериту.
Еозинофільний коліт. Лікування цього варіанта гастроінтестинальної алергії полягає у виключенні алергену з раціону харчування. У разі вживання дитячої суміші на основі коров’ячого молока слід замінити її на суміш із високим гідролізом білка [30]. У разі неефективності останньої — призначити амінокислотну суміш. У разі виключно грудного вигодовування слід виключити коров’яче молоко та молочні продукти з раціону харчування матері, а грудне вигодовування дитини необхідно підтримувати [31].
Алергію на білок коров’ячого молока слід вважати основною причиною еозинофільного коліту. Тести для оцінки чутливості до коров’ячого молока не сприяють встановленню діагнозу. Незважаючи на неоднорідність діагностичних критеріїв, у більшості дітей на підставі аналізу біоптатів слизової оболонки товстого кишечника спостерігається інфільтрація слизової оболонки прямої кишки еозинофілами. Виключення коров’ячого молока та молочних продуктів із раціону харчування матері чи дитини є ефективним засобом. Результати досліджень свідчать про те, що толерантність до коров’ячого молока при еозинофільниму коліті досягається після 12-місячного віку [32].
Ведення пацієнтів із не-IgE-опосередкованою гастроінтестинальною харчовою алергією включає в себе елімінацію причинних продуктів, адекватне забезпечення поживними речовинами, а в разі білок–індукованого ентероколітичного синдрому — забезпечення невідкладного лікування гострих реакцій [33, 34].
Терапія хворих на білокіндукований ентероколітичний синдром зазвичай є емпіричною, причому є багато протиріч в оцінці її ефективності через відсутність доказової бази проведених досліджень. Елімінаційна дієта включає усунення причинних харчових продуктів, а також відтермінування введення нових продуктів, які визнані як ризикові для дітей із білокіндукованим ентероколітичним синдромом [35, 36].
Близькоспоріднені і потенційно перехресно реагуючі продукти, наприклад риба, мають бути введені в раціон харчування дитини з обережністю, неодмінно під наглядом лікаря [30, 35, 37]. Хоча достатньо добре термічно оброблені молоко та яєчний білок у випечених виробах допускаються до вживання в більшості дітей з IgE-опосередкованою харчовою алергією і деяких пацієнтів з еозинофільним езофагітом, на сьогодні немає переконливих даних, що підтверджують толерантність до молока чи яєць у складі готових продуктів у хворих на білокіндукований ентероколітичний синдром [38–40].
Діти раннього віку з ентероколітичним синдромом, що викликаний білками коров’ячого молока чи сої, можуть знаходитися на грудному вигодовуванні в тому разі, якщо алергени, які входять до раціону харчування матері, не викликають реакції в дитини або в годуванні малюка застосовуються суміші на основі високогідролізованих білків. 10–20 % дітей можуть потребувати вживання амінокислотних сумішей [41, 42].
Розглядається пропозиція введення в раціон харчування дітей з ентероколітичним синдромом, індукованим білками коров’ячого молока, сумішей, що містять сою, у віці від 6 місяців, коли більша частина енергії надходить із продуктами прикорму [30, 37, 43, 44].
Козяче молоко і молоко інших тварин не може застосовуватися в харчуванні дітей через високу спорідненість до коров’ячого молока і високий ризик перехресної реактивності, а також незбалансованість і недостатність за нутритивним складом [30, 43]. У дітей із хронічним білокіндукованим ентероколітичним синдромом поліпшення стану зазвичай спостерігається на 3–10-й день із моменту переходу на гіпоалергенну суміш, проте в тяжких випадках може бути потреба в застосуванні часткового парентерального харчування [44].
Сьогодні існує багато спірних питань щодо ведення дітей із білокіндукованим ентероколітичним синдромом, а саме:
1. Потребує жорсткого уникнення у харчуванні продуктів навіть із термічно обробленим молоком або яйцем [6, 33, 45], оскільки є діти, які можуть переносити ці термічно оброблені продукти [46], проте дозвіл на їх вживання повинен надавати лікар і їх прийом в їжу мусить проводитися під наглядом лікаря.
2. Термін та умови повторного введення причинних продуктів — через 12–18 місяців після провокаційного тесту, по одному продукту, під наглядом лікаря [35].
3. Враховуючи те, що близько 50 % провокаційних проб потребували внутрішньовенних інфузій, у близько 15 % випадків спостерігався ризик розвитку шоку/гіпотензії, доцільно забезпечити внутрішньовенний доступ до початку введення продукту, особливо пацієнтам із тяжкими реакціями на харчову провокацію в анамнезі або дітям грудного віку, в яких можуть виникнути труднощі при постановці венозного доступу [33, 35, 44]. Для провокації потенційно перехресно реагуючими продуктами харчування внутрішньовенний доступ може бути не застосований.
4. Роль ондансетрону у веденні гострого ентероколітичного синдрому. Є повідомлення про ефективність ін’єкцій ондансетрону при гострому білок–індукованому ентероколітичному синдромі під час проведення провокаційних проб причинними продуктами в дітей раннього віку [46]. Ондансетрон взагалі добре переноситься. Однак він може бути причиною подовження інтервалу QT, а тому протипоказаний дітям із вадами серця або аритміями в анамнезі. Користь при застосуванні ондансетрону для ведення гострих реакцій ентероколітичного синдрому має бути ще доведена результатами досліджень [47].
5. Роль внутрішньовенного введення глюкокортикостероїдів в управлінні гострими реакціями. На підставі передбачуваної патогенезом білокіндукованого ентероколітичного синдрому тяжкої гострої запальної реакції є доцільним внутрішньовенне введення одноразової дози метилпреднізолону [47].
6. Роль адреналіну (епінефрину) у веденні гострих реакцій білокіндукованого ентероколітичного синдрому. Введення адреналіну не призводить до зупинки блювання, але може бути необхідним задля купування гіпотензії [48]. Епінефрин-шприц-ручка зазвичай не призначається хворим на білок–індукований ентероколітичний синдром, хіба що в них доведена IgE-сенсибілізація до харчових продуктів-тригерів, які визначають ризик негайної реакції [47].
7. Введення вакцин, що містять причинні продукти. Немає ніяких повідомлень про побічні реакції у вигляді ентероколітичного синдрому на сліди харчових білків, що були виявлені в складі деяких вакцин. Рекомендоване введення цих вакцин згідно зі стандартними протоколами [48].
Завданням лікарів в успішному лікуванні білок–індукованого ентероколітичного синдрому є вчасна діагностика, зменшення проміжку часу між першим епізодом і встановленням діагнозу. Адже його пізня діагностика загрожує високим ризиком появи неякісних діагностичних оцінок і помилкових методів лікування [49].
Білокіндукований алергічний проктоколіт. У дітей із цією патологією, що знаходяться на виключно грудному вигодовуванні, елімінація причинних харчових продуктів із раціону матері зазвичай призводить до поступового поліпшення симптомів на тлі продовження грудного вигодовування. Суміші на основі високогідролізованих білків та амінокислотні суміші не застосовуються для вирішення проблем, пов’язаних із кровотечею, як правило, в ме–жах 48–72 годин. Аналіз результатів рандомізованого контрольованого дослідження не показав ніякої користі від використання пробіотика порівняно з плацебо як доповнення до елімінаційної дієти матері в дітей із білокіндукованим алергічним проктоколітом [50].
У хворих на білокіндуковану ентеропатію елімінація алергенного продукту призводить до розрішення клінічної симптоматики протягом 1–3 тижнів. Діти з тяжкими початковими проявами можуть вимагати часткового парентерального харчування впродовж декількох днів або тижнів.
Висновки
На сьогодні не існує остаточно визнаного, заснованого на доказах лікування харчової алергії: елімінація харчових алергенів у комбінації з терапією системних реакцій, викликаних харчовими алергенами, залишається стандартним підходом у веденні таких пацієнтів. Доступні фармацевтичні препарати контролюють лише симптоми харчової алергії, проте не впливають на механізми імунних розладів.
Є нагальна потреба в проведенні численних нових досліджень, спрямованих на вивчення та аналіз імунних механізмів виникнення харчової алергії задля розроблення новітніх, насамперед дієвих лікувально-профілактичних заходів для ведення пацієнтів із цією поширеною і складною проблемою — харчовою алергією.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Vickery B.P. Oral immunotherapy for food allergy / B.P. Vi–ckery, W. Burks // Curr. Opin. Pediatr. — 2010. — Vol. 22. — P. 765-770.
2. Sackeyfio A. Diagnosis and assessment of food allergy in children and young people: summary of NICE guidance / A. Sackeyfio, A. Senthinathan, P. Kandaswamy, P.W. Barry, B. Shaw, M. Baker, Guideline Development Group // BMJ. — 2011. — Vol. 342. — d747.
3. Sicherer S.H. Food allergy / S.H. Sicherer, H.A. Sampson // J. Allergy Clin. Immunol. — 2010. — Vol. 125. — P. 116-125.
4. Lack G. Update on risk factors for food allergy / G. Lack J. // Allergy Clin. Immunol. — 2012. — Vol. 129. — P. 1187-1197.
5. Bunyavanich S. Peanut, milk, and wheat intake during pregnancy is associated with reduced allergy and asthma in children / S. Bunyavanich, S.L. Rifas-Shiman, T.A. Platts-Mills, L. Workman, J.E. Sordillo et al. // J. Allergy Clin. Immunol. — 2014. — Vol. 133. — P. 1373-1382.
6. Muraro A. EAACI Food Allergy and Anaphylaxis Guidelines Group / A. Muraro, T. Werfel, K. Hoffmann-Sommergruber et. al. // webversion.pdf (http://www.eaaci.org/foodallergyandanaphylaxisguidelines/Food%20Allergy%20%20web%20version.pdf)
7. Du Toit G. Effect of avoidance on peanut allergy after early peanut consumption / G. Du Toit, P.H. Sayre et al. // N. Engl. J. Med. — 2016. — Vol. 374. — P. 1435-1443.
8. Wong Yu. Food allergy: immune mechanisms, diagnosis andimmunotherapy / Wong Yu, Deborah M. Hussey Freeland, Kari C. Nadeau // Nat Rev Immunol. — 2016. — Vol. 16, № 2. — P. 751-765.
9. de Silva D. Acute and long-term management of food allergy: systematic review/ D. de Silva, M. Geromi, S.S. Panesar, A. Muraro, T. Werfel, K. Hoffmann-Sommergruber et al. // Allergy. — 2014. — Vol. 69, № 2. — P. 159-167.
10. Neustrom M.R. Treatment of eosinophilic gastroenteritis with montelukast / M.R. Neustrom, C. Friesen // J. Allergy Clin. Immunol. — 1999. — Vol. 104. — Р. 506.
11. Garrett J.K. Anti-interleukin-5 (mepolizumab) therapy for hypereosinophilic syndromes / J.K Garrett, S.C. Jameson, B. Thomson et al. // J. Allergy Clin. Immunol. — 2004. — Vol. 113. — P. 115-11.
12. Agostoni C. Coplementary feeding: a commentary by the –ESPGHAN Committee on Nutrition / C. Agostoni, T. Decsi, M. Fewtrell et al. // J. Ped. Gastroenterology and Nutrition. — 2008. — Vol. 46, № 1. — P. 99-110.
13. Attwood S.E. Eosinophilic oesophagitis: a novel treatment using Montelukast / S.E. Attwood, C.J. Lewis, C.S. Bronder, C.D. Morris, G.R. Armstrong, J. Whittam // Gut. — 2003. — Vol. 52. — Р. 181-185.
14. Шумилов П.В., Дубровская М.И., Юдина О.В. Эозинофильные воспалительные заболевания желудочно-кишечного тракта и пищевая аллергия у детей // Вопросы современной педиатрии. — 2007. — Т. 7, № 4. — С. 44-53.
15. Жерносек В.Ф., Дюбкова Т.П. Пищевая аллергия у детей первого года жизни: Учеб.-метод. пособ. — 2-е изд., перераб. и доп. — Минск: Эдит ВВ, 2007.
16. Bindslev-Jensen C. European Academy of Allergology and Clinical Immunology. Standardization of food challenges in patients with immediate reactions to foods-position paper from the European Academy of Allergology and Clinical Immunology / Bindslev-Jensen C., Ballmer-Weber B.K., Bengtsson U., Blanco C., Ebner C. et al. // Allergy. — 2004. — Vol. 59. — P. 690-697.
17. Chafen J.J. Diagnosing and managing common food allergies: a systematic review / J.J. Chafen, S.J. Newberry, M.A. Riedl, D.M. Bravata, M. Maglione et al. // JAMA. — 2010. — Vol. 303. — P. 1848-1856.
18. Calvani M. Specific oral toleranceтinduction for food. A systematic review / M. Calvani, V. Giorgio, S. Miceli Sopo // Eur. Ann. Allergy Clin. Immuno. — 2010. — Vol. 42. — P. 11-19.
19. Cardona V. Co-factor-enhanced food allergy / V. Cardona, O. Luengo, T. Garriga, M. Labrador-Horrillo, A. Sala-Cunill et al. // Allergy. — 2012. — Vol. 67. — P. 1316-1318.
20. Romano A. Lipid transfer proteins: the most frequent sensitizer in Italian subjects with food-dependent exercise-induced anaphylaxis / A. Romano, E. Scala, G. Rumi, F. Gaeta et al. // Clin. Exp. Allergy. — 2012. — Vol. 42. — P. 1643-1653.
21. Bousquet J. Practical guide to skin prick tests in allergy to aeroallergens / J. Bousquet, L. Heinzerling, C. Bachert et al. // Allergy. — 2012. — Vol. 67 — P. 18-24.
22. Price A. Oral allergy syndrome (pollen-food allergy syndrome) / A. Price, S. Ramachandran, G.P. Smith, M.L. Stevenson, M.K. Pomeranz, D.E. Cohen // Dermatitis. — 2015. — Vol. 26, № 2. — P. 78-88.
23. Geroldinger-Simic M. Birch pollen-related food allergy: clinical aspects and the role of allergen-specific IgE and IgG4 antibodies / M. Geroldinger-Simic, T. Zelnike, W. Aberer et al. // J. Allergy Clin. Immunol. — 2011. — Vol. 127, № 3. — P. 616-622.
24. Antonicelli L. Component resolved diagnosis in real life: the risk assessment of food allergy using microarray-based immunoassay / L. Antonicelli, C. Massaccesi, M.C. Braschi, B. Cinti, M.B. Bilò, F. Bonifazi // Eur. Ann. Allergy Clin. Immunol. — 2014. — Vol. 46, № 1. — P. 30-34.
25. Hofmann C. Cor a 1-reactive T cells and IgE are predominantly cross-reactive to Bet v 1 in patients with birch pollen-associated food allergy to hazelnut / C. Hofmann, S. Scheurer, K. Rost et al. // J. Allergy Clin. Immunol. — 2013. — Vol. 131, № 5. — P. 1384.e6-1392.e6.
26. Ahmed M. Eosinophilic esophagitis in adults: An update / M. Ahmed M. // World J. Gastrointest. Pharmacol. Ther. — 2016. –Vol. 7, № 2. — P. 207-213.
27. Carr S. Eosinophilic esophagitis / S. Carr, W. Watson // Allergy Asthma Clin. Immunol. — 2011. — Vol. 7, № 1. — P. 8.
28. Remedios M. Eosinophilic esophagitis in adults: clinical, endoscopic, histologic findings, and response to treatment with fluticasone propionate / M. Remedios, C. Campbell, D.M. Jones, P. Kerlin // Gastrointest Endosc. — 2006. — Vol. 63 — P. 3-12
29. Straumann A. Pediatric and adult eosinophilic esophagitis: similarities and differences / A. Straumann, S.S. Aceves, C. Blanchard et al. // Allergy. — 2012. — Vol. 67. — P. 477-490.
30. Koletzko S. Diagnostic approach and management of cow’s-milk protein allergy in infants and children: ESPGHAN GI Committee practical guidelines / S. Koletzko, B. Niggemann, A. Arato et al. // J. Pediatr. Gastroenterol. Nutr. — 2012. — Vol. 55. — P. 221-9.
31. Morais M.B. Allergy to cow milk protein / M.B. Morais, P. da G.L. Speridião, M.D. de Sillos, C.C. Ribeiro // Pediatr. Mod. — 2010. — Vol. 46, № 5. — P. 165-182.
32. Lozinsky A.C. Eosinophilic colitis in infants / A.C. Lozinsky, M.B. Morais // J. Pediatr. (Rio J.). — 2014. — Vol. 90, № 1. — P. 16-21.
33. Sampson H.A. Food allergy: a practice parameter update — 2014 / H.A. Sampson, S. Aceves, S.A. Bock et al. // J. Allergy Clin. Immunol. — 2014. — Vol. 134, № 5. — P. 1016-25.e43.
34. Venter C. Nutritional management of food protein-induced enterocolitis syndrome / C. Venter, M. Groetch // Curr. Opin. Allergy Clin. Immunol. — 2014. — Vol. 14, № 3. — P. 255-62.
35. Jarvinen K. Food protein-induced enterocolitis syndrome: current management strategies / K. Jarvinen, A. Nowak-Wegrzyn // J. Allergy Clin. Immunol. Pract. — 2013. — Vol. 1, № 4. — P. 317-22.
36. Miceli Sopo S. Clinical management of food protein-induced enterocolitis syndrome / S. Miceli Sopo, I. Dello Iacono, M. Greco, G. Monti // Curr. Opin. Allergy Clin. Immunol. — 2014. — Vol. 14. — P. 240-5.
37. Greer F.R. Effects of early nutritional interventions on the development of atopic disease in infants and children: the role of maternal dietary restriction, breastfeeding, timing of introduction of complementary foods, and hydrolyzed formulas / F.R. Greer, S.H. Sicherer, A.W. Burks // Pediatrics. — 2008. — Vol. 121. — P. 183-91.
38. Miceli Sopo S. Food protein-induced enterocolitis syndrome (FPIES) and well cooked foods: a working hypothesis / S. Miceli Sopo, D. Buonsenso, S. Monaco, S. Crocco, G. Longo, M. Calvani // Allergol Immunopathol. (Madr.). — 2010. — Vol. 3. — P.41: 346-8.
39. Nowak-Wegrzyn A. Tolerance to extensively heated milk in children with cow’s milk allergy / A. Nowak-Wegrzyn, K.A. Bloom, S.H. Sicherer et al. // J. Allergy Clin. Immunol. — 2008. — Vol. 122. — P. 342-7.
40. Ford L.S. Basophil reactivity, wheal size, and immunoglo–bulin levels distinguish degrees of cow’s milk tolerance / L.S. Ford, K.A. Bloom, A.H. Nowak-Wegrzyn, W.G. Shreffler, M. Masilamani, H.A. Sampson // J. Allergy Clin. Immunol. — 2013. — Vol. 131. — P. 180-6.
41. Caubet J.C. Clinical features and resolution of food protein-induced enterocolitis syndrome: 10-year experience / J.C. Caubet, L.S. Ford, L. Sickles et al. // J. Allergy Clin. Immunol. — 2014. — Vol. 134. — P. 382-9.
42. Nowak-Wegrzyn A. Food protein-induced enterocolitis syndrome caused by solid food proteins / A. Nowak-Wegrzyn, H.A. Sampson, R.A. Wood, S.H. Sicherer // Pediatrics. — 2003. — Vol. 111. — P. 829-35.
43. Sopo S.M. A multicentre retrospective study of 66 Italian children with food protein-induced enterocolitis syndrome: different management for different phenotypes / S.M. Sopo, V. Giorgio, I. Dello Iacono, E. Novembre, F. Mori, R. Onesimo // Clin. Exp. Allergy. — 2012. — Vol. 42. — P. 1257-65.
44. Katz Y. The prevalence and natural course of food protein-induced enterocolitis syndrome to cow’s milk: a largescale, prospective population-based study / Y. Katz, M.R. Goldberg, N. Rajuan, A. Cohen, M. Leshno // J. Allergy Clin. Immunol. — 2011. — Vol. 127. — P. 647-53.
45. Mane S.K. Food protein-induced enterocolitis syndrome to trivial oral mucosal contact / S.K. Mane, M.E. Hollister, S.L. Bahna // Eur. J. Pediatr. — 2014. — Vol. 173. — P. 1545-7.
46. Fiocchi A. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow’s Milk Allergy (DRACMA) guidelines / A. Fiocchi, J. Brozek, H. Schünemann et al. // Pediatr. Allergy Immunol. — 2010. — Vol. 21, № 21. — P. 1-125.
47. Holbrook T. Use of ondansetron for food protein-induced enterocolitis syndrome / T. Holbrook, C.A. Keet, P.A. Frischmeyer-Guerrerio, R.A. Wood // J. Allergy Clin. Immunol. — 2013. — Vol. 132. — P. 1219-20.
48. Nowak-Węgrzyn A. Non-IgE-mediated gastrointestinal food allergy / A. Nowak-Węgrzyn, Y. Katz, S.S. Mehr, S. Koletzko // J. Allergy Clin. Immunol. — 2015. — Vol. 135. — P. 1114-24.
49. Fernandes B.N. Food protein-induced enterocolitis syndrome can occur in adults / B.N. Fernandes, R.J. Boyle, C. Gore, A. Simpson, A. Custovic // J. Allergy Clin. Immunol. — 2012. — Vol. 130. — P. 1199-200.
50. Schultz F. Food protein-induced enterocolitis syndrome from the parent perspective / F. Schultz, A. Westcott-Chavez // Curr. Opin. Allergy Clin. Immunol. — 2014. — Vol. 14. — P. 263-267.