Журнал «Здоровье ребенка» Том 13, №2, 2018
Подавление бактериальных факторов вирулентности как метод лечения бактериальных пневмоний
Авторы: Абатуров А.Е.(1), Крючко Т.А.(2)
(1) — ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
(2) — ВГУЗУ «Украинская медицинская стоматологическая академия», г. Полтава, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Резюме
Неухильне зростання антибіотикорезистентних бактеріальних штамів в етіологічній структурі пневмоній, виснаження потенціалу антибактеріальної терапії підвищують значення лікарських засобів, дія яких спрямована на нейтралізацію головних чинників вірулентності, причинно-значимих бактеріальних агентів. Серед медикаментозних методів контролю інфекційного процесу за допомогою усунення бактеріальних факторів вірулентності виділяють: пригнічення продукції бактеріальних факторів вірулентності, нейтралізацію чинників вірулентності, блокування рецепторів, які розпізнають фактори вірулентності. Одним із можливих методів лікування малокурабельних форм пневмонії, викликаних антибіотикорезистентними штамами, є використання специфічних для певних антигенів респіраторно-тропних патогенів моноклональних антитіл (mAb). На даний час розроблені технології, що дозволяють отримати повністю гуманізовані mAb, що відрізняються мінімальним рівнем імуногенності і токсичності. З огляду на високий аффінітет бактеріальних пороутворюючих токсинів до ліпідного бішару клітинних мембран макроорганізму альтернативою специфічним mAb як нейтралізаторам бактеріальних факторів вірулентності є неспецифічні ліпідні секвестранти, експериментальне використання яких запобігає розвитку фатальної септицемії.
Неуклонный рост антибиотикорезистентных бактериальных штаммов в этиологической структуре пневмоний, истощение потенциала антибактериальной терапии повышают значение лекарственных средств в лечении пневмоний, действие которых направлено на нейтрализацию факторов вирулентности, причинно-значимых бактериальных агентов. Среди медикаментозных способов контроля инфекционного процесса при помощи подавления бактериальных факторов вирулентности выделяют: ингибирование продукции бактериальных факторов вирулентности, нейтрализацию факторов вирулентности, блокировку рецепторов, распознающих факторы вирулентности. Одним из возможных методов лечения малокурабельных форм пневмонии, вызванных антибиотикорезистентными штаммами, является использование специфических для определенных антигенов респираторно-тропных патогенов моноклональных антител (mAb). В настоящее время разработаны технологии, позволяющие получать полностью гуманизированные mAb, которые отличаются минимальным уровнем иммуногенности и токсичности. Учитывая высокий аффинитет бактериальных порообразующих токсинов к липидному бислою клеточных мембран макроорганизма, альтернативой специфическим mAb в качестве нейтрализаторов бактериальных факторов вирулентности являются неспецифические липидные секвестранты, экспериментальное использование которых предотвращает развитие фатальной септицемии.
Incremental increase in the number of antibiotic-resistant bacterial strains in the etiologic structure of pneumonia and reduced potential of antibiotic therapy increase the importance of drugs in the treatment of pneumonia, which are aimed at neutralizing virulence factors of etiologically significant bacterial agents. There are the following drug methods for monitoring the infectious process by suppressing bacterial virulence factors: inhibition of production of bacterial virulence factors, neutralizing virulence factors, blocking of receptors, blocking of receptors recognizing virulence factors. One possible method for the treatment of low-curable forms of pneumonia caused by antibiotic-resistant strains is the use of monoclonal antibodies (mAb) specific for certain antigens of respiratory-tropic pathogens. At present, technologies have been developed that make it possible to obtain fully humanized mAbs, which have a minimal level of immunogenicity and toxicity. In view of the high affinity of bacterial pore-forming toxins to the lipid bilayer of the cell membranes of the macroorganism, an alternative to specific mAbs as neutralizers of bacterial virulence factors are non-specific lipid sequestrants, wherein the experimental use of these sequestrants prevents the development of fatal septicemia.
Ключевые слова
пневмонії; бактеріальні фактори вірулентності; моноклональні антитіла
пневмонии; бактериальные факторы вирулентности; моноклональные антитела
pneumonia; bacterial virulence factors; monoclonal antibodies
Введение
Увеличение удельного веса антибиотикорезистентных бактериальных штаммов в этиологической структуре пневмоний и истощение потенциала антибактериальной терапии повышают значение в спектре препаратов, используемых или разрабатываемых для лечения пневмоний, лекарственных средств, действие которых направлено на нейтрализацию факторов вирулентности, причинно-значимых бактериальных агентов. Среди медикаментозных способов контроля инфекционного процесса при помощи подавления бактериальных факторов вирулентности выделяют: ингибирование продукции (экспрессии генов и секреции) бактериальных факторов вирулентности, нейтрализацию факторов вирулентности, блокировку рецепторов, распознающих факторы вирулентности [31].
Подавление продукции бактериальных факторов вирулентности
Уменьшение активности экспрессии генов, кодирующих бактериальные факторы вирулентности, является высокоэффективным методом управления инфекционным процессом респираторного тракта. Установлено, что вирстатин (Virstatin) ингибирует биогенез пили, подвижность и механизм quorum-sensing у мультирезистентных нозокомиальных бактерий Acinetobacter baumannii [33, 34].
Продемонстрировано, что препарат AFN-1252, который представляет собой ингибитор эноилацилпротеинредуктазы, способствует быстрому увеличению экспрессии генов синтеза жирных кислот в бактериях Staphylococcus aureus, тем самым нарушая сигнальный путь, ассоциированный с двухкомпонентным регулятором SaeRS, и подавляя экспрессию генов таких факторов вирулентности, как α-токсин, b- и γ-гемолизины, двух фибриногенсвязывающих адгезинов. Применение AFN-1252 при лечении мышей с респираторной инфекцией, вызванной бактериями Staphylococcus aureus, способствует выживанию экспериментальных животных [27, 35, 45].
Лекарственные средства, подавляющие секрецию факторов вирулентности бактерий, которые вызывают респираторные инфекции, не разработаны.
Нейтрализация активности факторов вирулентности
В качестве препаратов, нейтрализующих активность бактериальных факторов вирулентности, разрабатываются лекарственные средства, в основе которых лежат специфические моноклональные антитела и секвестранты.
Специфические моноклональные антитела
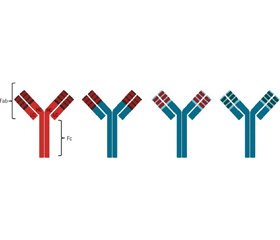
Одним из возможных методов лечения малокурабельных форм пневмонии, вызванных антибиотикорезистентными штаммами, является использование специфических для определенных антигенов респираторно-тропных патогенов моноклональных антител (mAb). Первоначально в 1975 году Георгом Келером и Цезарем Мильштейном [22] был разработан способ получения мышиных mAb на основе гибридомной технологии. Гибридомы представляют собой гибрид антителообразующей и опухолевой клеток, способный синтезировать антитела и неограниченно пролиферировать. В последующем уменьшение доли аминокислотной последовательности мышиного IgG позволило разработать новые генерации препаратов mAb: химерные рекомбинантные mAb состоят из вариабельных областей (F(ab’)2) мышиного Ig, слитых с константными областями (Fc) человека; гуманизированные рекомбинантные mAb содержат мышиные CDR (complementarity determining region — участки, задействованные в распознавании антигена) и полностью гуманизированные рекомбинантные mAb (рис. 1). Гуманизация mAb в основном направлена на снижение их иммуногенности, но если химерные mAb показали улучшение переносимости и эффективности, то преимущества гуманизированных и полностью гуманизированных рекомбинантных mAb перед химерными не имеют достоверного характера [5, 39].
/106-1.jpg)
Препараты моноклональных антител имеют названия, которые заканчиваются на «-mab» (от monoclonal antibody). Когда используются мышиные антитела, в название препарата добавляется буква «о», и окончание у таких антительных препаратов «-omab». Препараты химерных антител имеют окончание «-ximab», гуманизированных антител — «-zumab», полностью гуманизированных антител — «-umab» [1].
Использование mAb при проведении пассивной иммунизации больного пневмонией позволяет нейтрализовать PAMP и факторы вирулентности причинно-значимого патогена и улучшить условия для саногенетических процессов. В настоящее время разработаны технологии, позволяющие получать полностью гуманизированные mAb, которые отличаются минимальным уровнем иммуногенности и токсичности. Библиотеки фагов, экспрессирующих полностью гуманизированные антитела, представлены на сайте www.sciencedirect.com [10].
Антистрептококковые моноклональные антитела
Sascha A. Kristian и соавт. [24] считают, что разработка препаратов пассивной иммунизации, содержащих mAb против факторов вирулентности бактерий Streptococcus pneumoniae, имеет терапевтический потенциал, который невозможно переоценить.
Учитывая, что вирулентность бактерий Streptococcus pneumoniae в значительной степени обусловлена компонентами полисахаридной капсулы, которая защищает их от влияний иммунной системы макроорганизма [15], разработаны mAb, нейтрализующие пневмококковый капсульный полисахарид (pneumococcal capsular polysaccharide — PPS). Установлено, что применение данных mAb способствует достоверному усилению бактериального киллинга. Известно, что PPS-связывающие антитела защищают макроорганизм от бактерий пневмококка, индуцируя опсонический киллинг микроорганизмов гомологичного серотипа; также mAb, нейтрализующие пневмококковый капсульный полисахарид, изменяют экспрессию генов, участвующих в quorum-sensing, что сопровождается снижением выживаемости бактерий [48].
Другим наиболее распространенным из определяющих вирулентность протеинов бактерий Streptococcus pneumoniae факторов является пневмококковый поверхностный белок A (surface protein A — SpA). В частности, показано, что SpA играет определяющую роль в колонизации носоглотки, инфицировании легких и развитии бактериемии. Протеин SpA предотвращает фагоцитоз, ингибируя опсонизацию бактериальных клеток, опосредованную комплементом [20, 43]. Sascha A. Kristian и соавт. [24] разработали mAb 140H1 против SpA, которые связываются с 98 % из 48 штаммов Streptococcus pneumoniae, включая представителей наиболее клинически значимых кластеров PspA 1–5. Широкий спектр связывания mAb 140H1 авторы объясняют тем, что распознаваемый эпитоп расположен в домене PRR SpA, который хорошо сохраняется в семействе SpA.
Антистафилококковые моноклональные антитела
Казалось бы, использование препаратов mAb, которые нейтрализуют поверхностные бактериальные протеины, может обеспечить решение терапевтической проблемы некурабельности некоторых бактериальных инфекций, однако клинические испытания пагибаксимаба (pagibaximab) [36] и тефибазумаба (tefibazumab), mAb, направленных против липотейхоевой кислоты Staphylococcus aureus, продемонстрировали недостаточную их эффективность. Также было прекращено клиническое исследование II фазы препарата SAR279356, содержащего mAb против поли-N-ацетилглюкозамина [19]. Несмотря на неудачи, исследователи считают, что применение антивирулентных mAb станет эффективным методом лечения пневмоний, вызванных антибиотикорезистентными бактериями.
Антивирулентная терапия, разрабатываемая для терапии больных со стафилококковой пневмонией, представлена более широким спектром препаратов, содержащих нейтрализующие антитела (табл. 1).
Антисинегнойные моноклональные антитела
Одним из наиболее изученных антибактериальных mAb-препаратов, разработанных для лечения инфекций, вызванных Pseudomonas aeruginosa, является панобакумаб (panobacumab). Результаты клинических испытаний IIa фазы свидетельствуют о том, что назначение панобакумаба больным пневмонией, вызванной Pseudomonas aeruginosa, способствует благоприятному течению заболевания и более быстрому выздоровлению пациентов [37]. Также разработаны высокофункциональные широко реагирующие mAb KB001, Cam-003 и V2L2-MD, специфичные для PcrV бактерий Pseudomonas aeruginosa. Данные препараты mAb показали достаточный уровень эффективности на нескольких моделях синегнойной инфекции у мышей. Известно, что PcrV предотвращает подкисление фагосом и тем самым подавляет бактериальный киллинг внутри фагосом. Антитело-опосредованное ингибирование фактора вирулентности PcrV не усиливает активность фагоцитоза бактерий, но способствует киллингу бактерий, располагающихся в нейтрофильных фагосомах [30, 32, 47]. В настоящее время созданы биспецифические mAb, способные нейтрализовать одновременно два фактора вирулентности — PcrV и Psl. Одной из наиболее испытанных биспецифических молекул IgG с антисинегнойной направленностью является MEDI3902. Биспецифические mAb, нацеленные на PcrV и Psl, усиливают как нейтрофильный фагоцитоз, так и внутриклеточный бактериальный киллинг [44]. Ajitha Thanabalasuriar и соавт. [44] показали, что бактерии Pseudomonas aeruginosa связываются с эндотелиоцитами сосудов ткани легких, но не ткани печени, а также избегают за счет фактора вирулентности Psl взаимодействия с пульмональными нейтрофилами легких, но не Mϕ печени (клетки Купфера). Представляет интерес то, что массивность связывания бактерий Pseudomonas aeruginosa с эндотелиоцитами сосудов ткани легких и низкий уровень их нейтрофильного фагоцитоза ассоциированы с риском летального исхода заболевания. В этой ситуации применение MEDI3902 приводит к привлечению нейтрофилов к процессу элиминации бактерий Pseudomonas aeruginosa. Назначение MEDI3902 инфицированным мышам, в отличие от применения mAb против PcrV или mAb против Psl, сопровождается снижением уровня провоспалительных цитокинов и хемокинов в ткани легкого уже через 6 часов после введения препарата. Вероятно, что биспецифические моноклональные антитела MEDI3902 способствуют эффективному нейтрофильному клиренсу бактерий Pseudomonas aeruginosa из ткани легкого, но без избыточного клеточного лизиса, который приводит к нежелательному высвобождению протеаз и других молекул, вызывающих поражение тканей макроорганизма. Антитела MEDI3902 усиливают нейтрофильный фагоцитоз бактерий Pseudomonas aeruginosa, а также позволяют нейтрофилам захватывать больше чем одну бактерию. Не исключено, что mAb MEDI3902 ингибируют механизм секреции T3SS. В настоящее время mAb MEDI3902 проходят клиническое испытание IIb фазы, уточняющее возможность предотвращения развития пневмонии во время ИВЛ [14].
Антивирулентная терапия, разрабатываемая на основе mAb для терапии больных с синегнойной инфекцией, представлена в табл. 2.
Антиклебсиеллезные моноклональные антитела
Одним из возможных направлений альтернативной терапии клебсиеллезной пневмонии, ингибирующей факторы вирулентности, является применение капсулосвязывающих mAb. В частности, продемонстрировано, что применение mAb IgG1, направленных против K1-CPS капсулярного полисахарида (K1-serotype capsular polysaccharide) –бактерий Klebsiella pneumoniae, при пневмонии и при сепсисе способствует выживанию экспериментальных животных [7]. Однако с учетом высокой гетерогенности CPS бактерий Klebsiella pneumoniae применение данных mAb возможно только после точной серологической идентификации возбудителя. Следовательно, вероятность клинической эффективности применения антител, которые направлены на консервативные антигены, такие как О-антиген LPS, в частности гуманизированных mAb A1102, превышает таковую антикапсулярных антител [42]. Rachelle Babb и Liise-anne Pirofski [4] считают, что mAb A1102 могут использоваться в качестве специ–фического секвестранта LPS бактерий Klebsiella pneumoniae. Антитела A1102 демонстрируют высокий аффинитет к О-антигену LPS и нейтрализуют LPS in vitro значительно эффективнее, чем полимиксин B. При инвазивной инфекции, вызванной Klebsiella pneumoniae, назначение mAb A1102 в дозе 3 мкг/кг у мышей и 2 мкг/кг у кроликов сопровождается повышением уровня выживаемости у экспериментальных животных. Однако необходимо учитывать, что эффективность mAb A1102 отмечается исключительно при их назначении до момента инфицирования.
Секвестранты бактериальных факторов вирулентности
Липидные секвестранты
Учитывая высокий аффинитет бактериальных порообразующих токсинов к липидному бислою клеточных мембран макроорганизма, альтернативой специфическим mAb в качестве нейтрализаторов бактериальных факторов вирулентности являются неспецифические липидные секвестранты [31].
Brian D. Henry и соавт. [16] разработали искусственные липосомы, которые связывают бактериальные токсины — α-токсин, пневмолизин Streptococcus pneumoniae. Применение данных липосом у экспериментальных животных предотвращало развитие фатальной септицемии у мышей.
Липиды, упакованные в метил-b-циклодекстрин (CD), способны изолировать бактериальные токсины. В частности, показано, что CD-соединение IB201 блокирует индуцированный α-токсином Staphylococcus aureus лизис альвеолярных эпителиальных клеток человека [3, 38]. Также продемонстрировано, что CD-холестерин секвестрирует α-токсин Staphylococcus aureus и препятствует развитию инфекционного процесса [29].
Биомиметические наногубки
Для секвестрации бактериальных токсинов разработаны особые биологические наноструктуры, которые получили название «биомиметические наногубки» (biomimetic nanosponge — BN) [11]. Данные биомиметические губки состоят из полимерного ядра наночастиц, окруженного естественной мембраной эритроцитов (рис. 2). Было установлено, что BN способны связывать порообразующие токсины бактерий Staphylococcus aureus и повышать выживаемость экспериментальных мышей при развитии инфекции [17, 21, 26].
/110-2.jpg)
Применение BN, у которых использовалась мембрана тромбоцитов, повышает эффективность терапии ванкомицином при системной стафилококковой инфекции [25]. Стрептококковый фактор вирулентности — порообразующий стрептолизин O (streptolysin O — SLO), который продуцируется практически всеми клиническими изолятами Streptococcus A-группы, также может быть секвестрирован BN эритроцитов. Применение BN защищает человеческие нейтрофилы, макрофаги и кератиноциты от SLO-ассоциированной цитотоксичности. Терапия BN предотвращает SLO-индуцированный апоптоз макрофагов и способствует ускорению бактериального клиренса [5]. Согласно мнению Tamara Escajadillo и соавт. [13], применение BN представляет собой новое направление терапии, которое может быть дополнительным методом лечения тяжелых форм стрептококковой инфекции.
Блокирование рецепторов, связывающихся с бактериальными факторами вирулентности
Блокирование рецепторов макроорганизма к бактериальным факторам вирулентности представляется многообещающей терапевтической концепцией. В частности, установлено, что маломолекулярный ингибитор металлопротеазы ADAM10 (ADAM metallopeptidase domain 10), которая является рецептором для α-токсина бактерий Staphylococcus aureus, снижает риск летального исхода при стафилококковой пневмонии [12, 18, 28].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Будчанов Ю.И. Моноклональные антитела: от создания до клинического применения // Клиническая онкогематология. Фундаментальные исследования и клиническая практика. — 2016. — Т. 9, № 3. — С. 237-244.
2. Adawi A. In vitro and in vivo properties of a fully human IgG1 monoclonal antibody that combats multidrug resistant Pseudomonas aeruginosa / A. Adawi, C. Bisignano, T. Genovese et al. // Int. J. Mol. Med. 2012 Sep; 30(3): 455-64. doi: 10.3892/ijmm.2012.1040.
3. Baaske R. ATP Release from Human Airway Epithelial Cells Exposed to Staphylococcus aureus Alpha-Toxin / R. Baaske, M. Richter, N. Möller et al. // Toxins (Basel). 2016 Dec 6; 8(12). pii: E365. doi: 10.3390/toxins8120365.
4. Babb R., Pirofski L.A. Help is on the way: Monoclonal antibody therapy for multi-drug resistant bacteria // Virulence. 2017 Mar 17: 1-4. doi: 10.1080/21505594.2017.1306620.
5. Chhabria V., Beeton S. Development of nanosponges from erythrocyte ghosts for removal of streptolysin-O from mammalian blood // Nanomedicine (Lond). 2016 Oct 21. doi: 10.2217/nnm-2016-0180.
6. Congy-Jolivet N. Recombinant therapeutic monoclonal antibodies: mechanisms of action in relation to structural and functional duality / N. Congy-Jolivet, A. Probst, H. Watier, G. Thibault // Crit. Rev. Oncol. Hematol. 2007 Dec; 64(3): 226-33. doi: 10.1016/j.critrevonc.2007.06.013.
7. Diago-Navarro E. Antibody-Based Immunotherapy To Treat and Prevent Infection with Hypervirulent Klebsiella pneumoniae / E. Diago-Navarro, I. Calatayud-Baselga, D. Sun et al. // Clin. Vaccine Immunol. 2017 Jan 5; 24(1). pii: e00456-16. doi: 10.1128/CVI.00456-16.
8. DiGiandomenico A. A multifunctional bispecific antibody protects against Pseudomonas aeruginosa / A. DiGiandomenico, A.E. Keller, C. Gao et al. // Sci Transl. Med. 2014 Nov 12; 6(262): 262ra155. doi: 10.1126/scitranslmed.3009655.
9. DiGiandomenico A. Identification of broadly protective human antibodies to Pseudomonas aeruginosa exopolysaccharide Psl by phenotypic screening / A. DiGiandomenico, P. Warrener, M. Hamilton et al. // J. Exp. Med. 2012 Jul 2; 209(7): 1273-87. doi: 10.1084/jem.20120033.
10. DiGiandomenico A., Sellman B.R. Antibacterial monoclonal antibodies: the next generation? // Curr. Opin Microbiol. 2015 Oct; 27: 78-85. doi: 10.1016/j.mib.2015.07.014.
11. Distler U., Tenzer S. Tools for Pathogen Proteomics: Fi–shing with Biomimetic Nanosponges // ACS Nano. 2017 Nov 20. doi: 10.1021/acsnano.7b07363.
12. Dreymueller D. ADAM-family metalloproteinases in lung inflammation: potential therapeutic targets / D. Dreymueller, S. Uhlig, A. Ludwig et al. // Am. J. Physiol. Lung Cell Mol. Physiol. 2015 Feb 15; 308(4): L325-43. doi: 10.1152/ajplung.00294.2014.
13. Escajadillo T. A Red Blood Cell Membrane-Camouflaged Nanoparticle Counteracts Streptolysin O-Mediated Virulence Phenotypes of Invasive Group A Streptococcus / T. Escajadillo, J. Olson, B.T. Luk et al. // Front Pharmacol. 2017 Jul 18; 8: 477. doi: 10.3389/fphar.2017.00477.
14. EVADE (Effort to prevent nosocomial pneumonia caused by Pseudomonas aeruginosa in mechanically ventilated subjects). NIH Web site. https: //clinicaltrials.gov/ct2/show/NCT02696902?term = MEDI3902&rank = 2 Published February 11, 2016. Accessed March 15, 2017.
15. Geno K.A. Pneumococcal Capsules and Their Types: Past, Pre–sent, and Future / K.A. Geno, G.L. Gilbert, J.Y. Song et al. // Clin. Microbiol. Rev. 2015 Jul; 28(3): 871-99. doi: 10.1128/CMR.00024-15.
16. Henry B.D. Engineered liposomes sequester bacterial exoto–xins and protect from severe invasive infections in mice / B.D. Henry, D.R. Neill, K.A. Becker et al. // Nat. Biotechnol. 2015 Jan; 33(1): 81-8. doi: 10.1038/nbt.3037.
17. Hu C.M. A biomimetic nanosponge that absorbs pore-forming toxins / C.M. Hu, R.H. Fang, J. Copp et al. // Nat. Nanotechnol. 2013 May; 8(5): 336-40. doi: 10.1038/nnano.2013.54.
18. Inoshima I. A Staphylococcus aureus pore-forming toxin subverts the activity of ADAM10 to cause lethal infection in mice / I. Ino–shima, N. Inoshima, G.A. Wilke et al. // Nat. Med. 2011 Sep 18; 17(10): 1310-4. doi: 10.1038/nm.2451.
19. Kelly-Quintos C. Characterization of the opsonic and protective activity against Staphylococcus aureus of fully human monoclonal antibodies specific for the bacterial surface polysaccharide poly-N-acetylglucosamine / C. Kelly-Quintos, L.A. Cavacini, M.R. Posner et al. // Infect. Immun. 2006 May; 74(5): 2742-50. doi: 10.1128/IAI.74.5.2742-2750.2006.
20. Khan N., Jan A.T. Towards Identifying Protective B-Cell Epitopes: The PspA Story // Front Microbiol. 2017 May 2; 8: 742. doi: 10.3389/fmicb.2017.00742.
21. Kirkham L.A. Construction and immunological characterization of a novel nontoxic protective pneumolysin mutant for use in future pneumococcal vaccines / L.A. Kirkham, A.R. Kerr, G.R. Douce et al. // Infect. Immun. 2006 Jan; 74(1): 586-93. doi: 10.1128/IAI.74.1.586-593.200.
22. Köhler G., Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity // Nature. 1975 Aug 7; 256(5517): 495-7. PMID: 1172191.
23. Kong C., Neoh H.M., Nathan S. Targeting Staphylococcus aureus Toxins: A Potential form of Anti-Virulence Therapy // Toxins (Basel). 2016 Mar 15; 8(3). pii: E72. doi: 10.3390/toxins8030072.
24. Kristian S.A. Generation and Improvement of Effector Function of a Novel Broadly Reactive and Protective Monoclonal Antibody against Pneumococcal Surface Protein A of Streptococcus pneumo–niae / S.A. Kristian, T. Ota, S.S. Bubeck et al. // PLoS One. 2016 May 12; 11(5): e0154616. doi: 10.1371/journal.pone.0154616.
25. Kumar A., Kumar A. Role of Staphylococcus aureus Virulence Factors in Inducing Inflammation and Vascular Permeability in a Mouse Model of Bacterial Endophthalmitis // PLoS One. 2015 Jun 8; 10(6): e0128423. doi: 10.1371/journal.pone.0128423.
26. LaGrow A.L. A Novel Biomimetic Nanosponge Protects the Retina from the Enterococcus faecalis Cytolysin / A.L. LaGrow, P.S. Coburn, F.C. Miller et al. // mSphere. 2017 Nov 22; 2(6). pii: e00335-17. doi: 10.1128/mSphere.00335-17.
27. Liu Q., Yeo W.S., Bae T. The SaeRS Two-Component System of Staphylococcus aureus // Genes (Basel). 2016 Oct 3; 7(10). pii: E81. doi: 10.3390/genes7100081.
28. Matthews A.L. Scissor sisters: regulation of ADAM10 by the TspanC8 tetraspanins / A.L. Matthews, J. Szyroka, R. Collier et al. // Biochem. Soc. Trans. 2017 Jun 15; 45(3): 719-730. doi: 10.1042/BST20160290.
29. McCormick C.C. Chemical inhibition of alpha-toxin, a key corneal virulence factor of Staphylococcus aureus / C.C. McCormick, A.R. Caballero, C.L. Balzli et al. // Invest. Ophthalmol. Vis. Sci. 2009 Jun; 50(6): 2848-54. doi: 10.1167/iovs.08-3157.
30. Milla C.E. Anti-PcrV antibody in cystic fibrosis: a novel approach targeting Pseudomonas aeruginosa airway infection // C.E. Milla, J.F. Chmiel, F.J. Accurso et al. // Pediatr. Pulmonol. 2014 Jul; 49(7): 650-8. doi: 10.1002/ppul.22890.
31. Munguia J., Nizet V. Pharmacological Targeting of the Host-Pathogen Interaction: Alternatives to Classical Antibiotics to Combat Drug-Resistant Superbugs // Trends Pharmacol. Sci. 2017 May; 38(5): 473-488. doi: 10.1016/j.tips.2017.02.003.
32. Murphy A.J. Mice with megabase humanization of their immunoglobulin genes generate antibodies as efficiently as normal mice / A.J. Murphy, L.E. Macdonald, S. Stevens et al. // Proc. Natl. Acad. Sci USA. 2014 Apr 8; 111(14): 5153-8. doi: 10.1073/pnas.1324022111.
33. Nait Chabane Y. Virstatin inhibits biofilm formation and motility of Acinetobacter baumannii / Y. Nait Chabane, M.B. Mlouka, S. Alexandre et al. // BMC Microbiol. 2014 Mar 12; 14: 62. doi: 10.1186/1471-2180-14-62.
34. Oh M.H., Choi C.H. Role of LuxIR Homologue AnoIR in Acinetobacter nosocomialis and the Effect of Virstatin on the Expression of anoR Gene // J. Microbiol Biotechnol. 2015 Aug; 25(8): 1390-400. doi: 10.4014/jmb.1504.04069.
35. Parsons J.B. Perturbation of Staphylococcus aureus gene expression by the enoyl-acyl carrier protein reductase inhibitor AFN-1252 / J.B. Parsons, M. Kukula, P. Jackson et al. // Antimicrob Agents Chemother. 2013 May; 57(5): 2182-90. doi: 10.1128/AAC.02307-12.
36. Patel M., Kaufman D.A. Anti-lipoteichoic acid monoclonal antibody (pagibaximab) studies for the prevention of staphylococcal bloodstream infections in preterm infants // Expert Opin Biol. Ther. 2015 Apr; 15(4): 595-600. doi: 10.1517/14712598.2015.1019857.
37. Que Y.A. Assessment of panobacumab as adjunctive immunothe–rapy for the treatment of nosocomial Pseudomonas aeruginosa pneumonia / Y.A. Que, H. Lazar, M. Wolff et al. // Eur. J. Clin. Microbiol. Infect. Dis. 2014 Oct; 33(10): 1861-7. doi: 10.1007/s10096-014-2156-1.
38. Ragle B.E., Karginov V.A., Bubeck Wardenburg J. Prevention and treatment of Staphylococcus aureus pneumonia with a beta-cyclodextrin derivative // Antimicrob. Agents Chemother. 2010 Jan; 54(1): 298-304. doi: 10.1128/AAC.00973-09.
39. Rodgers K.R., Chou R.C. Therapeutic monoclonal antibo–dies and derivatives: Historical perspectives and future directions // Biotechnol. Adv. 2016 Nov 1; 34(6): 1149-58. doi: 10.1016/j.biotechadv.2016.07.004.
40. Roux D., Pier G.B., Skurnik D. Magic bullets for the 21st century: the reemergence of immunotherapy for multi- and pan-resistant microbes // J. Antimicrob. Chemother. 2012 Dec; 67(12): 2785-7. doi: 10.1093/jac/dks335.
41. Song Y. PcrV antibody-antibiotic combination improves survival in Pseudomonas aeruginosa-infected mice / Y. Song, M. Baer, R. Srinivasan et al. // Eur. J. Clin. Microbiol. Infect. Dis. 2012 Aug; 31(8): 1837-45. doi: 10.1007/s10096-011-1509-2.
42. Szijártó V. Endotoxin neutralization by an O-antigen specific monoclonal antibody: A potential novel therapeutic approach against Klebsiella pneumoniae ST258 / V. Szijártó, L.M. Guachalla, K. Hartl et al. // Virulence. 2017 Jan 19: 1-13. doi: 10.1080/21505594.2017.1279778.
43. Tai S.S. Streptococcus pneumoniae protein vaccine candidates: properties, activities and animal studies // Crit. Rev. Microbiol. 2006; 32(3): 139-53. PMID: 16893751.
44. Thanabalasuriar A. Bispecific antibody targets multiple Pseudomonas aeruginosa evasion mechanisms in the lung vasculature / A. Thanabalasuriar, B.G. Surewaard, M.E. Willson et al. // J. Clin. Invest. 2017 Jun 1; 127(6): 2249-2261. doi: 10.1172/JCI89652.
45. Tsuji B.T. Activity of AFN-1252, a novel FabI inhibitor, against Staphylococcus aureus in an in vitro pharmacodynamic model simulating human pharmacokinetics / B.T. Tsuji, Y. Harigaya, A.J. Lesse et al. // J. Chemother. 2013 Feb; 25(1): 32-5. doi: 10.1179/1973947812Y.0000000060.
46. Vuong C. Investigational drugs to treat methicillin-resistant Staphylococcus aureus / C. Vuong, A.J. Yeh, G.Y. Cheung, M. Otto // Expert Opin Investig. Drugs. 2016; 25(1): 73-93. doi: 10.1517/13543784.2016.1109077.
47. Warrener P. A novel anti-PcrV antibody providing enhanced protection against Pseudomonas aeruginosa in multiple animal infection models / P. Warrener, R. Varkey, J.C. Bonnell et al. // Antimicrob. Agents Chemother. 2014 Aug; 58(8): 4384-91. doi: 10.1128/AAC.02643-14.
48. Yano M. Antibodies to Streptococcus pneumoniae capsular polysaccharide enhance pneumococcal quorum sensing / M. Yano, S. Gohil, J.R. Coleman et al. // MBio. 2011 Nov 1; 2(5). pii: e00176-11. doi: 10.1128/mBio.00176-11.

/106-1.jpg)
/108-1.jpg)
/109-1.jpg)
/110-1.jpg)
/110-2.jpg)