Журнал «Актуальная инфектология» Том 6, №4, 2018
Вернуться к номеру
Дослідження центральної та периферичної гемодинаміки у дітей із сепсисом за допомогою ехокардіографії та ультразвукової допплерографії
Авторы: Євтушенко В.В., Шадрін В.О.
Національний медичний університет ім. О.О. Богомольця, м. Київ, Україна
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
Актуальність. Сепсис відноситься до найчастіших причин смерті дітей в світі. Тяжкий перебіг сепсису звичайно асоціюється з розвитком септичного шоку та розвитком поліорганної недостатності. Важливе місце в комплексному обстеженні та контролі ефективності лікування належить моніторингу показників гемодинаміки. Мета дослідження: вивчення змін центральної та периферичної гемодинаміки за допомогою ехокардіографії та ультразвукової допплерографії у дітей із сепсисом. Матеріали та методи. Проведено ретроспективне дослідження випадків сепсису у дітей віком від 0 до 18 років, які проходили лікування у відділенні інтенсивної терапії. Хворим проводився моніторинг центральної та периферичної гемодинаміки за допомогою ехокардіографії та ультразвукової допплерографії. Результати. Було досліджено 108 випадків, що відповідали критеріям сепсису. У 53,7 % хворих етіологічним фактором був менінгокок, у 0,9 % — стафілокок, у 0,9 % — пневмокок, у 0,9 % — єрсинія, у 41,7 % етіологію не було встановлено. У 81 дитини перебіг сепсису був без проявів шоку, у 28 пацієнтів захворювання ускладнилось септичним шоком. У 12 дітей захворювання закінчилось летально. Розвиток септичного шоку асоціювався з суттєво вищими показниками частоти серцевих скорочень (ЧСС) та підвищенням індексів периферичного опору в черевному стовбурі та ниркових артеріях. Несприятливими щодо фатального перебігу захворювання були високий показник ЧСС, зниження діастолічної швидкості у черевному стовбурі та ниркових артеріях. Висновки. Ехокардіографія та ультразвукова допплерографія у дітей із сепсисом дозволяють оцінювати характер і ступінь кардіоваскулярної дисфункції. Дослідження регіонарного кровотоку може бути діагностичним критерієм розвитку септичного шоку та має прогностичне значення у дітей з сепсисом.
Актуальность. Сепсис относится к наиболее частым причинам смерти у детей. Тяжелое течение сепсиса обычно ассоциируется с развитием септического шока и развитием полиорганной недостаточности. Важной составляющей в комплексном обследовании и контроле эффективности лечения является мониторинг показателей гемодинамики. Цель исследования: изучение изменений центральной и периферической гемодинамики с помощью эхокардиографии и ультразвуковой допплерографии у детей с сепсисом. Материалы и методы. Проведено ретроспективное исследование случаев сепсиса у детей в возрасте от 0 до 18 лет, которые проходили лечение в отделении интенсивной терапии. Больным проводился мониторинг центральной и периферической гемодинамики с помощью эхокардиографии и ультразвуковой допплерографии. Результаты. Было исследовано 108 случаев, которые отвечали критериям сепсиса. У 53,7 % больных этиологическим фактором был менингококк, у 0,9 % — стафилококк, у 0,9 % — пневмококк, у 0,9 % — иерсиния, у 41,7 % этиология не была установлена. У 12 детей из исследуемой группы заболевание закончилось летально. Развитие септического шока ассоциировалось с существенно более высокими показателями частоты сердечных сокращений (ЧСС) и повышением индексов периферического сопротивления в брюшном стволе и почечных артериях. Неблагоприятными в отношении фатального течения заболевания были высокий показатель ЧСС, снижение диастолической скорости в брюшном стволе и почечных артериях. Выводы. Эхокардиография и ультразвуковая допплерография у детей с сепсисом позволяют оценивать характер и степень кардиоваскулярной дисфункции. Исследование регионарного кровотока может быть диагностическим критерием развития септического шока и имеет прогностическое значение у детей с сепсисом.
Background. Sepsis is one of the most common causes of mortality in children. The severe course of sepsis is usually associated with the development of septic shock and multiple organ failure. An important component in the comprehensive examination and control of treatment effectiveness is the monitoring of hemodynamic parameters. Purpose: to evaluate changes in central and peripheral hemodynamics by echocardiography and Doppler ultrasound in children with sepsis. Materials and methods. A retrospective study of cases of septic shock in children aged 0 to 18 years who underwent treatment in the intensive care unit was conducted. Patients were monitored for central and peripheral hemodynamics by echocardiography and Doppler ultrasound. Results. One hundred eight cases of sepsis were investigated. Meningococcus was a causative agent in 53.7 % patients, in 0.9 % — Staphylococcus, in 0.9 % — Pneumococcus, in 0.9 % — Yersinia, and in 41.7 %, aetiology was not been established. In 12 children from the study group, fatal outcome occurred. Septic shock was associated with significantly higher heart rate and an increase in peripheral resistance indices in the abdominal trunk and renal arteries. Fatal course of the disease was associated with a high heart rate and a decrease in diastolic velocity (Vmin) in the abdominal trunk and renal arteries. Conclusions. Echocardiography and ultrasound dopplerography in children with sepsis make it possible to evaluate the pattern and extent of cardiovascular dysfunction. Results of regional blood flow assessment can be a diagnostic criterion for the septic shock and has prognostic value in children with sepsis.
сепсис; шок; гемодинаміка; діти
сепсис; шок; гемодинамика; дети
sepsis; shock; hemodynamics; children
Вступ
Матеріали та методи
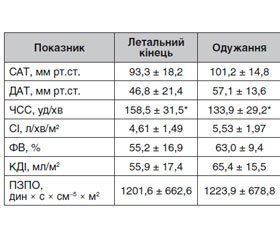
Результати
/203-1.jpg)
Обговорення
Висновки
- Randolph AG, McCulloh RJ. Pediatric sepsis: important considerations for diagnosing and managing severe infections in infants, children, and adolescents. Virulence. 2014;5(1):179-89. doi:10.4161/viru.27045.
- Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41(2):580-637. doi:10.1097/CCM.0b013e31827e83af.
- Shneider AG, Goodwin MD, Bellomo R. Measurement of kidney perfusion in critically ill patients. Crit Care. 2013;17(2):220. doi:10.1038/ajh.2010.174.
- Mccanny P, Colreavy F, Bakker J, authors; Poelaert J, editor. Haemodynamic monitoring and management. Skills and techniques. European Society of Intensive Care Medicine; 2013. 95 p.
- Goldstein B, Giroir B, Randolph A; International Consensus Conference on Pediatric Sepsis. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med. 2005;6(1):2-8. doi:10.1097/01.PCC.0000149131.72248.E6.
- Lopez L, Colan SD, Frommelt PC, et al. Recommendations for Quantification Methods During the Performance of a Pediatric Echocardiogram: A Report From the Pediatric Measurements Writing Group of the American Society of Echocardiography Pediatric and Congenital Heart Disease Council J Am Soc Echocardiogr. 2010 May;23(5):465-95; quiz 576-7. doi: 10.1016/j.echo.2010.03.019.
- Slonim AD, Pollack MM. Pediatric Critical Care Medicine. Lippincott Williams & Wilkins; 2006. 921 p.
- Coté CJ, Lerman J, Anderson BJ. A Practice of Anesthesia for Infants and Children: Expert Consult - Online and Print. Elsevier Health Sciences; 2013. 1142 p.
- Blanco P, Sasai T. Assessment of left ventricle preload by transthoracic echocardiography: an easy task? J intensive care. 2015;3(1):23. doi:10.1186/s40560-015-0090-7.
- Lai WW, Mertens LL, Cohen MS, Geva T, eds. Echocardiography in Pediatric and Congenital Heart Disease. Oxford, UK: Blackwell Publishing Ltd; 2009. 796 p. doi:10.1002/9781444306309.
- Richardson RR. Atlas of Acquired Cardiovascular Disease Imaging in Children. Springer International Publishing; 2016. 160 p.
- Klabunde RE. Cardiovascular physiology concepts. 2th ed. Lippincott Williams & Wilkins; 2012.
- Davis PJ, Cladis FP. Smith’s Anesthesia for Infants and Children E-Book. Elsevier Health Sciences; 2016. 1408 p.
- Chavhan GB, Parra DA, Mann A, Navarro OM. Normal Doppler spectral waveforms of major pediatric vessels: specific patterns. Radiographics. 2008;28(3):691-706. doi:10.1148/rg.283075095.
- Hamborsky J, Kroger A, Wolfe S, eds. Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccine-Preventable Diseases. 13th ed. Washington D.C. Public Health Foundation; 2015.
- Huang M-Y, Chen C-Y, Chien J-H, et al. Serum Procalcitonin and Procalcitonin Clearance as a Prognostic Biomarker in Patients with Severe Sepsis and Septic Shock. Biomed Res Int. 2016;2016:1758501. doi:10.1155/2016/1758501.
- Cecconi M, De Backer D, Antonelli M, et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med. 2014;40(12):1795-815. doi:10.1007/s00134-014-3525-z.
- Aneja RK, Carcillo JA. Differences between adult and pediatric septic shock. Minerva Anestesiol. 2011;77(10):986-92.
- Brierley J, Carcillo JA, Choong K, et al. Clinical practice parameters for hemodynamic support of pediatric and neonatal septic shock: 2007 update from the American College of Critical Care Medicine. Crit Care Med. 2009 Feb;37(2):666-88. doi: 10.1097/CCM.0b013e31819323c6.
- Bonanno FG. Clinical pathology of the shock syndromes. J Emerg Trauma Shock. 2011;4(2):233-43. doi:10.4103/0974-2700.82211.
- Hiltebrand LB, Krejci V, Banic A, Erni D, Wheatley AM, Sigurdsson GH. Dynamic study of the distribution of microcirculatory blood flow in multiple splanchnic organs in septic shock. Crit Care Med. 2000;28(9):3233-41.
- Krejci V, Hiltebrand L, Banic A, Erni D, Wheatley AM, Sigurdsson GH. Continuous measurements of microcirculatory blood flow in gastrointestinal organs during acute haemorrhage. Br J Anaesth. 2000;84(4):468-75.

/202-1.jpg)