Журнал «Актуальная инфектология» Том 8, №1, 2020
Вернуться к номеру
Парвовирусная инфекция В19V у беременных (обзор литературы) Часть 2
Авторы: Кириенко В.Т.(1), Зайцев И.А.(1), Потий В.В.(2), Нестерук Е.С.(1)
(1) — Национальный медицинский университет им. А.А. Богомольца, г. Киев, Украина
(2) — Донецкий национальный медицинский университет, г. Лиман, Украина
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
У статті наведені особливості перебігу парвовірусної інфекції у вагітних. Описано наслідки ураження плода збудником хвороби. Висвітлено можливості оцінки ризику вродженої парвовірусної інфекції, антенатальної діагностики, інтерпретації результатів лабораторних та інструментальних методів дослідження. Наведені підходи до лікування, обговорюються можливості профілактики захворювання.
В статье представлены особенности течения парвовирусной инфекции у беременных. Описаны последствия поражения плода патогеном. Освещены возможности оценки риска врожденной парвовирусной инфекции, антенатальной диагностики, интерпретации результатов лабораторных и инструментальных методов исследования. Представлены подходы к лечению, обсуждены возможности профилактики заболевания.
The article presents the features of the course of parvovirus infection in pregnant women. The consequences of the fetal damage by the pathogen are described. The possibilities of assessing the risk of congenital parvovirus infection, antenatal diagnosis, interpretation of the results of laboratory and instrumental stusies are highlighted. Approaches to treatment are presented, the possibilities of disease prevention are discussed.
парвовірусна інфекція; вагітність; неімунна внутрішньоутробна водянка
парвовирусная инфекция; беременность; неиммунная водянка плода
parvovirus infection; pregnancy; nonimmune hydrops fetalis
(Продолжение. Начало в журнале «Актуальная инфектология». Т. 7, № 5. 2019)
Парвовирус В19 широко распространен в популяции. Среди женщин репродуктивного возраста частота выявления серологических маркеров к парвовирусу составляет 45–65 %, остальные серонегативны и во время беременности от 1 до 5 % могут инфицироваться патогеном [1, 2, 16, 40]. Во время эпидемических вспышек, которые повторяются каждые 3–6 лет, риск заражения в случае контакта с маленькими детьми увеличивается от 30 до 50 %. Наиболее частому инфицированию подвергаются многодетные матери, а также работники детских садов и школ. Учителя детских садов имеют риск развития острой парвовирусной инфекции (ПВИ) в 3 раза выше по сравнению с другими беременными женщинами, а школьные учителя — в 1,6 раза [3, 13].
По современным представлениям клинические проявления ПВИ варьируют от бессимптомных форм до угрожающих жизни состояний [4–6]. У беременных данный патоген ассоциируется с развитием спонтанных абортов, неиммунной водянки плода, внутриутробной гибелью плода. Особую опасность представляет первичное инфицирование беременной женщины. При этом риск трансплацентарного заражения плода составляет 35–51 % [7, 8], частота неблагоприятных исходов беременности составляет 20–30 % и гибель плода — 10–15 % случаев [9, 73], в связи с чем ПВИ рассматривается как составная часть TORCH-комплекса [10].
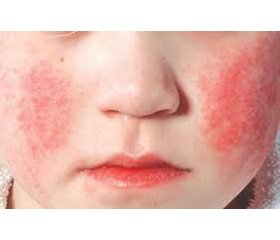
У большей части инфицированных беременных (50–70 %) заболевание протекает атипично или бессимптомно (рис. 1). Сравнительно редко можно наблюдать сыпь, характерную для ПВИ, в то же время артропатия встречается приблизительно в 50 % случаев и чаще всего является единственным проявлением заболевания. В связи с этим точный диагноз можно установить только с помощью серологического тестирования.
Особенности иммунного ответа на парвовирус В19 у беременных [11, 12, 39, 40, 101, 102]
У крови беременной титр специфических АТIgM может опускаться до недектируемых значений к моменту появления симптомов у плода, а образование АТIgG может при этом запаздывать. Быстрый клиренс материнских IgM может привести к ложноотрицательным результатам, поскольку существует вероятность снижения АТIgM приблизительно к 28-му дню после инфицирования, соответственно отсутствие АТIgM в период 8–12 недель от начала острой инфекции у беременной следует интерпретировать с осторожностью [13].
У беременной при первичном инфицировании вирусная ДНК может определяться от нескольких недель до 4 месяцев, иногда на низком уровне вплоть до родоразрешения. При наличии иммунодефицита АТIgM и вирусная ДНК могут быть ниже порога обнаружения [14, 39]. Выявленные в иммуноблоте АТIgG к белку NS-1 парвовируса В19 указывают на репликацию патогена.
При развитии парвовирусной инфекции у плода отмечается чрезвычайно активная вирусемия, определяющая высокую концентрацию ДНК вируса в пуповинной крови и окружающей амниотической жидкости. Обнаружение ДНК в биологическом материале (в крови и тканях плода, амниотической жидкости и тканях плаценты) указывает на инфицирование плода PVB19.
По мнению большинства исследователей, данные серологической диагностики крови плода считаются малоинформативными [15]. Обусловлено это тем, что у плода, зараженного в 1-й и 2-й триместр гестации, АТIgM в пуповинной крови обнаруживаются редко (в первые 14 недель ~ 22 % случаев). Минимальная выработка АТIgM у плода в этот период объясняется несостоятельностью иммунной системы плода, а также подавлением выработки вирусспецифических IgM-антител в связи с циркуляцией пассивно полученных материнских антител. В основном специфические АТIgM у плода появляются после 22-й недели гестации, соответственно, вероятность их выявления становится большей. При инфицировании плода в 3-м триместре АТIgM детектируются в 100 % случаев. Одним из признаков внутриутробной инфекции считается циркуляция IgG у младенца дольше года [84].
Исходы заражения плода парвовирусом В19
Доказанными клиническими проявлениями врожденной ПВИ являются: самопроизвольный аборт, внутриутробная гибель плода, анемия, неиммунная водянка плода, миокардит, застойная сердечная недостаточность, гепатит, печеночная недостаточность, сопровождающиеся нейтропенией, тромбоцитопенией или панцитопенией [16, 17]. Исходы заражения плода ПВ зависят от срока гестации, на котором произошло его инфицирование. Большинство плодов имеют спонтанное разрешение без каких-либо последствий.
В среднем риск внутриутробной гибели плода в случае развития острой ПВИ у беременной оценивается в 10–15 %. При выявлении материнских антител, подтверждающих первичное заражение в первые 20 недель гестации, риск развития врожденной ПВИ составляет 12,4–25 % [18, 59, 70]. Непосредственно частота внутриутробной гибели плода, пораженного парвовирусом B19, в период до 20 недель беременности составляет 14,8 %, а после 20 недель — 2,3 % [19, 20]. Другими авторами установлено, что риск самопроизвольной гибели плодов, пораженных данным патогеном, в период до 20 недель составляет 13 %, а после 20 недель гестации — 0,5 % [21, 22]. Также есть сообщения, что около 3 % спонтанных абортов в 1-й триместр обусловлены ПВИ. Данные литературы могут несколько разниться, однако большинством экспертов установлено, что наиболее тяжелые последствия внутриутробного заражения наблюдаются при инфицировании между 17-й и 24-й неделями гестации [23, 24, 72]. Поражение плода в этот период часто завершается развитием тяжелой анемии и неиммунной водянки плода, развитием миокардита и застойной сердечной недостаточности, в результате чего гибель плода может достигать 50 %. Есть работы, в которых показано, что при наличии клинических симптомов парвовирусной инфекции у беременной в I и II триместрах гестации возбудитель вызывает негативные последствия у плода в 100 % случаев [54]. Заражение с развитием внутриутробной инфекции в третьем триместре заканчивается гибелью плода в 6 % случаев, чаще наблюдаются преждевременные роды клинически здорового ребенка с серологическими маркерами, подтверждающими инфицирование [70].
Неиммунная водянка плода является основным клиническим проявлением врожденной ПВИ, в 80 % случаев развивается во втором триместре беременности [25, 41, 85]. По данным Эндерс и соавт., частота неиммунной водянки плода составляла 4,7 % при развитии ПВИ у матери до 25 недель гестации по сравнению с 2,3 % в более поздние сроки [88]. Авторами других исследований отмечено, что на ПВИ В19 приходится от 8 до 10 % неиммунной водянки плода [26, 41], а по данным последних наблюдений было установлено молекулярное доказательство наличия парвовируса В19 в 18–27 % случаев среди неиммунной водянки плода [72, 81]. В случае развития неиммунной водянки выявляются следующие УЗИ-признаки у плода: асцит, отек подкожной клетчатки, плевральный и перикардиальный выпот, отек плаценты, многоводие и кардиомегалия как результат развившейся сердечной недостаточности [27, 28]. При своевременной диагностике и проведении гемотрансфузии плоду внутриутробно благоприятный исход возможен в 83 % случаев [32].
В результате внутриматочной гемотрансфузии в 97 % случаев развивается посттрансфузионная тромбоцитопения, причем до 46 % — тяжелая тромбоцитопения (< 50 • 109 тромбоцитов/л) [29, 39, 84].Это необходимо учитывать при принятии решения о проведении кордоцентеза или необходимости внутриутробного внутрисосудистого переливания крови плоду.
Неонатальные последствия внутриутробного инфицирования В19V
К доказанным неонатальным последствиям внутриутробного инфицирования В19V относят: печеночную недостаточность, миокардит, посттрансфузионную анемию (если применялась внутриутробная гемотрансфузия), отставание в психомоторном развитии и патологию ЦНС среди новорожденных [30–32]. Предполагают, что сам парвовирус в отсутствие водянки плода или тяжелой анемии плода, по-видимому, не вызывает длительных неврологических нарушений, однако тяжелая В19V-ассоциированная анемия и неиммунная водянка плода могут быть независимыми факторами риска долгосрочных неврологических осложнений. Миокардит парвовирусной этиологии может привести к тяжелой дилатационной кардиомиопатии и даже потребовать пересадки сердца. Субклиническая форма врожденной ПВИ характеризуется отсутствием значимых клинико-лабораторных проявлений и диагностируется по результатам лабораторных исследований. У большинства младенцев нет долгосрочных осложнений, однако необходимы дальнейшие исследования [39, 40, 93].
Данные о повышении риска развития врожденных аномалий у плода на фоне внутриутробного инфицирования PVB19 противоречивы. Отдельные исследователи сообщают о врожденных черепно-лицевых, скелетно-мышечных, глазных аномалиях, о врожденной патологии центральной нервной системы у детей, рожденных от матерей с острой ПВИ [33–36]. Тем не менее большинство зарубежных источников отрицают связь между инфицированием В19 и развитием «истинных», связанных с повреждением генома врожденных фетопатий [37].
Диагностика парвовирусной инфекции В19
Современная диагностика ПВИ включает определение специфических IgM, IgG в сыворотке крови методом (ИФА), определение ДНК вируса в крови/костном мозге методом полимеразной цепной реакции (ПЦР) и морфологическое исследование аспирата костного мозга.
Дополнительным методом лабораторной диагностики является иммуноблот, позволяющий определять АТ к отдельным белкам-антигенам PVB19. Результаты применения иммуноблота дают возможность уточнить стадию заболевания, выявить персистирующую форму инфекции.
Гистологические и иммуногистохимические методы исследований чаще применяются в диагностике ПВИ у плода и ребенка первого года жизни.
Достаточно информативен клинический анализ крови с определением ретикулоцитов, тромбоцитов, эритроцитарного индекса. По показаниям необходимо определение печеночных ферментов, ЭКГ, ЭхоКГ.
Гематологические изменения чаще носят преходящий характер в виде анемии, ретикулоцитопении или полного отсутствия ретикулоцитов, нейтропении, эозинофилии, моноцитоза, тромбоцитопении. Возможно повышение печеночных трансаминаз (аланинаминотрансферазы и аспартатаминотрансферазы), С-реактивного белка, скорости оседания эритроцитов.
Лабораторный скрининг беременных или планирующих беременность женщин на наличие или отсутствие антител к парвовирусу не предусмотрен!
Согласно зарубежным стандартам диагностики, серологическому тестированию на ПВИ подлежат беременные с симптомами заболевания или из группы риска с вероятной возможностью инфицирования [1, 38, 87].
Диагностика врожденной ПВИ в антенатальном периоде [87]
Необходимо определять специфические иммуноглобулины в сыворотке крови (IgM и IgG одновременно!) и количественную ПЦР для определения уровня вирусемии.
Для доказательства поражения плода необходимо исследовать амниотическую жидкость, образцы тканей плаценты и умерших плодов методом ПЦР для обнаружения вирусного материала.
Основная группа риска развития врожденной ПВИ — серонегативные беременные
Задача врача — определить серологический статус: беременная неиммунная, первичная инфекция/перенесенная ранее — и определить тактику ведения пациентки (рис. 3).
Рекомендуемая интерпретация результатов серологического обследования [1, 39, 40, 87, 101]
1. (IgM–, IgG+). Выявление специфических IgG при отсутствии IgM может свидетельствовать о наличии иммунитета у женщины и отсутствии риска врожденной инфекции. Однако у беременных может быть быстрый клиренс IgM, также IgM могут быть ниже порога определения до появления симптомов у плода. Рекомендуется исследование плазмы крови на ДНК B19V. Вирусная ДНК в крови беременной может определяться от нескольких недель до 4 месяцев, иногда на низком уровне до родоразрешения. Однократно отрицательная ДНК PVB19 не исключает диагноз, так как может быть ниже порога определения. Нарастание количества АТIgG в 2–4 раза в парных сыворотках (через 2 недели) расценивается как острая ПВИ. При ДНК B19V–, IgM–, IgG+ уровень IgG в динамике без изменений, женщина иммунная и риска для плода нет.
2. (IgM+, IgG+). Одновременное присутствие IgM и IgG подтверждает острую инфекцию парвовирусом В19 или недавнее инфицирование (до 6 месяцев). Рекомендуется исследование плазмы крови на ДНК B19V. Нарастание количества IgG в динамике расценивается как сравнительно недавнее инфицирование, а снижение титра считается признаком заражения до 6 месяцев тому назад.
3. (IgM+, IgG–). В случае обнаружения IgM, при отсутствии IgG речь идет о совсем недавнем инфицировании или возможен ложноположительный результат. Рекомендуется исследование плазмы крови на ДНК B19V, через 2 недели повторить серологическое исследование на IgM и IgG. При острой ПВИ должна произойти сероконверсия IgG. При отсутствии IgG и повторном выявлении IgM — ложноположительный результат. Необходимо рекомендовать иммуноблот на IgM.
4. (IgM–, IgG–). При отсутствии иммуноглобулинов IgM и IgG беременная считается неиммунной и относится к группе риска возможного заражения парвовирусом. Может быть в инкубационном периоде, не исключается наличие серологического окна или у беременной IgM могут быть ниже порога обнаружения. Рекомендуется исследование плазмы крови на ДНК B19V, повторить исследование на IgM и IgG через 2–4 недели, при необходимости иммуноблот IgM и IgG. Если повторные серологические тесты отрицательные, ПЦР–, то беременную следует проинформировать о профилактических мерах, чтобы избежать инфекции.
5. Иммунодефицит (IgM–, IgG–/+, ДНК PVB19–/+). При отсутствии иммуноглобулинов IgM, IgG и ДНК PVB19 беременная считается неиммунной и относится к группе риска возможного заражения парвовирусом. При отсутствии иммуноглобулинов IgM, IgG и наличии ДНК PVB19 — у беременной острая ПВИ. Рекомендуется повторить исследование на IgM и IgG через 2–4 недели, при необходимости иммуноблот IgM и IgG. При острой ПВИ должна произойти сероконверсия IgM и IgG, через 2 недели титр АТIgG нарастет в 2–4 раза. Если ДНК PVB19+, IgM–, IgG +, при этом титр АТIgG в динамике не нарастает или незначительно повышается, необходимо рассмотреть хроническое течение ПВИ у лиц с иммунодефицитом.
Инструментальная диагностика врожденной ПВИ в антенатальный период
Согласно зарубежным стандартам, после подтверждения острой ПВИ у беременной рекомендуется УЗИ-мониторинг состояния плода с целью своевременной диагностики развития неиммунной водянки плода. Рандомизированных исследований для определения необходимой частоты УЗИ плода не проводилось, большинство экспертов рекомендуют выполнять УЗИ плода каждые 1–2 недели, при необходимости каждую неделю в течение 12 недель после диагностирования острой ПВИ у матери, поскольку развитие неиммунной водянки плода может быть отсроченным [101, 102]. Некоторые авторы рекомендуют продолжить серийные УЗИ плода каждые 1–2 недели, при необходимости каждую неделю до 32 недель гестации [40]. Развитие неиммунной водянки плода является подтверждением диагноза врожденной ПВИ. Среди других УЗИ-признаков, указывающих на ПВИ у плода, можно выявить: увеличенную толщину плаценты, ультразвуковые признаки мекониевого перитонита, нарушения объема околоплодных вод [39, 41]. Последующие УЗИ ограничиваются оценкой объема околоплодных вод и выявлением неиммунной водянки плода. Плоды с водянкой, как правило, двигаются меньше, поэтому беременной следует предложить ежедневно фиксировать частоту движений плода [42]. Если нет информации об иммунном статусе беременной к PVB19 и нет возможности ее обследовать с помощью серологических методов, при этом нельзя исключить ПВИ, рекомендовано выполнять серийные УЗИ для выявления неиммунной водянки плода [43].
Для оценки анемии у плода необходимо проводить допплерометрию с измерением пиковой систолической скорости кровотока в СМА [39, 40, 44]. Чувствительность указаного метода — 83–100 %, а специфичность — 93–100 % [45, 46]. Уровень гемоглобина плода определяют при проведении кордоцентеза [47]. Следует учитывать, что амниоцентез/кордоцентез выполняют только при наличии показаний, а подозрение на врожденную ПВИ не является основанием для их проведения.
Для доказательства внутриутробного инфицирования В19V наиболее информативным считается обнаружение вирусного материала методами ПЦР и лигазной цепной реакции (ЛЦР) в амниотической жидкости, крови плода (при кордоцентезе), крови, моче и слюне новорожденного, в образцах тканей плаценты и умерших плодов. Гистологическое выявление специфических ядерных включений в клетках эритроидного ростка на фиксированных препаратах плаценты или тканей плода также подтверждает инфицирование [48].
Терапевтические подходы к лечению парвовирусной инфекции В19
Этиотропная терапия не разработана.
Не рекомендуется введение высокотитражных IgG (иммуноглобулины показали ограниченную эффективность).
Патогенетическая терапия. При апластических кризах необходимо переливать эритроцитную массу. Введение эритроцитной массы в начале криза обычно позволяет добиться полного купирования анемии у большинства больных. При тяжелом и затяжном артрите используют нестероидные противовоспалительные препараты.
Лечение врожденной ПВИ. Антенатальная терапия
Основой терапии врожденной ПВИ является заместительная патогенетическая терапия путем внутривенных трансфузий компонентов крови. Состав вводимых компонентов крови, объем, кратность введения определяются динамикой клинико-лабораторных показателей.
Рекомендуется внутриутробная гемотрансфузия (эритромасса) при тяжелой анемии плода — гемоглобин ниже 80 г/л. При необходимости — трансфузии тромбоцитарной массы, лейкоконцентрата.
Неиммунная водянка плода может разрешиться самопроизвольно после внутриутробного переливания компонентов крови, до 80 % плодов с водянкой выживают после внутриутробного переливания [84].
При подтверждении врожденной ПВИ после 32-й недели гестации рекомендуются досрочные роды (цель — ускорить созревание легочной ткани и увеличить насыщаемость гемоглобина кислородом).
Профилактика парвовирусной инфекции В19 [49, 50]
Эффективной профилактики парвовирусной инфекции в настоящее время не существует. Ведется разработка безопасной и иммуногенной вакцины против ПВИ.
Согласно зарубежным рекомендациям, обследованию на ПВИ подлежат беременные с клиническими симптомами заболевания, из групп риска с вероятностью инфицирования.
Каждую женщину из группы риска следует проконсультировать о ее индивидуальном риске, исходя из ее риска инфицирования, гестационного возраста и других акушерских соображений.
Серонегативным беременным, которые имеют профессиональный контакт с детьми, можно рекомендовать повторять серологические тесты на специфические АТ каждые 4 недели.
Частое мытье рук может быть рекомендовано в качестве меры профилактики для уменьшения риска заражения парвовирусом.
Количественное тестирование на PV В19 донорской крови, переливаемой больным, находящимся в состоянии иммуносупрессии.
Заключение
Парвовирус представляет потенциальную опасность для беременных. Риск инфицирования данным патогеном во время гестации составляет от 1 до 5 %, а в период эпидемических вспышек беременные из группы риска могут заразиться в 30–50 % случаев, при этом риск трансплацентарной передачи составляет 33–51 % случаев, с возможностью развития тяжелого врожденного заболевания. В Украине нет точных данных о частоте ПВИ среди женщин детородного возраста, частоте врожденной инфекции. Крайне редкое обследование беременных на ПВИ позволяет предполагать, что часть случаев врожденных инфекций неустановленной этиологии связана именно с трансплацентарной передачей парвовируса. Иммунологическое обследование беременных из группы риска позволит не только своевременно выявить парвовирусную инфекцию, но и будет способствовать снижению развития патологии беременности и гибели плода.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
1. Neu N. et al. TORCH Infections. Clin. Perinatol. 2015. 42. 77. Available from: [http://pngpaediatricsociety.org/wp-content/uploads/2016/03/Neu-N-TORCHinfections-Clinics-in-Perinatology-2015.pdf], last accessed Sept 13, 2018.
2. Cossart Y.E., Field A.M., Cаnt B., Widdows D. Parvovius-like particles in human sera. Lancet. 1975. 1 (7898). 72-73.
3. Zadori Z., Szelei J., Lacoste M.C. et al. A viral phospholipase A2 is required for parvovirus infectivity. Dev. Cell. 2001. 1. 291-302.
4. Kaufmann B., Chipman P.R., Kostyuchenko V.A. et al. Visualization of the externalized VP2 N termini of infectious human parvovirus B19. J. Virol. 2008. 82. 7306-7312.
5. Wan Z., Zhi N., Wong S. et al. Human parvovirus B19 causes cell cycle arrest of human erythroid progenitors via deregulation of the E2 F family of transcription factors. J. Clin. Invest. 2010. 120. 3530-3544.
6. Servant-Delmas A., Lefrère J.J., Morinet F., Pillet S. Advances in human B19 erythrovirus biology. J. Virol. 2010. 84 (19). 9658-65.
7. Chen A.Y. et al. The small 11 kDa non-structural protein of human parvovirus B19 plays a key role in inducing apoptosis during B19 virus infection of primary erythroid progenitor cells. Blood. 2010. 115. 1070-1080.
8. Brown K.E., Hibbs J.R., Gallinella G. et al. Resistance to parvovirus B19 infection due to lack of virus receptor (erythrocyte P antigen). NEJM. 1994. 330. 1192-1196.
9. Kaufmann B. et al. The structure of human parvovirus B19. Proc. Natl. Acad. Sci. USA. 2004. 101. 11628-11633.
10. Schneider B., Höne A., Tolba R.H., Fischer Y.-P., Blümel J., Eis-Hübinger A.M. Simultaneous persistence of multiple genome variants of human parvovirus B19. J. Gen. Virol. 2008. 89. 164-176.
11. Servant A., Laperche S., Lallemand F. et al. Genetic diversity within human erythroviruses: identification of three genotypes. J. Virol. 2002. 76. 9124.
12. Parsyan A., Szmaragd C., Allain J.P., Candotti D. Identification and genetic diversity of two human parvovirus B19 genotype 3 subtypes. J. Gen. Virol. 2007. 88. 428.
13. Stelma F.F. et al. Occupational risk of human cytomegalovirus and parvovirus B19 infection in female day care personnel in the Netherlands; a study based on seroprevalence. Eur. J. Clin. Microbiol. Infect. Dis. 2009. 28. 393-397.
14. Anderson L.J. et al. Risk of infection following exposures to human parvovirus B19. Behring Inst. Mitt. 1990. 85. 60-63.
15. Jordan J., Tiangco B., Kiss J., Koch W. Human parvovirus B19: prevalence of viral DNA in volunteer blood donors and clinical outcomes of transfusion recipients. Vox Sang. 1998. 75. 97-102.
16. Lamont R.F., Sobel J., Vaisbuch E. et al. Parvovirus B19 infection in human pregnancy. BJOG. 2011. 118 (2). 175-186.
17. Климович Н.В., Матвеев В.Л., Романов О.М., Черновецкий М.А. Эпидемиологическая характеристика парвовирусной инфекции у детей с гематологическими заболеваниями. Охрана материнства и детства. 2011. 1. 42-46.
18. Kleinman S.H., Glynn S.A., Lee T.H., Tobler L., Montalvo L., Todd D., Kiss J.E., Shyamala V., Busch M.P. Prevalence and quantitation of parvovirus B19 DNA levels in blood donors with a sensitive polymerase chain reaction screening assay. Transfusion. 2007. 47 (10). 1756.
19. Kleinman S.H., Glynn S.A., Lee T.H., Tobler L.H., Schlumpf K.S., Todd D.S., Qiao H., Yu M.Y., Busch M.P. A linked donor-recipient study to evaluate parvovirus B19 transmission by blood component transfusion. Blood. 2009. 114 (17). 3677.
20. FDA Biologics Guidances. www. fda. Gov/Biologics Blood Vaccines/Guidance Compliance Regulatory information/Guidances/default.htm (Accessed on March 20, 2017).
21. Mossong J. et al. Parvovirus B19 infection in five European countries: seroepidemiology, force of infection and maternal risk of infection. Epidemiol. Infect. 2008. 136. 1059-1068.
22. Mortimer P.P., Humphries R.K., Moore J.G., Purcell R.H., Young N.S. A human parvovirus-like virus inhibits haematopoietic colony formation in vitro. Nature. 1983. 302. 426.
23. Brown K.E., Anderson S.M., Young N.S. Erythrocyte P antigen: cellular receptor for B19 parvovirus. Science. 1993. 262. 114.
24. Lunardi C., Tinazzi E., Bason C., Dolcino M., Corrocher R., Puccetti A. Human parvovirus B19 infection and autoimmunity. Autoimmun. Rev. 2008. 8 (2). 116-20.
25. Weigel-Kelley K.A., Yoder M.C., Srivastava A. Alpha5beta1 integrin as a cellular coreceptor for human parvovirus B19: requirementof functional activation of beta1 integrin for viral entry. Blood. 2003. 102. 3927.
26. Munakata Y., Saito-Ito T., Kumura-Ishii K., Huang J., Kodera T., Ishii T., Hirabayashi Y., Koyanagi Y., Sasaki T. Ku80 autoantigen as a cellular coreceptor for human parvovirus B19 infection. Blood. 2005. 106. 3449.
27. Weigel-Van Aken K.A. Pharmacological activation of guanine nucleotide exchange factors for the small GTPase Rap1 recruits high-affinity beta1 integrins as coreceptors for parvovirus B19: improved ex vivo gene transfer to human erythroid progenitor cells. Hum. Gene Ther. 2009. 20 (12). 1665-78.
28. Seve P. et al. Systemic manifestations of Parvovirus B19 infections. Rev. Med. Interne. 2004 Oct. 25 (10). 740-51.
29. Heegaard E.D., Brown K.E. Human parvovirus B19. Clin. Microbiol. Rev. 2002. 15 (3). 485-505.
30. Abe K., Kiuchi T., Tanaca K., Edamoto Y., Ajba N., Sala T. Characterization of erythrovirus B19 genomes isolated in Iiver tissues from patients with fulminant hepatitis and biliary atresia who underwent liver transpanlatation. Int. J. Med. Sei. 2007. 4 (2). 105-109.
31. Левада А.И. Парвовирусная инфекция В19. Педиатр онлайн. 2012.
32. Ergaz Z., Ornoy A. Parvovirus B19 in pregnancy. Reproductive Toxicology. 2006. 21. 421-435.
33. Chiasaka H. et al. Parvovirus B19 and the pathogenesis of anaemia. Rev. Med. Virol. 2003 Nov-Dec. 13 (6). 347-59.
34. Harger J.H., Adler S.P., Koch W.C., Harger G.F. Prospective evaluation of 618 pregnant women exposed to parvovirus B19: risks and symptoms. Obstet. Gynecol. 1998. 91. 413-420.
35. Caforio A.L.P., Bottaro S., Iliceto S. Dilated cardiomyopathy (DCM) and myocarditis: classification, clinical and autoimmune features. Applied Cardiopulmonary Pathophysiology. 2012. 16. 82-95.
36. Norja P. et al. Bioportfolio lifelong persistence of variant and prototypic erythrovirus DNA genomes in human tissue. Proc. Natl. Acad. Sci. USA. 2006. 103. 7450-7453.
37. Parvovirus B19 Infection in Pregnancy (2014). Available from: [https://sogc.org/wp-content/uploads/2014/12/gui 3161012E.pdf], last accessed Sept 13, 2018.
38. Neal S. Young, Kevin E. Brown. Parvovirus B19. The New England Journal of Medicine. 2004. 350. 586-97.
39. de Jong E.P., Walther F.J., Kroes A.C., Oepkes D. Parvovirus B19 infection in pregnancy: new insights and management. Prenat. Diagn. 2011. 31. 419-425.
40. Dijkmans A.C., de Jong E.P., Dijkmans B.A., Lopriore E., Vossen A., Walther F.J. et al. Parvovirus B19 in pregnancy: prenatal diagnosis and management of fetal complications. Curr. Opin Obstet. Gynecol. 2012. 24. 95-101.
41. O’Malley A. et al. Parvovirus infects cardiac myocytes in hydrops fetalis. Pediatr. Dev. Pathol. 2003. 6 (5). 414-420.
42. Lefrère J.J., Servant-Delmas A., Candotti D. et al. Persistent B19 infection in immunocompetent individuals: implications for transfusion safety. Blood. 2005. 106. 2890-2895.
43. Broliden K., Tolfvenstam T., Norbeck O. Clinical aspects of parvovirus B19 infection. J. Intern. Med. 2006. 260. 285-304.
44. Heegaard E.D., Petersen B.L., Heilmann C.J., Hornsleth A. Prevalence of parvovirus B19 and parvovirus V9 DNA and antibodies in paired bone marrow and serum samples from healthy individuals. J. Clin. Microbiol. 2002. 40 (3). 933-6.
45. Kurtzman G.J., Cohen B.J., Field A.M., Oseas R., Blaese R.M., Young N.S. Immune response to B19 parvovirus infection and an antibody defect in persistent viral infection. J. Clin. Invest. 1989. 84 (4). 1114-23.
46. Chisaka H., Ito K., Niikura H., Sugawara J., Takano T., Murakami T., Terada Y., Okamura K., Shiroishi H., Sugamura K., Yaegashi N. Clinical manifestations and outcomes of parvovirus B19 infection duting pregnancy in Tohoku. J. Exp. Med. 2006. 209. 277-283.
47. Corcioli F., Zakrzewska K., Fanci R., De Giorgi V., Innocenti M., Rotellini M., Di Lollo S., Azzi A. Human parvovirus PARV4 DNA in tissues from adult individuals: a comparison with human parvovirus B19 (B19V). Virol. J. 2010. 7. 272. Mode of access. http://www.virologyj.com/content/7/1/272 568-1.
48. Young N.S., Brown K.E. Mechanisms of disease: Parvovirus. N. Engl. J. Med. 2004. 350 (6). 586-597.
49. Noyola D.E., Lourdes Padilla-Ruiz M., Guadalupe Obregón-Ramos M. et al. Parvovirus B19 infection in medical students during a hospital outbreak. J. Med. Microbiol. 2004. 53. 141-146.
50. Tolfvenstam T., Broliden K. Parvovirus B19 infection. Semin. Fetal. Neonatal. Med. 2009. 14 (4). 218-221.
51. Anderson L.J. Role of parvovirus B19 in human disease. Pediatr. Infect. Dis. 1987. 6. 711-718.
52. Koch W.C. Fifth (human parvovirus) and sixth (herpesvirus 6) diseases. Curr. Opin. Infect. Dis. 2001. 14. 343-356.
53. Nicolay N. et al. Clinical and epidemiological aspects of parvovirus B19 infections in Ireland, January 1996 — June 2008. Euro Surveill. 2009. 14. 1-5.
54. Valentin M.N., Cohen P.J. Pediatric Parvovirus B19: spectrum of clinical manifestations. Cutis. 2013. 92. 179-184.
55. Pavlovic M.D. Papular-purpuric «gloves and socks» syndrome caused by parvovirus B19. Vojnosanit Pregl. 2003. 60 (2). 223-225.
56. Heckler G.T., Dal Ri N.M.K., Almeida H.L. Jr. Case for diagnosis. An. Bras. Dermatol. 2012. 87 (5). 793-794.
57. Kumano K. Various clinical symptoms in human parvovirus B19 infection. Japanese Journal of Clinical Immunology. 2008. 31 (6). 448-453.
58. Muir K., Todd W.T., Watson W.H., Fitzsimons E. Viral-associated haemophagocytosis with parvovirus-B19-related pancytopenia. Lancet. 1992. 339. 1139-1140.
59. Poole B.D., Karetnyi Y.V., Naides S.J. Parvovirus B19-induced apoptosis of hepatocytes. Journal of virology. 2004. 78 (14). 7775-7783.
60. Bihari Ch., Rastogi A., Saxena P. et al. Parvovirus B19 associated hepatitis. Hindawi Publishing Corporation. Hepatitis Research and Treatment. 2013. Article ID 472027. 1-9.
61. Mihály I., Trethon A., Arányi Z. et al. Observations on human parvovirus B19 infection diagnosed in 2011. Orvosi Hetilap. 2012. 153 (49). 1948-1957. View at Google Scholar.
62. Sun L., Zhang J.-C. Acute fulminant hepatitis with bone marrow failure in an adult due to parvovirus B19 infection. Hepatology. 2012. 55 (1). 329-330.
63. Yang S.-H., Lin L.-W., Fang Y.-J., Cheng A.-L., Kuo S.-H. Parvovirus B19 infection-related acute hepatitis after rituximab-containing regimen for treatment of diffuse large B-cell lymphoma. Annals of Hematology. 2012. 91 (2). 291-294.
64. Hatakka A., Klein J., He R. et al. Acute hepatitis as a manifestation of parvovirus B19 infection. Journal of Clinical Microbiology. 2011. 49 (9). 3422-3424.
65. Kindermann I., Barth C., Mahfoud F. et al. Update on Myocarditis. Journal of the American College of Cardiology. 2012. 59 (9). 779-792.
66. Schultheiss H.-P., Kuhl U., Cooper L.T. The management of myocarditis. European Heart Journal. 2011; doi: 10.1093. 1-13.
67. Lotze U., Egerer R., Gluck B., Zell R., Sigusch H., Erhardt C., Heim A., Kandolf R., Bock T., Wutzler P., Figulla H.R. Low level myocardial parvovirus B19 persistence is a frequent finding in patients with heart disease but unrelated to ongoing myocardial injury. J. Med. Virol. 2010. 82. 1449-1457.
68. Schenk T., Enders M., Pollak S., Hahn R., Huzly D. High prevalence of human parvovirus B19 DNA in myocardial autopsy samples from subjects without myocarditis or dilative cardiomyopathy. J. Clin. Microbiol. 2009. 47. 106-110.
69. Barah F., Whiteside S. et al. Neurological aspects of human parvovirus B19 infection: a systematic review. J. Rev. Med. Virol. 2014 May. 24 (3). 154-68.
70. Douvoyiannis M., Litman N., Goldman D.L. Neurologic manifestations associated with Parvovirus B19 Infection. CID. 2009. 48 (15). 1713-1723.
71. Alger L.S. Toxoplasmosis and parvovirus B19. Infect. Dis. Clin. North Am. 1997. 11. 55-75.
72. Waring G.J. Parvovirus B19 infection. Timely diagnosis in pregnancy essential. Case Rep. Womens Health. 2018. 18. e00057. DOI: 10.1016/j.crwh.2018. e00057
73. Ornoy A., Ergaz Z. Parvovirus. B 19 infection during pregnancy and risks to the fetus. Birth. Defects Res. 2017. Mar 15. 109 (5). 311-323.
74. Courtier J., Schauer G.M., Parer J.T., Regenstein A.C., Callen P.W., Glenn O.A. Parvovirus. B19 infection during pregnancy and risks to the fetus. Ultrasound Obstet Gynecol. 2012. 40 (5). 604-6.
75. Röhrer C.I., Gärtner B., Sauerbrei A., Böhm, S., Hottenträger B., Raab U. et al. Seroprevalence of parvovirus B19 in the German population. Epidemiol. Infect. 2008. 136. 1564-1575.
76. Valeur-Jensen A.K., Pedersen C.B., Westergaard T., Jensen I.P., Lebech M., Andersen P.K. et al. Risk factors for parvovirus B19 infection in pregnancy. JAMA. 1999. 281. 1099-1105.
77. Centers for Disease Control (CDC). Risks associated with human parvovirus B19 infection. Morb. Mortal. Wkly. Rep. 1989. 38. 81-88 (93-7).
78. Gilbert N.L. et al. Seroprevalence of parvovirus B19 infection in daycare educators. Epidemiol. Infect. 2005. 133. 299-304.
79. Giorgio E., Antonietta De Oronzo M., Iozza I. Parvovirus B19 during pregnancy: a review. Journal of Prenatal Medicine. 2010. 4 (4). 63-66.
80. Schulert G.S., Walsh W.F., Weitkamp J.H. Polymicrogyria and congenital Parvovirus B19 infection. Am. J. Perinatol. Rep. 2011. 1. 105-110.
81. Crane J., Mundle W., Boucoiran I. Parvovirus B19 infection in pregnancy. 2014 Dec. 36 (12). 1107-1116.
82. Leduc L. SOGC Maternal-Fetal Medicine Committee. Stillbirth and bereavement: guidelines for stillbirth investigation. SOGC Clinical Practice Guidelines. J. Obstet. Gynaecol. Can. 2006. 28. 540-552.
83. Watt A.P., Brown M., Pathiraja M., Anbazhagan A., Coyle P.V. The lack of routine surveillance of parvovirus B19 infection in pregnancy prevents an accurate understanding of this regular cause of fetal loss and the risks posed by occupational exposure. J. Med. Microbiol. 2013. 62. 86-92.
84. Simms R.A., Liebling R.E., Patel R.R., Denbow M.L., Abdel-Fattah S.A., Soothill P.W. et al. Management and outcome of pregnancies with parvovirus B19 infection over seven years in a tertiary fetal medicine unit. Fetal. Diagn. Ther. 2009. 25. 373-378.
85. Enders M., Schalasta G., Baisch C., Weidner A., Pukkila L., Kaikkonen L. et al. Human parvovirus B19 infection during pregnancy-value of modern molecular and serological diagnostics. J. Clin. Virol. 2006. 35. 400-406.
86. Australasian Society for Infectious Diseases. Management of Perinatal Infection (2014). Available from: [https://www.asid.net.au/documents/item/368], last accessed Sept 13, 2018.
87. SOGC Clinical Practice guideline. Parvovirus B19 Infection in Pregnancy (2014). Available from: [https://sogc.org/wp-content/uploads/2014/12/gui3161012E.pdf], last accessed Sept 13, 2018.
88. Enders M., Weidner A., Zoellner I., Searle K., Enders G. Fetal morbidity and mortality after acute human parvovirus B19 infection in pregnancy: prospective evaluation of 1018 cases. Prenat. Diagn. 2004. 24. 513-518.
89. Matsuda H., Sakaguchi K., Shibasaki T., Takahashi H. et al. Intrauterine therapy for parvovirus B19 infected symptomatic fetus using B19 IgG-rich high titer gammaglobulin. J. Perinat. Med. 2005. 33 (6). 561-563.
90. Sarfraz A.A., Samuelsen S.O., Bruu A.L., Jenum P.A., Eskild A. Maternal human parvovirus B19 infection and the risk of fetal death and low birthweight: a case-control study within 35 940 pregnant women. BJOG. 2009. 116. 1492-8.
91. Smith J. Human parvovirus B19: a literature review and case study. Infant. 2008. 4 (5). 101-104.
92. de Haan T.R., van den Akker E.S., Porcelijn L., Oepkes D., Kroes A.C., Walther F.J. Thrombocytopenia in hydropic fetuses with parvovirus B19 infection: incidence, treatment and correlation with fetal B19 viral load: BJOG. 2008. 115. 76-81.
93. Adler S., Koch W.C. Human parvovirus B19. In: J.S. Remington, J.O. Klein (Eds). Infectious diseases of the fetus and newborn infant. 7th ed. Saunders, Philadelphia. 2010. 845 (5).
94. Cohen B. Parvovirus B19: an expanding spectrum of disease. BMJ. 1995. 311. 1549-1552.
95. Levy R., Weissman A., Blomberg G., Hagay Z.J. Infection by parvovirus B19 during pregnancy: a review. Obstet. Gynecol. Surv. 1997. 52. 254-259.
96. Segata M., Chaoui R., Khalek N., Bahado-Singh R., Paidas M.J., Mari G. Fetal thrombocytopenia secondary to parvovirus infection. Am. J. Obstet. Gynecol. 2007. Jan. 196 (1). 61. e1-4.
97. Enders M., Weidner A., Zoellner I., Searle K., Enders G. Fetal morbidity and mortality after acute human parvovirus B19 infection in pregnancy: prospective evaluation of 1018 cases. Prenat. Diagn. 2004 Jul. 24 (7). 513-8.
98. Markenson G.R., Yancey M.K. Parvovirus B19 infections in pregnancy. Semin. Perinatol. 1998. 22. 309-317.
99. Barton L.L., Lax D., Shehab Z.M., Keith J.C. Congenital cardiomyopathy associated with human parvovirus B19 infection. Am. Heart J. 1997. 133. 131-133.
100. Enders M., Weidner A., Rosenthal T., Baisch C., Hedman L., Söderlund-Venermo M., Hedman K. Improved diagnosis of gestational parvovirus B19 infection at the time of nonimmune fetal hydrops. J. Infect. Dis. 2008. 197. 58-62.
101. Health Protection Agency Rash Guidance Working Group. Guidance on viral rash in pregnancy: investigation, diagnosis and management of viral rash illness, or exposure to viral rash illness, in pregnancy. Health Protection Agency, London. 2011.
102. Miller E., Fairley C.K., Cohen B.J., Seng C. Immediate and long term outcome of human parvovirus B19 infection in pregnancy. Br. J. Obstet. Gynaecol. 1998. 105. 174-178.
103. Nyman M., Tolfvenstam T., Petersson K., Krassny C., Skjöldebrand-Sparre L., Broliden K. Detection of Human Parvovirus B19 Infection in First-Trimester Fetal Loss. Obstetrics & Gynecology. 2002. 99 (5). Part 1. 795-798.
104. von Kaisenberg C.S., Jonat W. Fetal parvovirus B19 infection. Ultrasound. Obstet. Gynecol. 2001. 18. 280-288.
105. Rodis J.F. Parvovirus infection. Clin. Obstet. Gynecol. 1999. 42. 107-120 (quiz 174-5).
106. Barrett J., Ryan G., Morrow R., Farine D., Kelly E., Mahony J. Human parvovirus B19 during pregnancy. J. Soc. Obstet. Gynaecol. Can. 1994. 16. 1253-1258.
107. Borna S., Mirzaie F., Hanthoush-Zadeh S., Khazardoost S., Rahimi-Sharbaf F. Middle cerebral artery peak systolic velocity and ductus venosus velocity in the investigation of nonimmune hydrops. J. Clin. Ultrasound. 2009. 37. 385-388.
108. Chauvet A., Dewilde A., Thomas D., Joriot S., Vaast P., Houfflin-Debarge V. et al. Ultrasound diagnosis, management and prognosis in a consecutive series of 27 cases of fetal hydrops following maternal parvovirus B19 infection. Fetal. Diagn. Ther. 2011. 30. 41-47.
109. Delle Chiaie L., Buck G., Grab D., Terinde R. Prediction of fetal anemia with Doppler measurement of the middle cerebral artery peak systolic velocity in pregnancies complicated by maternal blood group alloimmunization or parvovirus B19 infection. Ultrasound Obstet Gynecol. 2001. 18. 232-236.
110. Morgan-Capner P. Guidelines on the management of, and exposure to, rash illness in pregnancy (including consideration of relevant antibody screening programmes in pregnancy). Commun. Dis. Public Health. 2002. 5. 59-71.
111. Koppelman M.H.G.M. et al. Quantitative real-time detection of parvovirus B19 DNA in plasma. Transfusion. 2004. 44. 97-103.
112. Rodis J.F., Hovick T.J. Jr., Quinn D.L., Rosengren S.S., Tattersall P. Human parvovirus infection in pregnancy. Obstet. Gynecol. 1988. 72. 733-738.
113. Bernstein D.I., Sahly H., Keitel W.A. et al. Safety and immunogenicity of a candidate Parvovirus B19 vaccine. Vaccine. 2011. 29 (43). 7357-7363.
114. Pickering L.K., Baker C.J., Kimberlin D.W. et al. Parvovirus B19. Report of the Committee on Infectious Diseases. American Academy of Pediatrics. 2009. 491-494.

/20-1.jpg)
/21-1.jpg)
/22-1.jpg)